实验性变态反应性脑脊髓炎小鼠胸腺中MOG特异性胸腺细胞分化机制探讨
张俊华,高云,马卫国,许青霞
(郑州大学附属肿瘤医院 检验科,郑州 450008)
实验性变态反应性脑脊髓炎(experimental autoimmune encephalomyelitis,EAE)是多发性硬化(multiple sclerosis,MS)的理想动物模型[1]。MS是主要由T细胞介导的自身免疫性疾病,其中CD4+T细胞在疾病发展过程中发挥重要作用[2],同时CD8+T细胞甚至B细胞在EAE发病过程中的作用也逐渐被发现[3]。胸腺是T细胞分化发育成熟的主要器官[4],T细胞在胸腺内的分化发育可分为3个阶段:即CD4CD8双阴性(double negative,DN)细胞阶段;CD4CD8双阳性(double positive,DP)细胞阶段;CD4单阳性(CD4 single positive,CD4SP)或CD8单阳性(CD8 single positive,CD8SP)细胞阶段,它们是由DP细胞经阳性和阴性选择而分化发育成熟的具有免疫功能的T细胞。已有研究发现,存在胸腺的EAE小鼠在发病高峰期后会有自发恢复期,而摘除胸腺的EAE小鼠将缺失自发恢复期,此现象提示胸腺对EAE小鼠具有免疫调节作用[5-6]。因为关于胸腺对EAE发病机制作用的报道甚少,本研究将探索EAE小鼠胸腺细胞亚群变化,以阐述EAE小鼠髓鞘少突胶质细胞糖蛋白(myelin oligodendrocyte glycoprotein,MOG)特异性胸腺细胞的分化机制,进而为EAE的发病机制研究提供理论依据。
1 材料与方法
1.1 材料6~8周龄C57BL/6小鼠25只,体质量20~25 g,购自北京维通利华实验动物技术有限公司,饲养在中美(河南)荷美尔肿瘤研究院SPF级动物房中。MOG35-55(肽序列:Met-Glu-Val-Gly-Trp-Tyr-Arg-Ser-Pro-Phe-Ser-Arg-Val-Val-His-Leu-Tyr-Arg-Asn-Gly-Lys),纯度98%,购于上海吉尔生化公司;弗氏完全佐剂(complete Freund's adjuvant,CFA,灭活结核分枝杆菌含量5 mg/mL)购于上海三踏生物科技有限公司;百日咳毒素(pertussis toxin,PT)购于北京联立信生物技术有限责任公司;大鼠抗小鼠抗体CD4-FITC、CD8-PE购于eBioscience公司;Annexin Ⅴ/碘化丙啶(propidium iodide,PI)凋亡试剂盒购于生工生物工程(上海)股份有限公司;BD FACS Calibur 流式细胞仪购于美国BD公司。
1.2 方法
1.2.1 EAE模型的构建及临床评分 对21只C57BL/6小鼠两点背部皮下免疫200 μL乳化剂(5 mg/mL CFA与1.5 mg/mL MOG按照1∶1比例配制,使用乳化管反复推拉混匀,形成油包水样的乳剂)。免疫后第0和2天经小鼠尾静脉注射PT稀释液(200 μL/只,PT试剂2 μL稀释于PBS缓冲液中)[7]。记录小鼠的临床评分,评分标准如下:0,正常小鼠;0.5,尾巴部分瘫痪;1,尾巴完全瘫痪;1.5,一后肢无力;2,两后肢均无力;2.5,一后肢瘫痪,一后肢无力;3,两后肢均瘫痪;3.5,前肢无力;4,一前肢无力,一前肢瘫痪;4.5,前肢完全瘫痪;5,死亡。同时对3只对照组小鼠皮下注射PBS。
1.2.2 胸腺单细胞悬液的获取 EAE诱导后第0、5、10、15天各取3只小鼠,颈椎脱臼处死,打开小鼠胸腔暴露心脏上方白色的胸腺,从根部摘除,观察胸腺大小。使用剪刀将小鼠的胸腺剪碎,使用研磨棒研磨胸腺组织块,充分研磨后用70 μm滤网过滤,2 009×g离心5 min,弃上清液,PBS重悬获得单个胸腺细胞悬液备用。用同样的方法获取3只PBS对照小鼠及临床评分分别为0、1、3.5的小鼠胸腺细胞,并在倒置显微镜下使用计数板计数胸腺细胞。
1.2.3 凋亡检测和FACS分析 按照1.5×106/管的检测量取胸腺细胞悬液,并根据Annexin Ⅴ/PI试剂盒的操作步骤进行凋亡检测,标记大鼠抗小鼠抗体CD4-FITC、CD8-PE,使用FlowJo软件分析胸腺细胞凋亡情况和胸腺细胞亚群DN、DP、CD4SP、CD8SP细胞的比例变化。
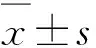
2 结果
2.1 胸腺细胞数与EAE病程的关系EAE诱导第9~10天小鼠开始发病并呈现相应的临床症状,第15天左右小鼠发病达到高峰,第20~22天小鼠症状开始部分缓解(图1A);根据EAE病程,选取具有代表性的4个时间点:EAE诱导后第0天(对照),第5天(发病前期),第10天(发病起始期),第15天(发病高峰期)。计数4组小鼠胸腺细胞数,结果显示,在EAE诱导后第5天胸腺细胞数显著升高,第10天和第15天又逐渐降低,其中在发病高峰期的第15天胸腺细胞数最低(图1B)。

注:A.EAE诱导后临床评分;B.EAE诱导后第0、5、10、15天胸腺细胞数。与第0天组比较,*P<0.05,**P<0.01。图1 胸腺细胞数与EAE小鼠病程的关系
2.2 胸腺细胞数与EAE临床评分的相关性与PBS组比较,0临床评分组小鼠胸腺细胞数显著升高(P<0.05),且0、1、3.5临床评分组小鼠间的胸腺细胞数差异具有统计学意义(P<0.05,表1)。

表1 PBS组小鼠和临床评分0、1、3.5组小鼠胸腺细胞数的比较
2.3 胸腺细胞亚群凋亡分析EAE诱导后第5天胸腺细胞凋亡率开始升高,第10天凋亡率最高,达到8%左右,并且与第0天比较,差异具有统计学意义(P<0.005),然而第15天又急剧下降至第0天的水平(图2A)。另外,对凋亡率最高的第10天小鼠进行胸腺细胞亚群凋亡率分析,发现凋亡率最高的是DP细胞,CD4SP、CD8SP细胞次之,DN细胞最低(图2C),且其他3类细胞凋亡率与DP细胞凋亡率差异均具有统计学意义(P<0.05,图2B)。

注:A.4组小鼠胸腺细胞凋亡比例;B~C.DN、DP、CD4SP、CD8SP细胞亚群的凋亡分析。*P<0.05。图2 胸腺细胞凋亡分析
2.4 EAE诱导后胸腺细胞亚群分析DN、CD4SP、CD8SP细胞在EAE诱导后比例逐渐升高,DP细胞则逐渐降低(P<0.05,图3)。

注:A.4组小鼠胸腺细胞亚群流式分析;B.4组小鼠胸腺细胞亚群统计分析。第0、5、10、15天4组小鼠比较,*P<0.05。图3 EAE诱导后胸腺细胞亚群分析
3 讨论
MS是一种免疫系统介导的中枢神经系统脱髓鞘疾病[8-9],其中髓鞘主要浸润细胞为T细胞[10]。用于MS研究最广泛的动物模型是EAE大鼠或小鼠,其主要致病细胞是Th1和Th17[11],但EAE潜在的发病机制尚不清楚。胸腺是重要的淋巴器官之一,骨髓来源的祖细胞在这里经历增殖分化,最终产生功能性T细胞[12]。另外,胸腺是控制器官特异性的自身免疫中心,既通过阳性选择获得MHC限制性,也通过阴性选择获得自身免疫耐受性[13]。有研究发现,切除新生豚鼠的胸腺可以防止或明显延迟EAE症状的出现[14];相似的,有研究证实T细胞是产生EAE体征和组织学损伤所必需的[15],综上可知,MS患者的胸腺功能可能发生了变化。为了更好地阐述EAE诱导后胸腺发生的变化,尤其是胸腺来源MOG特异性T细胞的变化,本研究分析了4个病程时间点——EAE诱导后第0天(对照)、第5天(发病前期)、第10天(发病起始期)和第15天(发病高峰期)的胸腺细胞变化,主要是胸腺细胞亚群变化及凋亡情况,这些对胸腺细胞在EAE诱导后的增殖分化过程的研究将有助于EAE发病机制的阐明。
本研究发现,在EAE诱导后第5天胸腺细胞数显著升高,第10天和第15天又明显下降,可以认为小鼠在诱导物MOG抗原的早期作用下先动员了胸腺细胞的增殖分化。另外本研究发现,临床评分越高的小鼠胸腺细胞数越低,这与很多学者证实的EAE小鼠胸腺萎缩结论相一致[5],在其他MS模型中也有发现胸腺萎缩,如大鼠EAE模型[16]、患有原发性进展性EAE的A.SW小鼠[17]等。因为胸腺是T细胞分化发育成熟的器官[18],在胸腺细胞中,DP细胞通过阳性选择分化发育为单阳性细胞,而未通过阳性选择的DP细胞全部凋亡,故进一步研究胸腺细胞的凋亡情况。本研究发现,EAE诱导后胸腺细胞凋亡率开始升高,在EAE诱导后第10天凋亡率达到最高,第15天又下降。另外,本研究还发现,凋亡率最高的第10天小鼠其主要凋亡细胞亚群是DP细胞。这一数据说明,EAE诱导后至发病起始期胸腺细胞中DP细胞的阳性选择进程加快,也就是胸腺细胞分化发育成熟为MOG特异性效应T细胞的速度加快。为了进一步获得EAE诱导后胸腺细胞亚群的动态变化,本研究利用FACS发现,除了DP细胞比例在EAE诱导后逐渐减少,DN、CD4SP、CD8SP细胞的比例在EAE诱导后都逐渐升高,这一数据也与前面DP细胞凋亡最严重的结果相一致。
综上所述,EAE诱导后至发病初始阶段胸腺细胞中MOG特异性胸腺细胞增殖加快,凋亡率增加,其可能机制为在疾病发生之前MOG抗原通过加速对胸腺内DP细胞的阳性选择来产生更多MOG特异性效应T细胞,这些细胞随着疾病的进展最终迁移至致病部位并表现出相应的临床症状。本研究能够详细地描述EAE诱导后MOG特异性胸腺细胞亚群的动态变化,可为阐述EAE发病机制提供帮助。

