MUS81基因多态性与EBV相关肿瘤的相关性
赵帅 张勇 刘雯 张岩
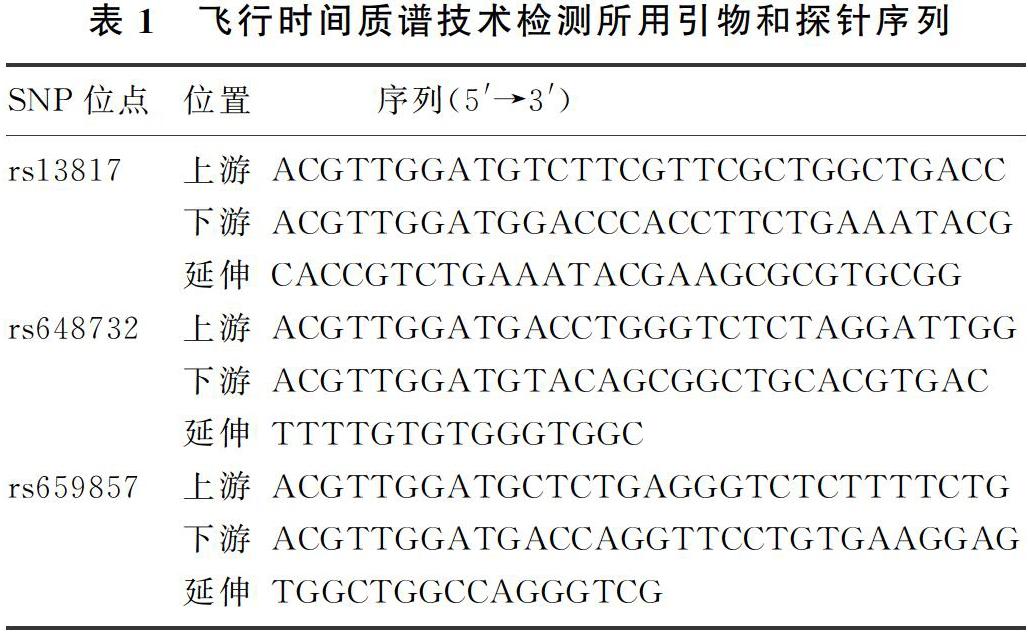
[摘要] 目的 探讨MUS81基因多位点单核苷酸多态性与EB病毒(EBV)相关肿瘤的关系。方法 采用飞行时间质谱技术,分别检测鼻咽癌、淋巴瘤、胃癌等肿瘤组织和正常对照人群外周血MUS81基因rs13817、rs648732、rs659857位点基因型,并分别分析EBV阳性肿瘤、EBV阴性肿瘤、正常对照人群MUS81基因上述位点基因型和等位基因频率的差异。结果 EBV阳性胃癌rs13817位点基因型AA、等位基因A和rs648732位点等位基因T频率均明显高于正常对照(χ2=4.917~6.802,P<0.05);EBV阳性胃癌和鼻咽癌rs659857位点TC基因型频率明显低于正常对照和(或)相应的EBV阴性肿瘤(χ2=14.759~28.741,P<0.01),EBV阳性和阴性淋巴瘤rs659857位点TC基因型频率明显低于正常对照(χ2=14.124、16.455,P<0.01)。结论 MUS81基因rs13817、rs648732和rs659857位点多态性与EBV相关肿瘤存在相关性,是其潜在的风险因素。
[关键词] MUS81基因;多态性,单核苷酸;胃肿瘤;鼻咽癌;淋巴瘤;疱疹病毒4型,人
[中图分类号] R394.25;R73
[文献标志码] A
[文章编号] 2096-5532(2021)04-0555-04
EB病毒(EBV)属人类疱疹病毒4型,感染全球超过95%的成年人[1]。EBV感染与多种人类肿瘤的发生密切相关,如伯基特淋巴瘤、霍奇金淋巴瘤、鼻咽癌、胃癌等[2-3]。EBV相关肿瘤组织中,几乎所有的肿瘤细胞均可检测到EBV基因组,且其末端重复序列的数目均相同,提示EBV感染发生在肿瘤形成的早期[4],但EBV诱导肿瘤形成的细胞及分子机制尚不明了。诱导宿主细胞基因组的不稳定是EBV相关肿瘤发生发展的关键因素,EBV潜伏感染往往伴随着DNA损伤修复失调引起的非克隆性染色体异常[5-6]。MUS81基因是新近发现的重要的DNA损伤修复基因,在乙烷磺酸盐和紫外线引起的DNA损伤的识别、修复以及维持DNA复制稳定中发挥着重要的作用[7]。多项研究证实,MUS81基因异常表达与多种人类肿瘤的发生发展密切相关[8-10]。基因多态性,如单核苷酸多态性(SNP),可能通过对DNA损伤修复基因的调控影响不同个体对肿瘤的易感性而导致相关肿瘤的发生[11],已被广泛用作诊断和评估某些疾病和肿瘤风险及预后的生物标记物。但目前尚未见MUS81基因多态性与胃癌、鼻咽癌、淋巴瘤及病毒感染相关性报道。因此,本研究选取3个MUS81基因高突变多态性位点进行检测分析,探讨其与EBV相关肿瘤的相关性。
1 材料与方法
1.1 组织标本
本研究所用胃癌、鼻咽癌、淋巴瘤肿瘤标本共计403例,均来自青岛大学附属医院和青岛市市立医院病理科,包括胃癌组织标本158例,病人男136例,女22例,平均年龄(56.39±11.33)岁;鼻咽癌组织标本104例,病人男76例,女28例,平均年龄(46.24±15.01)岁;淋巴瘤组织标本141例,病人男83例,女58例,平均年龄(46.71±18.89)岁。所有标本均经病理学检查确诊。随机选取113例健康成人乙二胺四乙酸(EDTA)抗凝外周血5 mL作为正常对照(NC),经离心分离取单核细胞并提取DNA备用。
1.2 EBV阳性肿瘤的鉴定
采用原位杂交技术检测石蜡包埋组织标本中EBV编码小RNA1(EBER1),EBER1特异性寡核苷酸反义探针(AGACACCGTCCTCACCACCCG-GGACTTGTA)参考文献方法设计并由Roche公司合成[12]。采用Roche公司Dig Oligonucleotide 3′-end Labeling kit标记,阳性者为EBV阳性标本。
1.3 DNA提取
采用蛋白酶K消化和酚-氯仿法提取外周血与新鲜组织标本DNA,石蜡包埋组织DNA抽提试剂盒(QIAGEN,德国)提取石蜡包埋组织的DNA。采用NanoPhotometer P360(IMPLEN,德国)检测各样本DNA浓度和纯度,所有样本DNA浓度需介于0.05~0.50 g/L之间,以满足飞行时间质谱技术检测要求。
1.4 基因多态性检测
所有DNA样本均送华大基因公司,采用飞行时间质谱技术检测MUS81基因rs13817、rs648732和rs659857位点的基因型,引物序列和延长探针序列见表1。
1.5 统计学分析
应用SPSS 24.0(IBM)軟件进行统计学分析。数据间比较采用卡方检验和Fisher精确概率检验(双侧),以P<0.05为差异有显著性。用比值比(OR)和95%置信区间(CI)表示等位基因的风险系数。
2 结 果
本研究EBER1原位杂交筛选出EBV阳性胃癌(EBVaGC)48例、EBV阳性鼻咽癌(EBVaNPC)49例和EBV阳性淋巴瘤(EBVaL)93例。本研究对照组中MUS81基因3个SNP位点的基因频率均符合Hardy-Weinberg平衡(P>0.05)。
2.1 rs13817位点与胃癌、鼻咽癌和淋巴瘤相关性
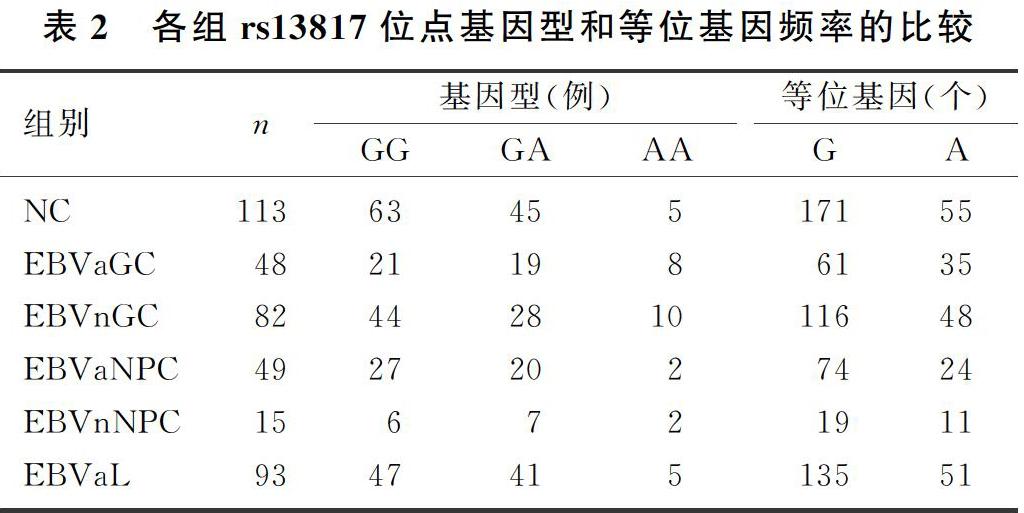
EBVaGC rs13817位点基因型分布与NC相比差异有显著性(χ2=7.183,P<0.05),EBVaGC基因型AA的频率(16.67%)较NC明显升高(OR=4.320,95%CI=1.334~13.986,P=0.009),而其他组间比较差异均无统计学意义(P>0.05),提示基因型AA可能是EBVaGC的危险因素。EBVaGC rs13817位点等位基因A的频率显著高于NC(χ2=4.917,P<0.05),而EBV阴性胃癌(EBVnGC)与NC比较以及EBVaGC与EBVnGC比较差异均无显著意义(P>0.05),结果提示等位基因A可能是EBVaGC危险因素。EBVaNPC、EBV阴性鼻咽癌(EBVnNPC)、EBVaL和NC各组比较,rs13817位点基因型和等位基因频率差异均无显著性(P>0.05)。见表2。
2.2 rs648732位点与胃癌、鼻咽癌和淋巴瘤相关性
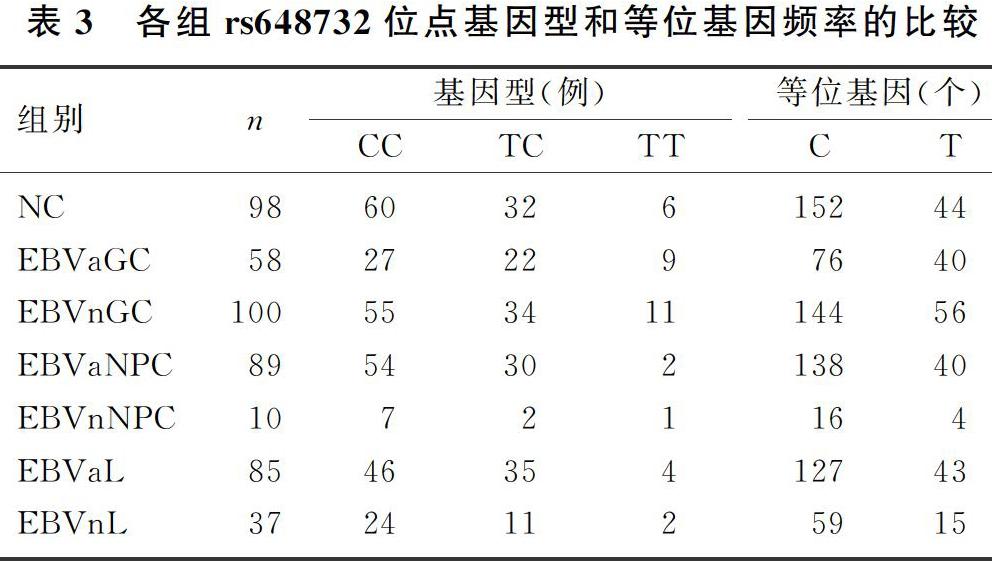
EBVaGC、EBVnGC、EBVaNPC、EBVnNPC、EBVaL、EBV阴性淋巴瘤(EBVnL)与NC相比较,rs648732位点基因型分布差异均无显著性(P>0.05)。EBVaGC T等位基因的频率显著高于NC(OR=1.818,95%CI=1.093~3.025,P=0.021),提示rs648732位点等位基因T可能是EBVaGC的危险因素。见表3。
2.3 rs659857位点与胃癌、鼻咽癌和淋巴瘤相关性
本研究EBVaGC rs659857位点基因型分布与EBVnGC、NC比较差异均有显著意义(χ2=25.077、28.741,P<0.01),其杂合基因型TC明显缺失。EBVaNPC TC基因型频率低于NC(χ2=14.759,P<0.01),与EBVnNPC比较差异无显著性(P>0.05)。EBVaL和EBVnL TC基因型频率与NC比较差异均有显著性(χ2=14.124、16.455,P<0.01),而EBVaL与EBVnL比较则差异无显著意义(P>0.05)。上述结果提示,杂合基因型TC减少可能为上述肿瘤的危险因素。EBVaNPC、EBVaL、EBVnL的T等位基因频率均明显高于NC(χ2=7.141~9.416,P<0.01),提示等位基因T可能为上述肿瘤的危险因素。见表4。
3 讨 论
肿瘤的形成受多种因素的影响,例如微生物因素、个体的易感性、毒物、生活习惯等,基因不稳定也是其中一个重要的因素。诱导宿主细胞基因组的不稳定是EBV相关肿瘤发生发展的关键因素,EBV潜伏感染过程中往往伴随着DNA损伤修复失调引起的染色体异常[5-6]。研究证实,重要的DNA损伤修复基因SNP对个体肿瘤的易感性有重要的影响[11,13]。LOIZIDOU等[14]研究表明,MUS81基因rs545500位点的SNP可使该位点的氨基酸从精氨酸变成脯氨酸残基,能够提示乳癌发生的高风险。有文献报道,部分位点的SNP能够增加病毒感染的风险,是某些病毒相关疾病的危险因素[15-16]。
本研究结果显示,EBVaGC rs13817位点基因型AA和等位基因A频率明显高于正常对照,提示两者可能是EBVaGC的危险因素。同样,EBVaGC rs648732位点等位基因T频率明显高于正常对照,提示该位点等位基因T可能为EBVaGC的危险因素。胃癌发生与基因多态性的关系已有文献报道[17-18],而近年来,亦有胃癌基因多态性与EBV感染相关性的研究报道[19-20]。EBVaGC的发病机制和临床病理特征均异于EBVnGC,EBV潜伏感染是其重要致病机制。本文结果表明,MUS81基因多态性与EBV相关胃癌的发生发展相关。本研究未显示MUS81基因rs13817、rs648732位点多态性与鼻咽癌、淋巴瘤及其EBV潜伏感染有明显相关性。
本文结果还显示,在EBVaGC及EBVaNPC中,MUS81基因rs659857位点杂合基因型TC明显减少,而在EBV阳性和阴性淋巴瘤中均存在此现象,提示在EBV相关上皮细胞性肿瘤中,rs659857位点与EBV潜伏感染密切相关,而在淋巴细胞性肿瘤中则与EBV感染无关。推测这种现象可能与肿瘤的发病机制不同相关,鼻咽癌和胃癌为上皮细胞性肿瘤,而淋巴瘤为淋巴细胞性肿瘤,且其分型较多,发病机制复杂[21-23]。目前已有多项研究结果表明,SNP可能参与淋巴瘤的形成且與EBV潜伏感染密切相关[24]。HLA-DPB1基因附近rs6457715位点的多态性与霍奇金淋巴瘤及EBV潜伏感染相关,该区域可能是一个新的霍奇金淋巴瘤易感位点[25]。特殊位点的杂合型缺失能够引起某些抑癌基因的失活从而参与肿瘤的发生发展[26]。尽管这种杂合型缺失在多种实体肿瘤中被发现,但具体的分子机制仍不清楚。依据本研究结果,推测在上皮细胞性肿瘤鼻咽癌和胃癌中,rs659857位点的杂合型缺失与EBV的潜伏感染可能共同作用参与肿瘤的发生。
综上所述,本研究首次探讨了MUS81基因多个位点的多态性与EBV相关肿瘤的相关性,结果表明,rs13817、rs648732和rs659857位点多态性与EBV相关肿瘤存在相关性,MUS81基因的多态性可作为EBV相关肿瘤的标志物。
[参考文献]
[1]YOUNG L S, RICKINSON A B. Epstein-Barr virus: 40 years on[J]. Nature Reviews Cancer, 2004,4(10):757-768.
[2]DANILOVA N V, MALKOV P G, OLEYNIKOVA N A, et al. Epstein-Barr virus-associated gastric adenocarcinoma[J]. Arkhiv Patologii, 2019,81(3):74-83.
[3]AYEE R, OFORI M E O, WRIGHT E, et al. Epstein Barr virus associated lymphomas and epithelia cancers in humans[J]. Journal of Cancer, 2020,11(7):1737-1750.
[4]RAAB-TRAUB N, FLYNN K. The structure of the termini of the Epstein-Barr virus as a marker of clonal cellular proliferation[J]. Cell, 1986,47(6):883-889.
[5]KAMRANVAR S A, GRUHNE B, SZELES A, et al. Epstein-Barr virus promotes genomic instability in Burkitts lymphoma[J]. Oncogene, 2007,26(35):5115-5123.
[6]RAPTIS S, BAPAT B. Genetic instability in human tumors[J]. EXS, 2006(96):303-320.
[7]INTERTHAL H, HEYER W D. MUS81 encodes a novel helix-hairpin-helix protein involved in the response to UV- and methylation-induced DNA damage in Saccharomyces cerevisiae[J]. Molecular & General Genetics: MGG, 2000,263(5):812-827.
[8]LU R Q, XIE S H, WANG Y C, et al. MUS81 participates in the progression of serous ovarian cancer associated with dysfunctional DNA repair system[J]. Frontiers in Oncology, 2019,9:1189.
[9]ZHONG A L, ZHENG H, ZHANG H Q, et al. MUS81 inhibition increases the sensitivity to therapy effect in epithelial ovarian cancer via regulating CyclinB pathway[J]. Journal of Cancer, 2019,10(10):2276-2287.
[10]XIE S H, ZHENG H, WEN X M, et al. MUS81 is associated with cell proliferation and cisplatin sensitivity in serous ovarian cancer[J]. Biochemical and Biophysical Research Communications, 2016,476(4):493-500.
[11]LIN Y, CHAHAL H S, WU W T, et al. Association study of genetic variation in DNA repair pathway genes and risk of ba-sal cell carcinoma[J]. International Journal of Cancer, 2017,141(5):952-957.
[12]LOPES L F, BACCHI M M, ELGUI-DE-OLIVEIRA D, et al. Epstein-Barr virus infection and gastric carcinoma in Sǎo Paulo State, Brazil[J]. Revista Brasileira De Pesquisas Medicas e Biologicas, 2004,37(11):1707-1712.
[13]GOODE E L, ULRICH C M, POTTER J D. Polymorphisms in DNA repair genes and associations with cancer risk[J]. Cancer Epidemiol Biomarkers Prev, 2002,11(12):1513-1530.
[14]LOIZIDOU M A, CARIOLOU M A, NEUHAUSEN S L, et al. Genetic variation in genes interacting with BRCA1/2 and risk of breast cancer in the Cypriot population[J]. Breast Can-cer Research and Treatment, 2010,121(1):147-156.
[15]AL-ANAZI M R, MATOU-NASRI S, ABDO A A, et al. Variations in DEPDC5 gene and its association with chronic hepatitis C virus infection in Saudi Arabia[J]. BMC Infectious Diseases, 2014,14(1):1-9.
[16]JUNG S W, PARK N H, SHIN J W, et al. Polymorphisms of DNA repair genes in Korean hepatocellular carcinoma patients with chronic hepatitis B: possible implications on survival[J]. Journal of Hepatology, 2012,57(3):621-627.
[17]WU X J, MI Y Y, YANG H, et al. Association of the hsa-mir-499 (rs3746444) polymorphisms with gastric cancer risk in the Chinese population[J]. Onkologie, 2013,36(10):573-576.
[18]WANG K, KAN J S, YUEN S T, et al. Exome sequencing identifies frequent mutation of ARID1A in molecular subtypes of gastric cancer[J]. Nature Genetics, 2011,43(12):1219-1223.
[19]WANG J Y, LIU W, ZHAO Z Z, et al. Association of the aquaporin 3 gene polymorphism (rs2231231) with Epstein-Barr virus-associated cancers in China[J]. Intervirology, 2018,61(2):72-78.
[20]YANG Y, LIU W, ZHAO Z Z, et al. Filaggrin gene polymorphism associated with Epstein-Barr virus-associated tumors in China[J]. Virus Genes, 2017,53(4):532-537.
[21]VOCKERODT M, YAP L F, SHANNON-LOWE C, et al. The Epstein-Barr virus and the pathogenesis of lymphoma[J]. The Journal of Pathology, 2015,235(2):312-322.
[22]MURRAY P G, YOUNG L S. An etiological role for the Epstein-Barr virus in the pathogenesis of classical Hodgkin lymphoma[J]. Blood, 2019,134(7):591-596.
[23]HEALY J A, DAVE S S. The role of EBV in the pathogenesis of diffuse large B cell lymphoma[J]. Current Topics in Microbiology and Immunology, 2015,390(Pt 1):315-337.
[24]JOHNSON P C, MCAULAY K A, MONTGOMERY D, et al. Modeling HLA associations with EBV-positive and-negative Hodgkin lymphoma suggests distinct mechanisms in disease pathogenesis[J]. International Journal of Cancer, 2015,137(5):1066-1075.
[25]DELAHAYE-SOURDEIX M, URAYAMA K Y, GABORIEAU V, et al. A novel risk locus at 6p21.3 for Epstein-Barr virus-positive Hodgkin lymphoma[J]. Cancer Epidemio-logy, Biomarkers & Prevention, 2015,24(12):1838-1843.
[26]LASKO D, CAVENEE W, NORDENSKJOLD M. Loss of constitutional heterozygosity in human cancer[J]. Annu Rev Genet, 1991,25:281-314.
(本文編辑 马伟平)

