不同治疗方法对肝门部胆管癌预后的影响
孙嵩 曹广华 仲灏辰 冯玉杰 孙兆伟 张炳远

[摘要] 目的 探讨不同的治疗方法对肝门部胆管癌(HCCA)病人预后的影响。方法 回顾性分析我院2006—2015年收治的366例HCCA病人的临床资料,并根据治疗方法将病人分为根治性切除组、非根治性切除组和单纯减黄组。使用Kaplan-Meier生存曲线进行生存分析,并使用Cox比例风险模型评估HCCA的独立预后因素。结果 根治性切除组(115例)、非根治性切除组(97例)以及单纯减黄组(154例)病人的1年生存率分别为71.7%、52.5%和35.3%,2年生存率分别为52.2%、25.8%和7.8%,3年生存率分别为36.7%、8.9%和0;中位生存期分別为23.6、14.7和9.7个月。3组病人的1、2、3年生存率及中位生存期比较差异均有统计学意义(χ2=34.31~64.55,P<0.001)。多因素分析显示,治疗方法、清蛋白、总胆红素、术后病理T分期和远处转移等为HCCA的独立预后指标。结论 根治性切除可显著提高HCCA病人的生存率,提高清蛋白水平和降低总胆红素水平可以改善HCCA病人的预后。
[关键词] Klatskin肿瘤;外科手术;预后;影响因素分析
[中图分类号] R735.7;R657.43
[文献标志码] A
[文章编号] 2096-5532(2021)04-0481-06
肝门部胆管癌(HCCA),也称为Klatskin瘤,是一种累及肝总管、左右肝管以及肝管汇合部分的肿瘤[1-3]。由于其特殊的生长位置、较低的切除率和较低的5年生存率,HCCA对于临床医生来说是一个颇具挑战性的难题[4-6]。根治性切除可以延长HCCA病人生存期,从而使5年生存率达到20%~40%[7-10],但是大多数病人由于肿瘤位置较高或者已侵犯周围血管神经,因此在诊断明确后不宜行根治性切除,故这些病人需行非根治性切除、内镜逆行胆管置管引流(ERBD)或者经皮经肝胆管置管引流(PTCD)[8,11-12]。上述方法对HCCA病人生存的影响仍存在争议[13]。此外,影响HCCA病人生存的预后因素也存在争议。因此,本研究回顾性分析了2006年1月1日—2015年12月31日在我院接受治疗的366例HCCA病人的临床资料,探讨不同治疗方法对HCCA病人预后的影响。
1 资料和方法
1.1 一般资料
回顾性收集我院2006年1月1日—2015年12月31日收治的366例HCCA病人的临床资料。本文366例病人,男233例,女133例;中位年龄60岁;平均住院时间16 d。所有病人均接受了上腹部增强CT、胰胆管造影磁共振成像(MRCP)和肝功能等术前检查。伴有糖尿病、高血压、冠状动脉粥样硬化性心脏病等内科基础疾病的病人44例。根据有关文献重度饮酒和吸烟的诊断标准[14],有重度饮酒史者41例,有重度吸烟史者70例。本研究经青岛大学附属医院伦理委员会审查批准,所有研究对象均同意在科学研究中使用其医学信息。
1.2 纳入标准
①病人首次诊断为HCCA,且之前未行其他治疗;②病人后续随访信息可获得;③组织病理学结果、实验室检查结果、影像学检查结果等资料可获得;④排除伴有重度心脑血管、肾脏、肺部基础疾病及重度自身免疫性疾病的病人;⑤排除仅接受剖腹探查及腹腔镜下探查并取活检的病人。
1.3 病人分组
将病人分为3组:根治性切除组115例,非根治性切除组97例,单纯减黄组154例。根治性切除定义为手术切缘的肉眼观察及病理学结果皆为阴性(R0切除)。本文根治性切除组中,有110例病人术中根据Bismuth-Corlette分型进行了肝切除术。非根治性切除定义为术后病理结果提示切缘阳性(R1切除,54例)和肉眼观察及病理结果皆提示切缘阳性(R2切除,43例)。单纯减黄组病人的治疗方式有两种,包括ERBD(胆管支架通常是塑料的,术中平均置入的支架数量为每人2枚)和PTCD(放置引流管的平均数量为每人1根)[15]。
1.4 随访情况
随访主要包括电话联系和门诊复查随访,在必要时可进行信函和户籍查询。在最初的2年中,每3个月对病人进行一次随访,之后的随访周期为6个月。门诊复查常规行血癌胚抗原(CEA)和糖类抗原19-9(CA19-9)、消化系统超声、上腹部CT平扫等检查,若考虑肿瘤复发时,再行增强CT、MRI等检查,以明确复发与否。最后一次随访时间为2018年12月31日。生存期定义为初次治疗至死亡或最后一次随访的时间。失访者生存期不计入统计数据。
1.5 数据统计分析
所有数据均使用Microsoft Excel软件(美国Microsoft公司)进行管理,并使用IBM SPSS Statistics软件(版本20.0,美国IBM公司)进行统计分析。使用Kaplan-Meier生存曲线分析不同治疗方法对生存的影响,构建Cox比例风险回归模型进行HCCA预后影响因素的多因素分析。检验水准为α=0.05(双向检验)。
2 结 果
2.1 各组生存情况比较
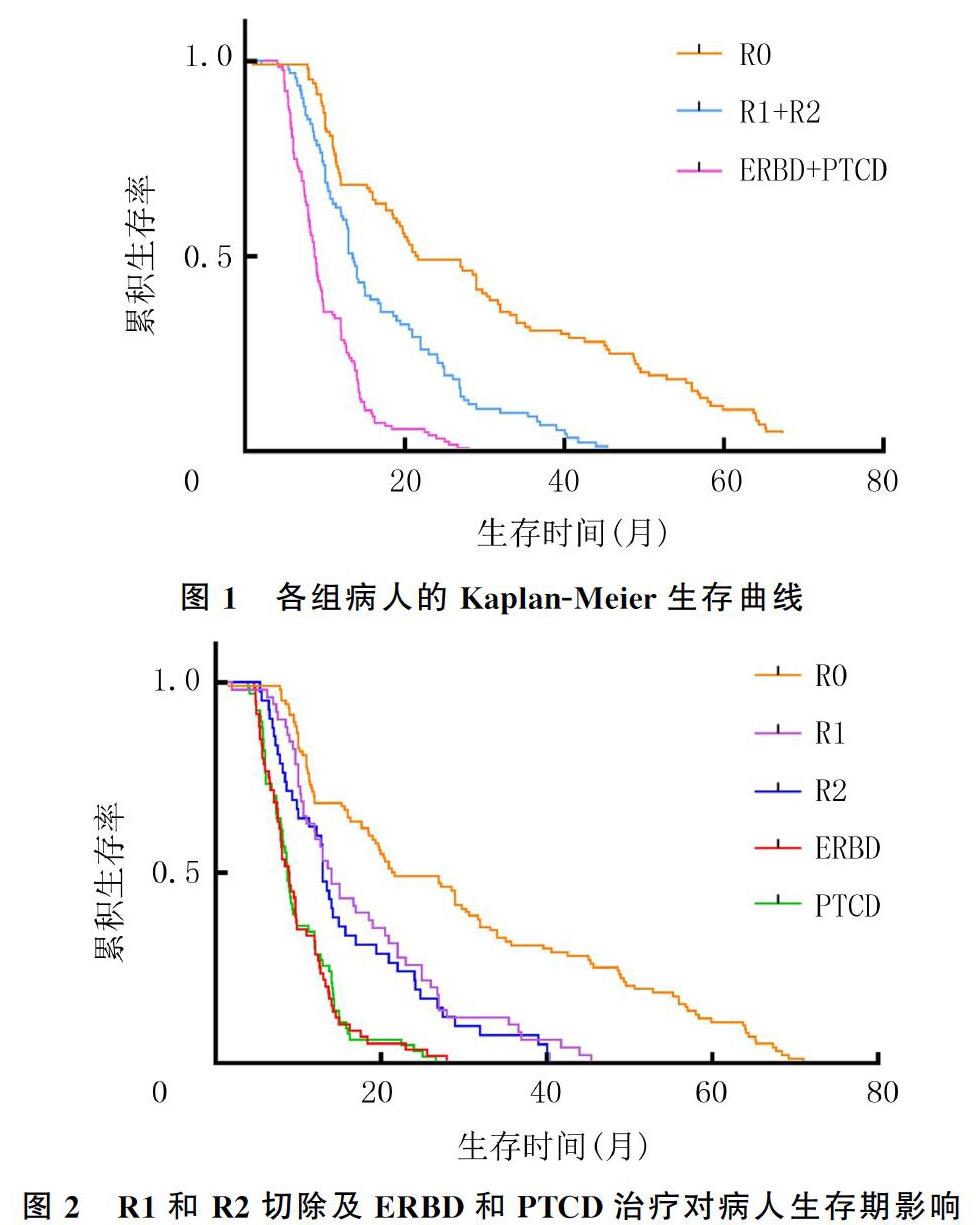
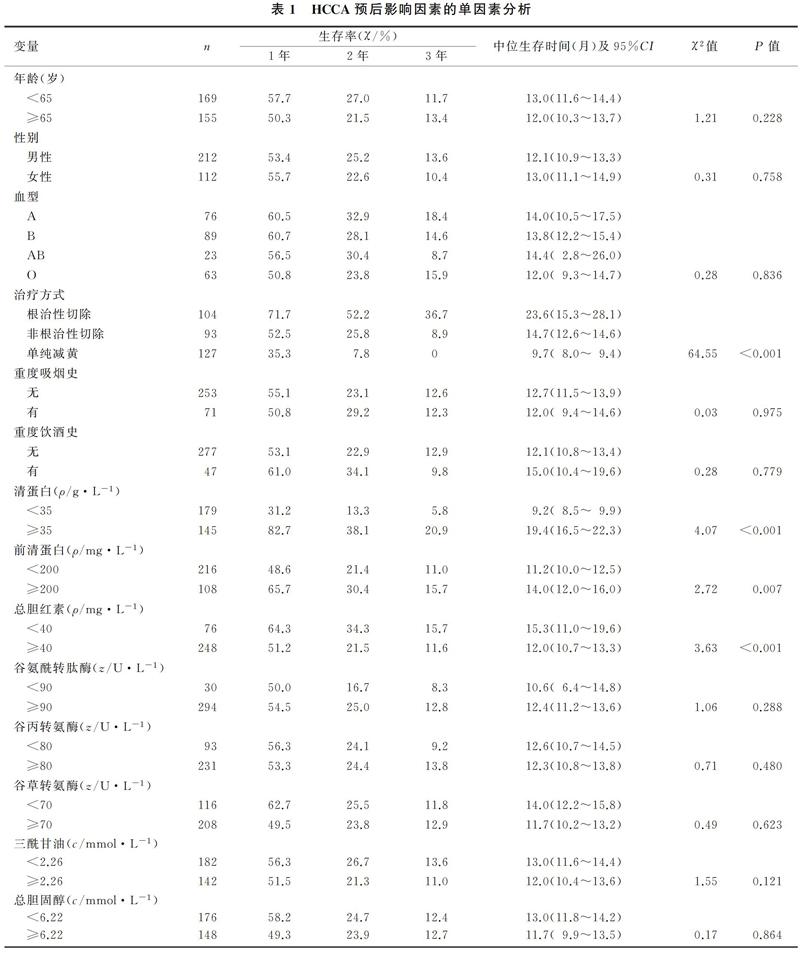
本研究共纳入366例HCCA病人,其中42例失访,随访率为88.5%。根治性切除组的中位生存期为23.6个月(1.0~71.0个月),1、2、3年生存率分别为71.7%、52.2%和36.7%;非根治性切除组的中位生存期为14.7个月(2.0~45.4个月),1、2、3年生存率分别为52.5%、25.8%和8.9%;单纯减黄组的中位生存期为9.7个月(4.0~28.0个月),1、2、3年生存率分别为35.3%、7.8%和0。3组病人的1、2、3年生存率及中位生存期比较差异均有显著性(χ2=34.31~64.55,P<0.001)。见图1。行R1切除和R2切除病人的生存期(14.0个月vs 13.0个月)比较,以及接受ERBD治疗和PTCD治疗病人的生存期(9.0个月vs 8.7个月)比较,差异均无统计学意义(P>0.05)。见图2。
2.2 预后影响因素分析
单因素分析显示,治疗方法、清蛋白、前清蛋白、总胆红素、C反应蛋白、肿瘤直径、术后病理T分期、淋巴结转移、远处转移和Bismuth-Corlette分型等与生存时间显著相关。见表1。将这些差异具有统计学意义因素纳入Cox比例风险回归模型进行分析,结果显示,治疗方法(HR=1.88,95%CI=1.21~2.91)、清蛋白(HR=0.65,95%CI=0.45~0.94)、总胆红素(HR=1.63,95%CI=1.02~2.59)、术后病理T分期(HR=1.43,95%CI=1.18~1.72)和远处转移(HR=2.29,95%CI=1.15~4.53)等为HCCA獨立预后影响因素。见表2。
3 讨 论
本次研究的366例HCCA病人中,有212例病人接受了切除手术,根治性切除率为54.2%(115/212),比GUGLIELMI等[16]报道的76.7%要低,但GUGLIELMI等[16]仅研究了62例病人。本文手术切除病人的中位生存期明显长于单纯减黄处理病人,就中位生存期和1、2、3年生存率而言,根治性切除优于其他治疗方法[17-19]。多因素分析结果也显示,治疗方法为HCCA的独立预后影响因素。
对于仅接受单纯减黄处理的HCCA病人,使用ERBD和PTCD治疗对生存率无显著影响。
本文研究结果显示,清蛋白、总胆红素水平为HCCA的独立预后影响因素。清蛋白水平反映了在我院接受治疗之前病人的空腹血清清蛋白水平,也可以反映病人的营养状况[20-21]。当清蛋白水平低且营养状况较差时,病人将无法接受外科手术等治疗[22-23]。
本文研究结果显示,清蛋白≥35 g/L的病人比清蛋白<35 g/L的病人具有更高的生存率。临床上可通过静脉输注人血清蛋白改善HCCA病人的预后[24-25]。将病人按照术前总胆红素水平(以40 mg/L为界)进行分组对照研究,结果显示,两组病人的生存率存在显著差异,这反映了总胆红素对HCCA病人预后的影响;多因素分析也显示,总胆红素是HCCA的一个独立预后因素。血清胆红素水平升高可对全身多个器官造成损害,因此术前降低胆红素水平可改善预后[2,26-28]。但术前胆红素水平为多少适合先行减黄处理和胆红素降至多少可行手术治疗等问题仍存在争议[29-31]。
本文结果显示,术后病理T分期和远处转移为HCCA的独立预后影响因素。我院对HCCA病人的治疗主要集中在肝胆外科,有些在其他科室接受治疗的HCCA病人具有较早的Bismuth-Corlette分期,CT或MRI等检查显示无远处转移,因此接受了非手术治疗,从而使这部分病人错失了根治性切除的机会。目前,HCCA的治疗仍有多种方法可供选择[32-33]。因此,多学科联合诊治对改善HCCA病人的预后具有重要的价值[34-36]。
总之,早期诊断和根治性手术切除对于延长HCCA的生存期很重要,术前提高清蛋白水平和降低总胆红素水平有助于改善HCCA病人的预后。
[参考文献]
[1]MANSOUR J C, ALOIA T A, CRANE C H, et al. Hilar cholangiocarcinoma: expert consensus statement[J]. HPB, 2015,17(8):691-699.
[2]MIZUNO T, EBATA T, NAGINO M. Advanced hilar cholangiocarcinoma: an aggressive surgical approach for the treatment of advanced hilar cholangiocarcinoma: perioperative management, extended procedures, and multidisciplinary approaches[J]. Surgical Oncology, 2020,33:201-206.
[3]PORUK K E, PAWLIK T M, WEISS M J. Perioperative management of hilar cholangiocarcinoma[J]. Journal of Gastrointestinal Surgery, 2015,19(10):1889-1899.
[4]LIU C H, HUANG Q, JIN Z Y, et al. Circulating microRNA-21 as a prognostic, biological marker in cholangiocarcinoma[J]. Journal of Cancer Research and Therapeutics, 2018,14(1):220-225.
[5]LO E C, RUCKER A N, FEDERLE M P. Hepatocellular carcinoma and intrahepatic cholangiocarcinoma: imaging for diagnosis, tumor response to treatment and liver response to radiation[J]. Seminars in Radiation Oncology, 2018,28(4):267-276.
[6]XIAO J, ZHU J S, LIU Z Y, et al. Role of surgical treatment for hepatolithiasis-associated intrahepatic cholangiocarcinoma: a retrospective study in a single institution[J]. Journal of Cancer Research and Therapeutics, 2017,13(5):756-760.
[7]DINANT S, GERHARDS M F, RAUWS E A, et al. Improved outcome of resection of hilar cholangiocarcinoma (Klatskin tumor)[J]. Annals of Surgical Oncology, 2006,13(6):872-880.
[8]ITO F, CHO C S, RIKKERS L F, et al. Hilar cholangiocarcinoma: current management[J]. Annals of Surgery, 2009,250(2):210-218.
[9]ANDERSON B, DOYLE M B M. Surgical considerations of hilar cholangiocarcinoma[J]. Surgical Oncology Clinics of North America, 2019,28(4):601-617.
[10]ZHANG X F, BAGANTE F, CHEN Q Y, et al. Perioperative and long-term outcome of intrahepatic cholangiocarcinoma involving the hepatic hilus after curative-intent resection: comparison with peripheral intrahepatic cholangiocarcinoma and hilar cholangiocarcinoma[J]. Surgery, 2018,163(5):1114-1120.
[11]CELOTTI A, SOLAINI L, MONTORI G, et al. Preoperative biliary drainage in hilar cholangiocarcinoma: Systematic review and meta-analysis[J]. European Journal of Surgical Oncology, 2017,43(9):1628-1635.
[12]HU H J, WU Z R, JIN Y W, et al. Minimally invasive surgery for hilar cholangiocarcinoma: state of art and future perspectives[J]. ANZ Journal of Surgery, 2019,89(5):476-480.
[13]BLECHACZ B. Cholangiocarcinoma: current knowledge and new developments[J]. Gut and Liver, 2017,11(1):13-26.
[14]ANDERSON M A, ZOLOTAREVSKY E, COOPER K L, et al. Alcohol and tobacco lower the age of presentation in sporadic pancreatic cancer in a dose-dependent manner: a multicenter study[J]. The American Journal of Gastroenterology, 2012,107(11):1730-1739.
[15]LIU J G, WU J, WANG J, et al. Endoscopic biliary drainage versus percutaneous transhepatic biliary drainage in patients with resectable hilar cholangiocarcinoma: a systematic review and meta-analysis[J]. Journal of Laparoendoscopic & Advanced Surgical Techniques Part A, 2018,28(9):1053-1060.
[16]GUGLIELMI A, RUZZENENTE A, CAMPAGNARO T, et al. Prognostic significance of lymph node ratio after resection of peri-hilar cholangiocarcinoma[J]. HPB, 2011,13(4):240-245.
[17]DOHERTY B, NAMBUDIRI V E, PALMER W C. Update on the diagnosis and treatment of cholangiocarcinoma[J]. Current Gastroenterology Reports, 2017,19(1):2.
[18]RIZVI S, KHAN S A, HALLEMEIER C L, et al. Cholangiocarcinoma-evolving concepts and therapeutic strategies[J]. Nature Reviews Clinical Oncology, 2018,15(2):95-111.
[19]ESNAOLA N F, MEYER J E, KARACHRISTOS A, et al. Evaluation and management of intrahepatic and extrahepatic cholangiocarcinoma[J]. Cancer, 2016,122(9):1349-1369.
[20]BIRGIN E, RASBACH E, REISSFELDER C, et al. A systematic review and meta-analysis of caudate lobectomy for treatment of hilar cholangiocarcinoma[J]. European Journal of Surgical Oncology, 2020,46(5):747-753.
[21]SIRICA A E, GORES G J, GROOPMAN J D, et al. Intrahepatic cholangiocarcinoma: continuing challenges and translational advances[J]. Hepatology (Baltimore, Md), 2019,69(4):1803-1815.
[22]ZHANG H, YANG T, WU M C, et al. Intrahepatic cholangiocarcinoma: epidemiology, risk factors, diagnosis and surgical management[J]. Cancer Letters, 2016,379(2):198-205.
[23]CHUN Y S, JAVLE M. Systemic and adjuvant therapies for intrahepatic cholangiocarcinoma[J]. Cancer Control: Journal of the Moffitt Cancer Center, 2017,24(3):1073274817729241.
[24]QUINN L M, MANN K, JONES R P, et al. Defining enhanced recovery after resection of peri-hilar cholangiocarcinoma[J]. European Journal of Surgical Oncology, 2019,45(8):1439-1445.
[25]LI Q J, ZHOU Z G, LIN X J, et al. Clinical practice of basin-shaped hepaticojejunostomy following hilar resection of stage Ⅲ/Ⅳ hilar cholangiocarcinoma[J]. BMC Gastroenterology, 2019,19(1):99.
[26]SEYAMA Y, KUBOTA K, SANO K, et al. Long-term outcome of extended hemihepatectomy for hilar bile duct cancer with no mortality and high survival rate[J]. Annals of Surge-ry, 2003,238(1):73-83.
[27]SUN Y B, LI W M, SUN D L, et al. Percutaneous transhepatic cholangial drainage combined with percutaneous endoscopic jejunostomy for maintaining nutrition state in patients with advanced ampullary neoplasms[J]. Journal of Cancer Research and Therapeutics, 2018,14(Supplement):S1158-S1162.
[28]WANG Y D, FU W K, TANG Z W, et al. Effect of preoperative cholangitis on prognosis of patients with hilar cholangiocarcinoma: a systematic review and meta-analysis[J]. Medicine, 2018,97(34):e12025.
[29]GOUMA D J. Multicentre European study of preoperative bi-liary drainage for hilar cholangiocarcinoma (Br J Surg 2013; 100:274-283)[J]. The British Journal of Surgery, 2013,100(2):283-284.
[30]PAIK W H, LOGANATHAN N, HWANG J H. Preoperative biliary drainage in hilar cholangiocarcinoma: when and how[J]? World Journal of Gastrointestinal Endoscopy, 2014,6(3):68-73.
[31]SEWNATH M E, BIRJMOHUN R S, RAUWS E A, et al. The effect of preoperative biliary drainage on postoperative complications after pancreaticoduodenectomy[J]. Journal of the American College of Surgeons, 2001,192(6):726-734.
[32]RASSAM F, ROOS E, VAN LIENDEN K P, et al. Modern work-up and extended resection in perihilar cholangiocarcinoma: the AMC experience[J]. Langenbecks Archives of Surgery, 2018,403(3):289-307.
[33]CHEN K J, YANG F C, QIN Y S, et al. Assessment of clinical outcomes of advanced hilar cholangiocarcinoma[J]. Hepatobiliary & Pancreatic Diseases International: HBPD INT, 2018,17(2):155-162.
[34]BENSON A B 3rd, ABRAMS T A, BEN-JOSEF E, et al. NCCN clinical practice guidelines in oncology: hepatobiliary cancers[J]. Journal of the National Comprehensive Cancer Network: JNCCN, 2009,7(4):350-391.
[35]SAPISOCHIN G, IVANICS T, SUBRAMANIAN V, et al. Multidisciplinary treatment for hilar and intrahepatic cholangiocarcinoma: a review of the general principles[J]. International Journal of Surgery (London, England), 2020,82S:77-81.
[36]BIRD N T E, MANU N, QUINN L, et al. Evaluation of the utility of prognostic models for patients with resected hilar cholangiocarcinoma[J]. HPB, 2019,21(10):1376-1384.
(本文編辑 马伟平)

