LC-MS/MS法同时测定肾移植患者血浆中霉酚酸及两种代谢物浓度
蒋振伟,杨旭萍,蒋艳,凌静,董露露,邹素兰,陈荣,胡楠(常州市第一人民医院药学部,江苏 常州 213003)
霉酚酸(mycophenolic acid,MPA)是由青霉菌发酵生成的有机弱酸,在体内通过抑制次黄嘌呤核苷酸脱氢酶的活性,阻断嘌呤核苷酸的合成,抑制T、B 淋巴细胞的增殖,从而发挥免疫抑制效应[1]。MPA 在体内主要通过尿苷二磷酸葡萄糖醛酸转移酶(uridine diphosphate glucuronyl-transferase,UGT)代谢为葡萄糖醛酸化物(MPA-glucuronide,MPAG)和酰基化的葡萄糖醛酸化物(acyl-MPAglucuronide,AcMPAG)[2],各化合物结构见图1。MPA 的药动学个体间差异较大,且浓度与疗效和不良反应有关[2],治疗药物监测具有重要意义。MPAG、AcMPAG 与MPA 游离药物浓度、肝肠循环及二次峰浓度等有密切关联[3-4],因此测定上述三者血药浓度于MPA 血药浓度监测、指导临床合理用药有实际意义。现有的关于MPA 及其代谢物血药浓度测定的方法基本是测定其中的单一化合物。同时测定MPA、MPAG、AcMPAG 有助于提高测定效率和药物检测时效。本研究建立了同时测定血浆中三者浓度的LC-MS/MS 法。
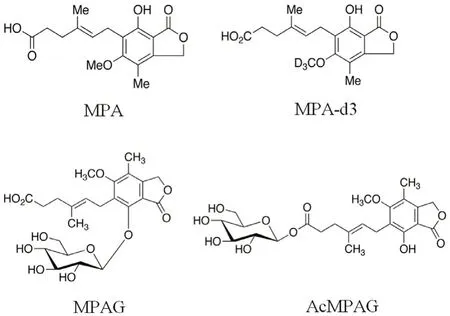
图1 MPA、MPAG、AcMPAG 及MPA-d3 的化学结构Fig 1 Chemical structure of MPA,MPAG,AcMPAG and MPA-d3
1 材料
1.1 仪器
Jasper HPLC 液相色谱仪,Triple Quad 4500MD三重四极杆串联质谱仪(AB SCIEX,美国),Vortex-Genie 2 涡旋混合器(Scientific industries,美国),5417R 低温高速离心机(Eppendorf,德国),Direct-Q 纯水仪(Millipore,美国),BT25S 电子分析天平(Sartorius,德国)。
1.2 试药
MPA(纯度:98%, 批号:3-BKG-19-1)、MPAG(纯度:96%,批号:2-FAI-5-1)、AcMPAG(纯度:95%,批号:6-PQY-99-1)(Toronto Research Chemicals 公司),内标MPA-d3(纯度:98%,批号:3-ACA-246-4,Cmass 公司)。甲醇(色谱纯,Merck公司);甲酸和乙酸铵(分析纯,Sigma-Aldrich 公司);纯水由Milli-Q 超纯水系统制得。
2 方法与结果
2.1 色谱条件
Kinetex C18(3 mm×100 mm,2.6 μm,Phenomenex,USA),流动相A:水(0.1%甲酸,10 mmol·L-1乙酸铵),流动相B:甲醇(0.1%甲酸),梯度洗脱:0~0.8 min,60%A;0.8~3.8 min,0%A;3.8~4 min,60%A;4~5 min,60%。流速:0.55 mL·min-1,柱温:40℃。
2.2 质谱条件
ESI 正离子检测模式,多反应监测(MRM)扫描。各成分选用的离子对和DP、CE 电压如下:
MPA:m/z321.0 →303.2,75 V 和15 V;MPAG:m/z514.0 →303.3,30 V 和18 V;AcMPAG:m/z514.0 →207.0,30 V 和50 V;内标MPA-d3:m/z324.1 →306.0,110 V 和15 V。
2.3 对照品储备液的配制
取MPA 5 mg、MPAG 2.5 mg、AcMPAG 0.5 mg,加入适量甲醇溶解,配制成MPA、MPAG 及AcMPAG 质量浓度分别为5、5、0.5 mg·mL-1的对照品储备液。分别取对照品储备液适量,混合配制成MPA、MPAG 及AcMPAG 质量浓度分别为0.5、2、0.4 mg·mL-1混合对照品储备液。
2.4 血浆样品处理
取血浆50 μL,加入5 μL 内标MPA-d3(10 μg·mL-1),再加入200 μL 甲醇-乙腈溶液(9∶1),涡旋震荡3 min,16 400 r·min-1离心10 min,取上清液20 μL,加入50%甲醇溶液180 μL,涡旋30 s,16 400 r·min-1离心10 min,取上清液100 μL 进样。
2.5 方法学验证
2.5.1 专属性 取6 份不同来源的人空白血浆、加入对照品储备液的人血浆样品、用药后的血浆样品按照“2.4”项下方法处理分析。结果MPA、MPAG、AcMPAG 和内标(MPA-d3)的保留时间分别为2.8、2.39、2.58 和2.79 min,血浆中内源性物质在待测物保留时间内无干扰,结果见图2。
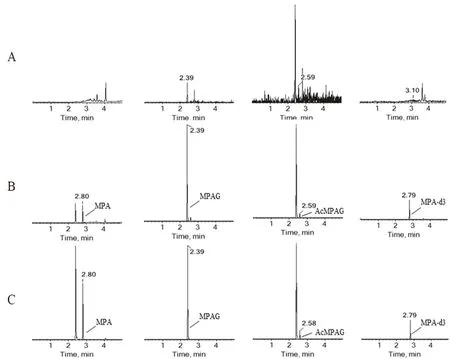
图2 血浆中MPA、MPAG、AcMPAG 和内标MPA-d3 的LC-MS/MS 色谱图Fig 2 LC-MS/MS chromatogram of MPA,MPAG,AcMPA and MPA-d3 in the plasma
2.5.2 标准曲线和定量限 精密量取混合对照品储备液适量,加甲醇稀释成含MPA(2、4、10、25、50、100、250、500 μg·mL-1),MPAG(10、20、50、125、250、500、1250、2500 μg·mL-1),AcMPAG(0.8、1.6、4、10、20、40、100、200 μg·mL-1)的混合工作溶液。取混合工作液5 μL,加入空白血浆45 μL,制备标准系列溶液。按“2.4”项下方法处理。以待测物与内标物峰面积比Y为纵坐标,待测物质量浓度X(μg·mL-1)为横坐标,以加权(W=1/χ²)最小二乘法进行线性回归运算,结果MPA 标准曲线为:Y=3.754X+0.3733(r=0.9926);MPAG标准曲线为:Y=0.4653X+0.1271(r=0.9941);AcMPAG 标准曲线为:Y=0.2891X+4.441×10-4(r=0.9942);MPA、MPAG、AcMPAG 的定量限分别为0.2、1、0.08 μg·mL-1。
2.5.3 精密度与准确度 取混合对照品储备液,配制成含MPA(5、80、400 μg·mL-1)、MPAG(25、400、2000 μg·mL-1)和AcMPAG(2、32、160 μg·mL-1)的低、中、高浓度的质控工作液。取混合质控工作液5 μL,加入空白血浆45 μL,按“2.4”项下方法处理,每个浓度取6 份,在2周内测定3 次。根据当日的标准曲线计算日内和日间精密度、准确度,结果见表1。
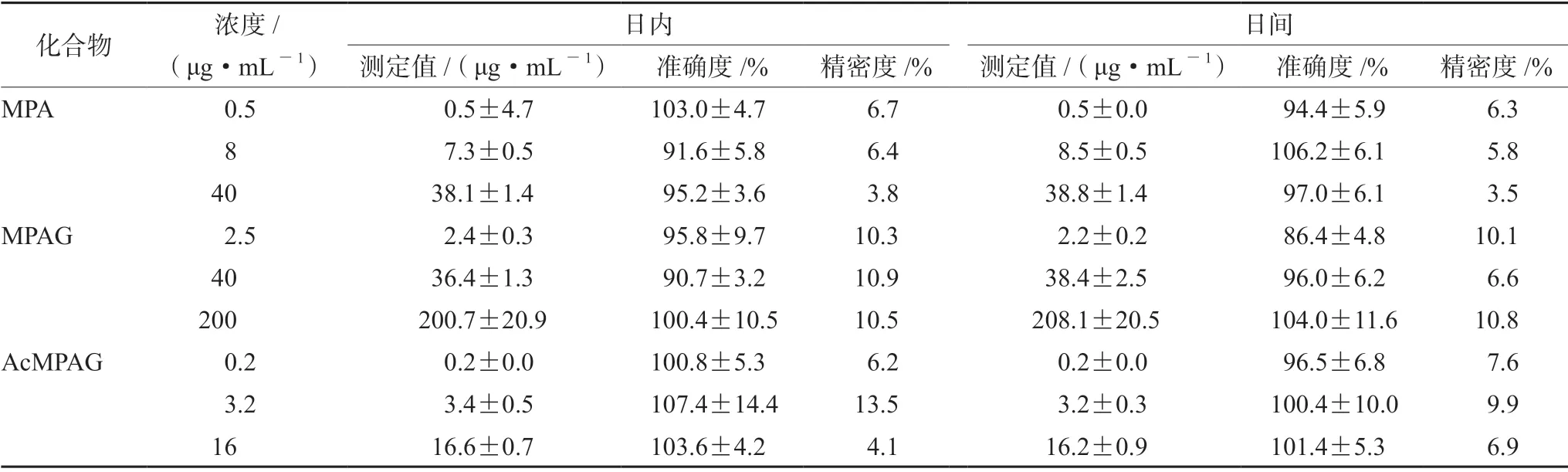
表1 MPA、MPAG、AcMPAG 的准确度及精密度(n =6)Tab 1 Accuracy and precision of MPA,MPAG and AcMPAG (n =6)
2.5.4 提取回收率和基质效应 取“2.5.3”项下3个浓度的质控QC 工作液,进样测得待测物峰面积比值A1。取空白血浆进行预处理后的上清液,加入低、中、高浓度的混合质控样品(包括内标),每个浓度6 份,测得待测物峰面积比值A2。峰面积比A1/A2可求得3 种浓度待测物的提取回收率。取不同人空白血浆6 份,加入低,中,高浓度质控样品溶液,每个浓度6 个待测样品,按“2.4”项下方法处理,测得待测物峰面积比值A3,基质效应为A2/A3,结果MPA、MPAG 和AcMPAG 的提取回收率及基质效应RSD均符合方法学要求。
2.5.5 稳定性 考察了室温稳定性,4℃稳定性,冻融稳定性及进样器稳定性。取“2.5.3”项下3个浓度的质控工作液各5 μL,每个浓度6 份,加入人空白血浆,分别在室温下放置6 h;在4℃下放置24 h;在-80℃,反复冻融3 次,按“2.4”项下方法处理后进样测定,结果MPA、MPAG 和AcMPAG 质量浓度的RSD均在±15%范围内,表明MPA 及其代谢物在本实验条件下稳定。
2.6 药动学研究
7 例肾移植患者,术后免疫抑制剂方案均采用他克莫司(FK506)+霉酚酸酯(MMF)+糖皮质激素三联用药。MMF 在肾移植术前12 h 内开始口服1000 mg bid;术中及术后1 d 静脉滴注甲基强的松龙500 mg·d-1,术后第2日或者第3日减为250 mg·d-1,后口服泼尼松片40 mg/(kg·d),逐渐减量至10~20 mg/(kg·d),他克莫司剂量为0.07~0.15 mg/(kg·d)bid。于本方案治疗1 周后,于末次给药后0、0.5、1、1.5、2、4、6、8、10、12 h 采集血浆样本测定MPA、MPAG 和AcMPAG 浓度。用WinNonlin 软件的非房室模型进行拟合求算Cmax、tmax、t1/2、AUC及平均驻留时间(MRT)等药动学参数。实验数据以mean±SD 表示,结果见表2及图3。

表2 7 例肾移植患者服用霉酚酸酯后MPA 和代谢物的药动学参数Tab 2 Pharmacokinetic parameters of MPA and metabolites after the oral administration of MMP in 7 renal transplant patients
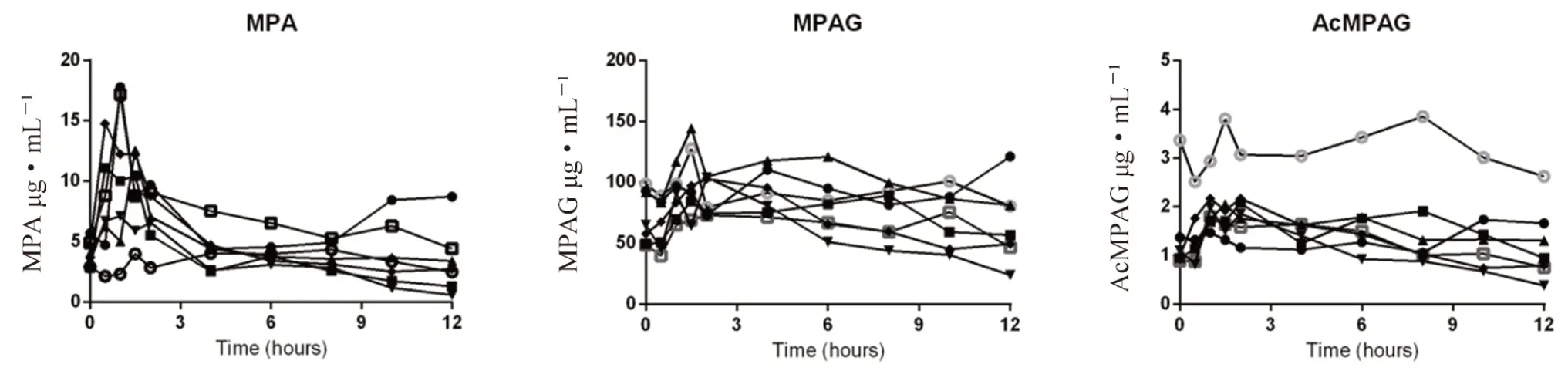
图3 肾移植患者口服霉酚酸酯后MPA、MPAG、AcMPAG 的血药浓度-时间曲线Fig 3 Mean plasma concentrations-time curve of MPA,MPAG and AcMPAG in renal transplantation patients after the oral administration of MMP
3 讨论
目前临床上应用的MPA 类药物主要有霉酚酸酯(MMF)肠溶片和霉酚酸钠肠溶片(ECMPS)[5],MMF 是无活性的前体药物,口服后经胃肠道吸收,水解生成活性代谢产物MPA。霉酚酸类药物具有非线性药动学特征,在不同患者体内药动学差异较大,需要通过血药浓度监测调整给药剂量。MPA 的血药浓度-时间曲线下面积(AUC)的理想范围在30~60 μg·h·mL-1,大于60 μg·h·mL-1时易发生胃肠道、骨髓抑制等相关不良反应,而小于30 μg·h·mL-1时发生急性排斥反应的风险增加[6]。研究表明代谢物MPAG 会影响MPA 的药动学特征,AcMPAG可能与MPA 的毒副作用有关[7-8]。MPAG 会与MPA 竞争蛋白结合影响MPA 的游离浓度。AcMPAG 可能通过抑制次黄嘌呤核苷酸脱氢酶、白细胞的增殖和诱导细胞因子的释放表现出生物活性,服用MMF 后引起的白细胞减少和胃肠道功能紊乱可能与 AcMPAG 相关[9]。因此对MPA及其代谢物的检测具有一定的临床意义。
目前国内外测定MPA 及其代谢物的方法主要有HPLC 法、LC-UV 法以及酶放大免疫法(EMIT)[10]。免疫法方便快捷,但是特异性不强,测定MPA 及其代谢物时,会与AcMPAG 发生交叉反应使MPA 浓度偏高。HPLC 法具有较高的灵敏度和特异性,是测定MPA 及其代谢物的一种标准方法,但检测过程耗时较长。本实验选择LC-MS/MS 测定MPA 及其代谢物浓度,相较于HPLC 和EMIT 法,LC-MS/MS 法不需要使用昂贵的抗体,可以缩短测定时间,样本处理方法简单,同时具有更好的特异性和灵敏度。
在方法优化过程中尝试了多种流动相,包括水-甲醇、 水-乙腈、 水(0.01%甲酸,10 mmol·L-1乙酸铵)-甲醇(0.01%甲酸)、水(0.1%甲酸,5 mmol·L-1乙酸铵)-甲醇(0.1%甲酸),最终选择流动相A:水(0.1%甲酸,10 mmol·L-1乙酸铵),流动相B:甲醇(0.1%甲酸),通过加入甲酸和乙酸铵使得MPA 及其代谢物的色谱峰形和响应值得到改善。对于洗脱方式,尝试了等度洗脱与梯度洗脱,相对等度洗脱,梯度洗脱有更好的峰形以及分离度。通过调整初始有机相比例得到了较为合适的保留时间,避免与杂质共同洗脱从而减少了基质效应的干扰。笔者查阅相关文献,发现大部分研究对于MPA、MPAG 和AcMPAG 母离子的选择都是[M-H]-离子[11-14],而在质谱条件摸索时发现MPA 的[M +H]+离子,MPAG 和AcMPAG 的[M +NH4]+离子也有很好的响应,能够满足MPA 血药浓度测定的需要。MPAG 和AcMPAG 都是霉酚酸的葡萄糖醛酸化代谢物,互为同分异构体具有相同的分子量,刘晓雪等[11]建立的肝移植患者血浆MPA及其代谢物的LC-MS/MS 检测方法中MPAG 和AcMPAG 共用同一个离子对,笔者在实验中发现了两种代谢物的不同的离子对,每个代谢物在各自的离子对下都具有较高的响应,可以更好地对MPAG 和AcMPAG 进行定性和定量。对于内标的选择,本实验选择稳定同位素内标MPA-d3,相对于吲哚美辛内标[11],MPA-d3 的理化性质与待测物最相近,表现为相似的回收率、离子化效率和色谱保留行为,并且无内源性干扰,受到基质效应的干扰更小。

