冠心病患者PCI前后AT1-AA滴度变化及其与支架内再狭窄的关系
任于军,张国勇,张明德,曹应江,邹洋,卜建学
在我国冠状动脉粥样硬化性心脏病(冠心病,CHD)一直是老年人群致死和致残的最常见原因[1]。经皮冠状动脉介入术(PCI)的出现,使超过90%的患者冠状动脉(冠脉)狭窄得到成功治疗,然而,支架内再狭窄(ISR)仍是一个严重的预后难题,使患者重新出现症状或需二次血运重建[2]。Val-PREST[3]和VALVACE[4]研究证实,使用血管紧张素Ⅱ-1型受体(AT1R)阻滞剂(ARB)治疗可降低ISR和血运重建的发生率。但ARB降低ISR的确切机制尚不清楚。Wallukat等[5]首次发现AT1受体自身抗体(AT1-AA),并证实AT1-AA可导致剂量依赖性的细胞内钙动员增加及血管平滑肌细胞增殖活性增强。而血管平滑肌细胞的过度增殖被证实是ISR发生的病理基础。本研究在于探讨CHD患者PCI对AT1-AA滴度的影响,及术后AT1-AA分布特征与ISR发生的关系。
1 资料与方法
1.1 研究对象自2018年10月至2020年1月,选取因急性胸痛在中国人民解放军联勤保障部队989医院被诊断为急性冠脉综合征(ACS)的患者145例,其中男性91例,女性54例;年龄37~82岁,平均年龄(64.74±11.64)岁,由经验丰富的介入专家按照标准技术进行PCI。符合ACS的诊断标准[6],包括不稳定性心绞痛(UA)患者74例,非ST段抬高心肌梗死(NSTEMI)患者38例,ST段抬高心肌梗死(STEMI)患者33例。排除标准:存在自身免疫性疾病、心肌病、先天性心脏病、出血障碍、慢性感染、肝脏或肾脏疾病、各种结缔组织疾病、感染、创伤或恶性肿瘤者。本研究经我院伦理委员会批准,所有患者及家属均知情同意。
1.2 PCI和冠脉造影(CAG)分析对于择期PCI患者,术前至少2~3 d起服用阿司匹林100 mg和氯吡格雷75 mg,对于急诊PCI患者给予负荷剂量阿司匹林(300 mg)和氯吡格雷(450~600 mg)。采用常规技术行PCI和国产雷帕霉素涂药支架(Firebird,上海微创医疗器械有限公司)。根据病变血管的近端和远端直径,选择比例为1:1的支架,支架比病变血管长3~5 mm。手术成功定义为血流达到TIMI 3级,且目测判断残余狭窄<20%。依指南建议,PCI后患者接受至少12个月的氯吡格雷75 mg/d和阿司匹林100 mg/d。在基线(PCI术前)和PCI后3~12个月随访时进行CAG检查。ISR定义为随访时冠脉直径狭窄 ≥50%,将患者分为ISR组(≥50%,n=43例)和非ISR组(<50%,n=102例)[7]。
1.3 收集血样和AT1-AA滴度检测PCI前(基线值)和PCI后24 h采集2次血样,将样品在离心前(4℃,3500 r/min,15 min)静置凝固30 min,储存于-80℃待测。采用SA-ELISA法检测血清AT1-AA滴度。将固相多肽合成法合成的AT1-AA多肽溶解于100 mmol/L Na2CO3溶液中,4℃孵育过夜,弃上清,加入PBST稀释的脱脂牛奶溶液。风干后,37℃恒温孵育1 h。将阳性对照、阴性对照、待测样品按1:100稀释,加入多肽包被的孔中,37℃恒温孵育1 h。加入稀释后的辣根过氧化物酶标记的二级抗体,37℃孵育1 h。加入0.5 μl H2O2反应30 min。用酶标仪检测各孔径的光密度值(OD)。P/N≥2.1为阳性,P/N≤1.5为阴性,P/N =(OD样品-OD空白)/(OD阴性对照-OD空白)。
1.4 血清炎症因子和血管生成因子水平检测取PCI后24 h的血样,用酶联免疫吸附测定法检测血清白细胞介素-6(IL-6)、C反应蛋白(CRP)、γ-干扰素(IFN-γ),血管新生相关指标主要包括血管内皮生长因子(VEGF)、血管生成素1(Ang-1)、Ang-2。试剂盒均购自上海广锐生物有限公司。
1.5 统计学方法采用SPSS 17.0软件包进行数据处理,计量资料采用均数±标准差(±s)表示,组间比较采用t检验;计数资料采用例数(构成比)表示,组间比较采用χ2检验。多因素 Logistic回归模型用于ISR发生的独立预测因子。P<0.05为显著性。
2 结果
2.1 两组一般临床资料比较根据随访CAG(随访时间为PCI后3~12个月),将145例患者分为ISR组(n=43)和非ISR组(n=102),ISR发生率为29.66%。临床特征和实验室数据(表1)。与非ISR组相比,ISR组2型糖尿病患病率和总胆固醇水平增加(P均<0.05)。两组患者在年龄、性别组成、体质指数、临床诊断分布、高危因素(吸烟史、高血压)、临床诊断类型、左室射血分数(LVEF)、其他实验室指标,差异均无统计学意义(P>0.05),表1。
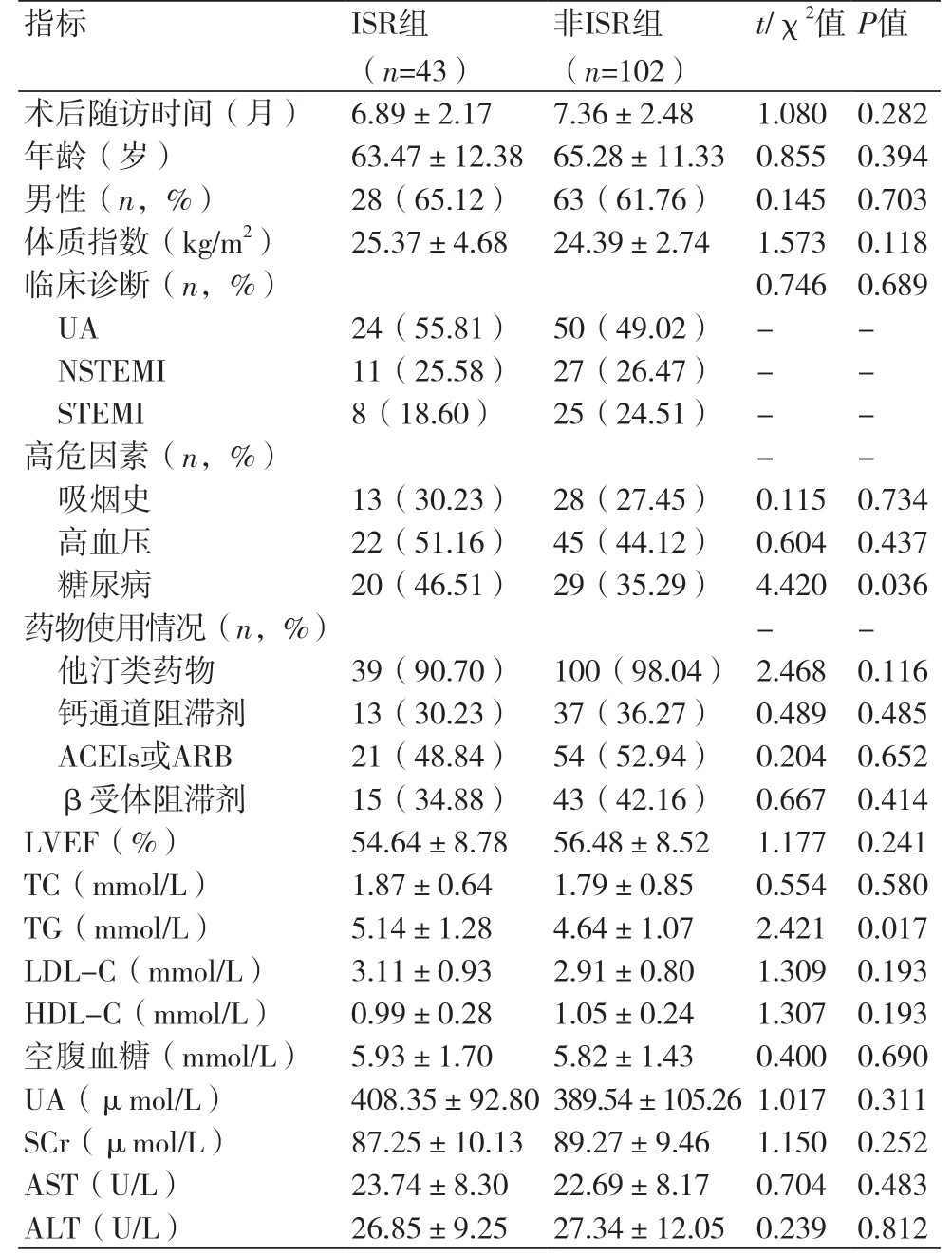
表1 两组患者一般临床资料对比
2.2 两组CAG结果及支架特征比较145例患者中,共植入252枚支架。其中61枚支架发生再狭窄,发生率为20.89%。ISR组患者最长支架长度、术前血管最大狭窄程度均高于非ISR组,同时支架最大直径、参考血管直径小于非ISR组(P均<0.05),另外其他调查变量在两组间具有可比性(P>0.05),表2。
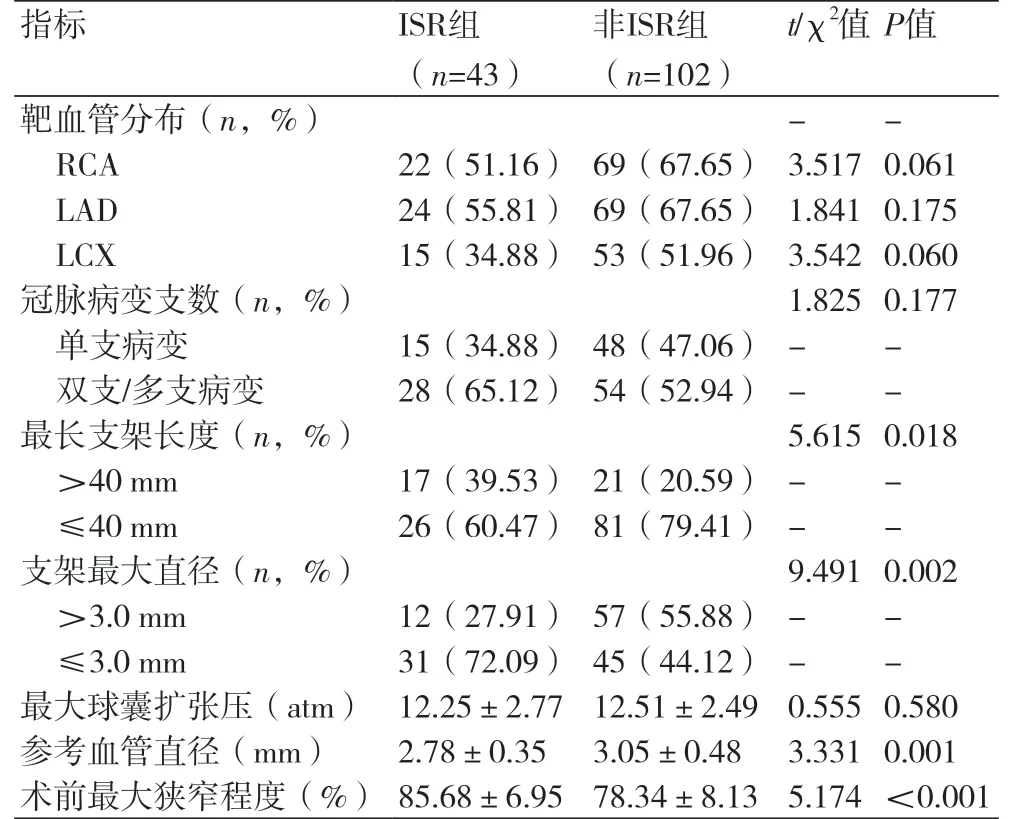
表2 两组CAG结果及支架特征分析
2.3 两组PCI前后血清AT1-AA滴度阳性率变化两组PCI前血清AT1-AA滴度阳性率比较,差异无统计学意义(P>0.05)。PCI后,ISR组患者血清AT1-AA滴度阳性率较PCI前升高,经McNemanr检验,差异有统计学意义(P<0.05)。ISR组患者血清AT1-AA滴度阳性率高于非ISR组,经χ2检验,差异有统计学意义(P<0.05),表3。
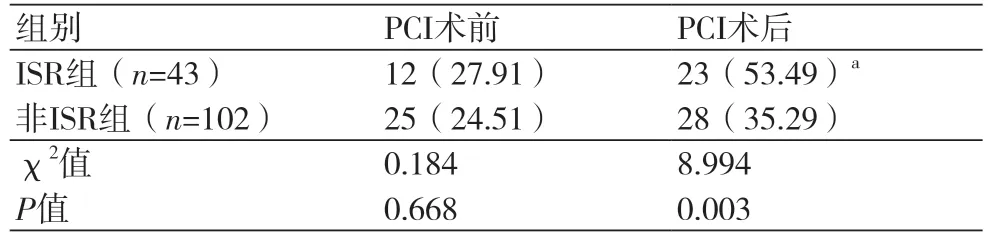
表3 两组PCI术前后血清AT1-AA滴度变化(n,%)
2.4 多因素Logistic回归分析影响ACS患者术后发生ISR的临床因素以ISR发生为因变量(赋值ISR=1,非ISR=0),以糖尿病、总胆固醇水平、最长支架长度、支架最大直径、术前血管最大狭窄程度、参考血管直径作为自变量,进行多因素Logistic回归分析,结果显示,只有糖尿病、支架长度、支架直径、参考血管直径、PCI术后AT1-AA滴度值是ISR发生的独立预测因素(P<0.05),表4。
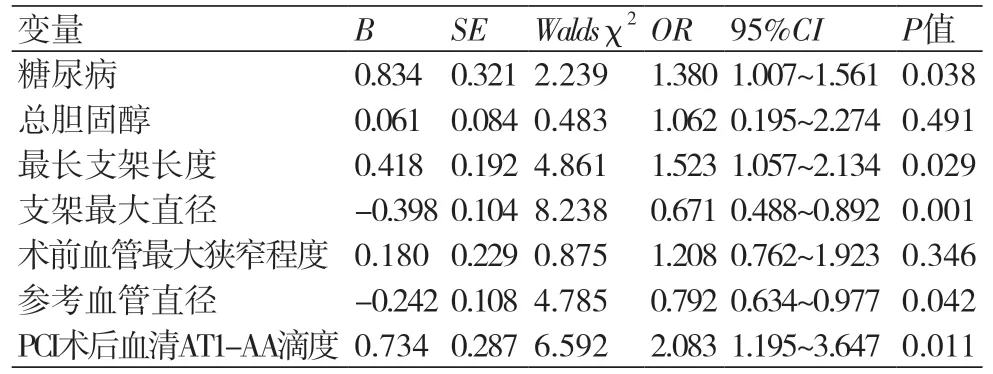
表4 多因素Logistic回归分析影响ACS患者术后发生ISR的临床因素
2.5 ISR组患者PCI术后血清AT1-AA滴度与血清炎症因子、血管生成因子的关系对于ISR组患者,与AT1-AA滴度阴性亚组患者相比,AT1-AA滴度阳性亚组患者血清IL-6、CRP、IFN-γ水平以及血清VEGF、Ang-2水平较高(P均<0.05),表5。

表5 ISR组患者PCI术后血清AT1-AA滴度与血清炎症因子、血管生成因子的关系
3 讨论
ISR是接受PCI的CHD患者术后常见的问题之一,药物洗脱支架的出现虽然降低了金属支架ISR的发生率,但仍有部分患者会发生ISR[8-10]。本研究中,43例患者在术后随访期间发生ISR,ISR发生率为29.66%,与国内多数研究报道的范围基本一致。我们发现,PCI后ACS患者血清AT1-AA滴度阳性率均有所升高,但ISR组患者升高更明显,且ISR组患者PCI后24 h时血清AT1-AA滴度阳性率高于非ISR组患者,经多因素Logistic回归分析,血清AT1-AA滴度阳性是ACS患者PCI后发生ISR的独立预测因子。
ISR主要是由于血管平滑肌细胞增殖、迁移和细胞外间质沉积引起的血管内皮增生所致。肾素-血管紧张素系统(RAS)在ISR发生和发展中的作用早已被证实[11-13]。Ang-2是RAS的主要效应分子,能调节血压,调节动脉壁生长,增加血管平滑肌细胞DNA和蛋白合成。Ang-2通过与AT1受体结合后被激活在血管壁损伤的增殖中发挥基础作用[14]。因此,AT1是预防再狭窄和动脉粥样硬化血栓事件的潜在目标。Val-PREST和VALVACE研究证实,长期服用大剂量(80 mg)ARB(缬沙坦)可有效抑制冠脉再成形术后再狭窄(19.2% vs. 38.6%安慰剂组)和再干预率(12.1% vs. 28.7%安慰剂组)。研究小组在另一项临床试验中发现,裸金属支架植入后给予80 mg缬沙坦,可减少支架内再狭窄,而ACEIs的作用则不明显[4]。这些效果可能是由于缬沙坦选择性阻断了AT1受体,但还不清楚是否存在其他机制。
既往研究表明,炎症反应在动脉粥样硬化和斑块不稳定的进展中起重要作用[15]。Ang-2除了在血管生成中发挥作用外,还是炎症的重要调节因子。最近有报道表明,即使在一般人群或无心血管疾病的人群中,高水平的Ang-2也能预测重大心血管不良事件的发生[16]。不仅如此,Jian等报道了血清Ang-2在择期PCI中的作用,通过分析97例CHD的患者临床资料,并采集PCI后24~48 h的血样,发现血清Ang-2高水平组PCI后短期不良心血管事件(非致命性心肌梗死/重复血运重建、心绞痛严重恶化再入院和新发心力衰竭再入院)的发生风险明显增加,因此Ang-2水平较高是CHD患者PCI不良预后的独立危险因素。
AT1-AA最早是由Wallukat等[5]首先发现并证实AT1-AA可能通过激活AT1受体在高血压发病机制中发挥着重要作用,在顽固性高血压患者中可明显检测到血清AT1-AA滴度阳性,其作用机制可能与剂量依赖性增加细胞内钙动员有关。本研究中,我们从ACS患者血清中提取到AT1-AA免疫球蛋白,且ISR组患者血清AT1-AA滴度阳性率在PCI后显著增加,并高于非ISR组患者。再狭窄是动脉对治疗过程中造成的血管损伤的过度反应,主要是由于新生内膜的形成,这与血管平滑肌细胞的增殖和迁移有关。支架置入后,侵入性损伤导致内皮剥脱引起血小板下层出血,其次是粘附、聚集和激活。活化的血小板诱导多种生长因子的释放和表达,导致血管平滑肌细胞迁移和增殖,产生大量的细胞外间质,导致新生内膜增生。内皮细胞是调节炎症细胞通透性的重要屏障,受血管生成素-配体-受体系统调控。Ang-1与tie-2受体结合,能够稳定内皮和血管结构。相反,Ang-2通过干扰Ang-1/tie-2信号转导而作为Ang-1的天然拮抗剂。Ang-2水平过高可导致内皮细胞完整性受损,通过增加内皮细胞对炎症因子(IL-6、IFN-γ等)的敏感性,促进内皮细胞的粘附和迁移。此外,Ang-2与动脉粥样硬化的进展密切相关。初志辉等证实,循环血Ang-2水平被发现与颈动脉斑块的数量和性质有关。动物实验证实,Ang-2特异性阻断剂能够减缓小鼠动脉粥样硬化斑块的早期发展。基于上述研究,高水平的Ang-2可能使患者易于在PCI后发生心血管事件。而在我们的研究中心,我们发现AT1-AA滴度阳性亚组患者,血清VEGF、Ang-2水平高于AT1-AA滴度阴性亚组患者,并且这部分患者血清炎症因子IL-6、CRP、IFN-γ也处于较高水平,说明血清AT1-AA滴度阳性反映了冠脉内皮细胞受损情况以及内膜增生情况,是导致ISR发生的病变基础。Li等也证实,AT1-AA可诱导内皮细胞高表达IL-6、 VCAM-1、MCP-1等促炎性细胞因子,并激活NF-κb 通路,且AT1-AA对NF-κb 炎症通路的影响是通过AT1R的激活而介导,说明AT1-AA具有类似于Ang-2的激动效应,也是ARB缬沙坦可用于预防PCI后ISR发生的分子机制之一。
综上所述,PCI后血清AT1-AA滴度阳性与ISR的发生风险存在独立的相关性,可能与冠脉内皮细胞受损及内膜增生有关,检测血清AT1-AA滴度的分布特征有助于预测PCI后ISR的发生。但需进一步研究来阐述AT1-AA在ISR发生中的确切作用,并扩大样本量以确定它在临床实践中有效地作为生物标志物的潜力。

