外周血单个核细胞miR-214与急性心肌梗死患者免疫趋化因子表达的相关性
冷佰桦,孟瑜,朱志林,付文军
急性心肌梗死(AMI)是冠状动脉(冠脉)粥样硬化最重要的并发症之一[1],不仅涉及脂类失衡、炎症反应等机制[2],且与环境、遗传等因素导致的免疫系统紊乱密切相关[3],其中免疫趋化因子在斑块破裂、血小板聚集和血栓形成等过程中占据重要位置[4]。既往研究证实,趋化因子/趋化因子功能性受体2(CCR2)信号轴介导的信号传递过程在心血管疾病中呈过度激活状态,持续聚集单核细胞亚群,促进或加重血管内皮组织的炎症反应[5]。近年来越来越多研究发现,miRNAs对趋化因子有一定调控作用[6,7]。miR-214是AMI发生、进展过程中的重要分子,属于保护性miRNAs[8],但其调控机制尚不明确,我们在前期调研工作中发现,miR-214存在与CCR2基因靶向结合序列,推测可能对于AMI患者免疫趋化因子的调控有一定的影响。本研究期望通过分析AMI患者外周血单个核细胞miR-214表达量与免疫趋化因子的相关性,为进一步阐述AMI的发生发展机制并寻找潜在的治疗靶点提供新的思路。
1 资料与方法
1.1 研究对象前瞻性选择2019年1月~2019年12月因急性胸闷胸痛于宜昌市第一人民医院(三峡大学人民医院)心血管内科就诊患者174例,其中男性118例,女性56例,平均年龄(59.92±9.86)岁,所有患者就诊时均接受冠脉造影术(CAG)检查。其中排除冠状动脉粥样硬化性心脏病(冠心病)者45例,为CAG正常组;其余129例确诊为AMI,为AMI组,其中男性83例,女性46例,平均年龄(60.27±10.29)岁。根据心电图结果,ST段抬高型心肌梗死患者55例(STEMI组),非ST段抬高型心肌梗死患者74例(NSTEMI组)。AMI患者纳入标准:①根据缺血性胸痛的临床病史、胸痛、胸闷等临床症状(持续时间超过30 min),扫描18导联心电图(常规12导联+V7~V9、V3R~V5R)的动态演变,监测血清心肌损伤标志物的动态变化,符合中华医学会心血管病学分会所制定的AMI诊断标准[9];②舌下含服硝酸甘油或者麝香保心丸不能完全缓解症状;③首次确诊;④发病12 h内就诊。排除合并恶性肿瘤、肝肾功能不全、急慢性感染及其他器质性疾病者。所有患者及家属均被知情并签署同意书。本研究获我院医学伦理委员会批准。
1.2 样本采集所有患者入院后立即采肘静脉血5 ml,置于EDTA抗凝管中,采用Ficoll法分离单个核细胞(PBMCs),用4%胎盘蓝染液染色,记录活性细胞数,活细胞百分数>95%则可用于后续实验。将PBMCs置于-80℃冰箱中保存备用。
1.3 CAG由放射影像科副主任级医师采用标准Judkins法[10]完成CAG检查,左冠脉行6体位投照和右冠脉行4体位投照。采用飞利浦Allura Xper FD20悬吊球管平板数字血管机(荷兰飞利浦公司)辅助图像处理系统定量分析冠脉病变支数和狭窄程度,进行SYNTAX评分[11]:<22分为轻度病变亚组,22~32分为中度病变亚组,>32分为重度病变亚组。
1.4 实时荧光定量PCR法检测miR-214表达取PBMCs样本,加入TRIzol裂解试剂(北京AidLab公司),采用miRNeasy血清/血浆快速提取试剂盒(北京AidLab公司)提取miRNAs,采用PrimeScript miRNA cDNA合成试剂盒(大连宝生生物工程公司)合成cDNA,37℃ 60 min(poly(A)加尾和逆转录反应),85℃ 5 s(酶失活)。取1 μg cDNA模板采用SYBR Premix Ex TaqTMⅡ试剂盒(大连宝生生物工程公司)进行基因扩增,95℃ 10 s(预变性),1个循环;95℃ 5 s(变性),60℃ 10 s(退火),72℃ 1 min(延伸),40个循环。PCR引物购自上海生工生物工程有限公司。miR-214扩增上游引物为5’-GGG GCG AAT CAT TAT TTG CT-3 ’,下游引物为5 ’-GTG CGT GTC GTG GAG TCG-3’。小分子U6作为内参,上游引物为5’-CTC GCT TCG GCA GCA CA-3 ’,下游引物为5 ’-AAC GCT TCA CGA ATT TGC GT-3’。以2-Dct表示miR-214相对表达量。
1.5 血浆单核细胞趋化蛋白-1(MCP-1)水平检测采用ELISA试剂盒检测血浆MCP-1水平,试剂盒购自英国Abcam公司。
1.6 Western blot法检测PBMCs上CCR2蛋白表达量取PBMCs样本(1×106个),加入细胞裂解液裂解后以Bradford法测定蛋白浓度,BSA为标准品;取50 μg蛋白样本进行5%SDS-PAGE电泳,将目标蛋白电转至PVDF上,一抗和二抗分别孵育,ECL法显色。CCR2一抗购自武汉博士德公司。
1.7 血液生化指标检测采集空腹外周静脉血5 ml,检测总胆固醇(TC)、三酰甘油(TG)、高密度脂蛋白胆固醇(HDL-C)、低密度脂蛋白胆固醇(LDL-C),肌酸激酶同工酶(CK-MB)、肌钙蛋白I(cTnI)、血浆N末端脑钠肽前体(NTproBNP)、超敏C反应蛋白(hs-CRP)。
1.8 统计学处理所有数据均采用SPSS 19.0统计学软件分析,符合正态分布的计量资料采用均数±标准差(±s)表示,两组间均数的比较采用t检验;偏正态分布变量以中位值(P25,P75)表示,进行秩和检验。计数资料采用例数(构成比)表示,组间比较采用χ2检验。连续变量采用Pearson相关性分析。采用多重线性回归分析不同因素之间的相关性。P<0.05为差异有统计学意义。
2 结果
2.1 AMI组和CAG正常组基线资料比较比较AMI组和CAG正常组受试者基线资料,两组人群的年龄、性别构成、体质指数、吸烟史、饮酒史、糖尿病史、HDL-C水平比较,差异无统计学意义(P>0.05)。但AMI组患者高血压史比例、TC、TG、LDL-C、CK-MB、cTnI、NT-proBNP、hs-CRP水平均显著高于CAG正常组,差异有统计学意义(P<0.05,表1)。
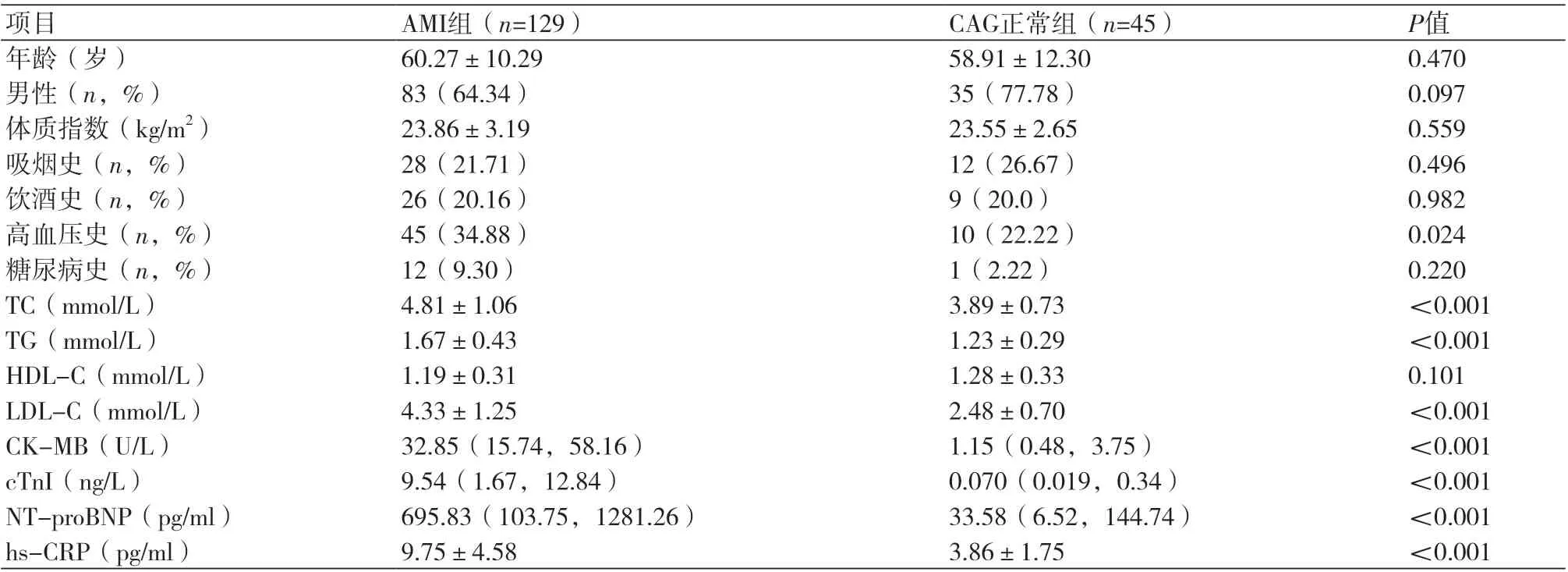
表1 AMI组和CAG正常组受试者基线临床资料比较
2.2 AMI组和CAG正常组外周血单个核细胞miR-214水平比较AMI组和CAG正常组受试者外周血单个核细胞miR-214表达量分别为(1.00±0.13)和(0.81±0.28),经t检验,差异有统计学意义(t=4.384,P<0.05),AMI组患者外周血单个核细胞miR-214表达量低于CAG正常组。
2.3 AMI组和CAG正常组血浆MCP-1浓度和外周血单个核细胞CCR2蛋白水平比较AMI组和CAG正常组受试者血浆MCP-1浓度分别为(97.85±23.86)pg/ml和(133.90±47.48)pg/ml,外周血单个核细胞CCR2蛋白水平分别为(0.48±0.16)和(0.67±0.29),经t检验,差异有统计学意义(t=4.876,4.174,P<0.05),AMI组患者血浆MCP-1浓度和外周血单个核细胞CCR2蛋白水平均高于CAG正常组。
2.4 AMI组患者外周血单个核细胞miR-214水平和血浆MCP-1浓度、外周血单个核细胞CCR2蛋白水平的相关性经miRWalk、miRanda、PITA、TargetScan在线生物学软件检索,并进一步进行维恩汇总分析,富集分析和文献分析发现CCR2可能为miR-214靶基因,通过软件分析发现hsa-miR-214与CCR2存在3'UTR结合区域。经Pearson相关性分析,AMI组患者外周血单个核细胞miR-214水平和血浆MCP-1浓度、外周血单个核细胞CCR2蛋白水平均呈负相关性(r=-0.590,-0.433,P<0.05),图1~2。

图1 hsa-miR-214的靶基因汇总维恩图及与CCR2基因靶向结合序列
2.5 AMI组患者外周血单个核细胞miR-214水平和CCR2蛋白水平、血浆MCP-1浓度与冠脉病变严重程度的关系随着冠脉SYNTAX评分增加,患者外周血单个核细胞miR-214水平逐渐降低,同时外周血单个核细胞CCR2蛋白水平和血浆MCP-1浓度则逐渐升高,差异有统计学意义(P<0.05),表2。

表2 不同冠脉病变程度患者外周血单个核细胞miR-214水平和CCR2蛋白水平、血浆MCP-1浓度比较
2.6 多重线性回归分析以SYNTAX评分为因变量,纳入TC、TG、LDL-C、CK-MB、cTnI、NTproBNP、hs-CRP、miR-214、MCP-1及CCR2作为因变量,进行多元线性回归分析,结果显示CK-MB、cTnI、NT-proBNP、miR-214、MCP-1及CCR2与SYNTAX评分均存在线性回归关系(P<0.05),表3。
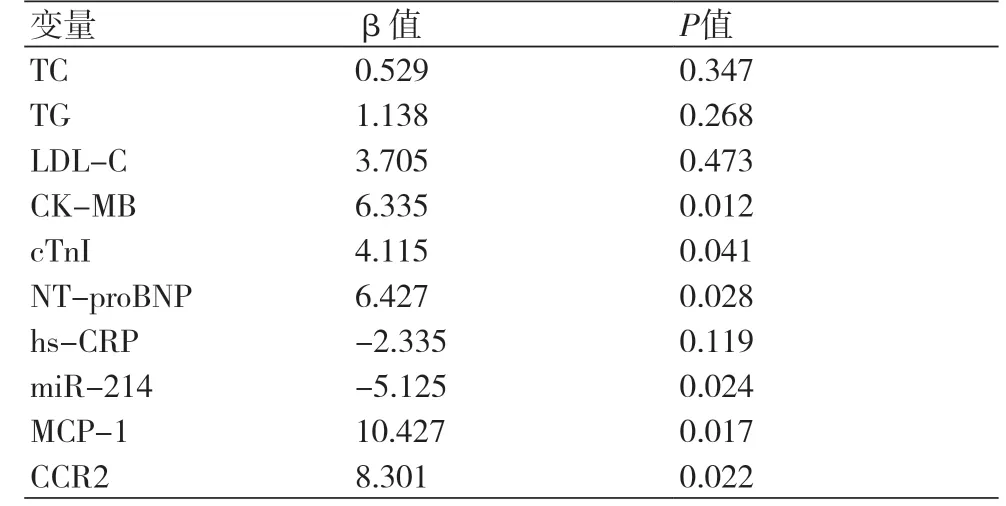
表3 AMI患者SYNTAX评分的多重线性回归分析
3 讨论
miRNA是普遍存在于真核生物体内一类重要的调控相关因子转录后翻译或生物合成的小分子(19~25nt)内源性非编码RNA,在心血管疾病领域中发挥着重要作用[12],一些miRNAs逐渐被证实具有AMI诊断或靶向治疗的潜力[13]。最近一项研究发现,miR-214在小鼠心肌梗死及缺血再灌注损伤中具有一定保护作用[14],但其作用机制尚不明确。本研究中,我们发现,AMI患者外周血单个核细胞miR-214表达量低于非冠心病人群,且随冠脉病变程度的增加而进一步降低,说明miR-214在心肌梗死中可能属于保护性miRNAs。为进一步探索其作用机制,通过检索miRWalk、miRanda、PITA、TargetScan在线生物学软件,并进行维恩汇总分析发现,CCR2可能是miR-214的靶基因,两者存在3'UTR结合序列。
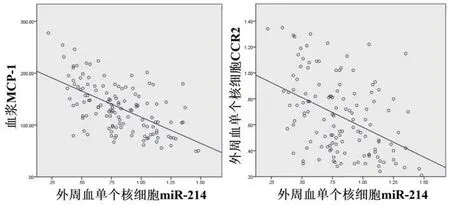
图2 AMI组患者外周血单个核细胞miR-214水平和血浆MCP-1浓度、外周血单个核细胞CCR2蛋白水平的Pearson相关性
AMI是冠脉粥样硬化疾病的急症表现,与机体非特异性免疫炎症反应密切相关,其中趋化因子及其功能性受体介导的单核细胞定向移动在诱发动脉管壁炎症反应过程中发挥着关键作用。趋化因子家族是由一系列结构类似的小分子肝素结合多肽组成的分泌型蛋白家族,对于单核细胞、巨噬细胞等都有一定的趋化或招募作用,不仅促进易损斑块破裂或血栓生成等,还参与免疫应答、促进刺激血管平滑肌细胞和内皮细胞产生组织因子等[15]。因此趋化因子及其功能性受体表达水平升高可能是诱发动脉管壁炎症反应的重要机制之一。
本世纪初,葛红霞等[16]发现急性心肌梗死大鼠在建模早期,梗死区域的趋化因子包括RANTES、MIP-1α、MIG表达量即开始升高,随后逐渐降低至正常,推测趋化因子可能是诱导T细胞浸润心肌组织的始动因子。此外,曹禹等[17]证实CCL2(即MCP-1)以自分泌/旁分泌方式参与STEMI患者残余血小板高反应,其作用机制可能与激活p38MAPK-HSP27信号通路有关。曲楠等[18]也证实急性心肌梗死患者CCL2/CCR2表达与血小板聚集率关系密切,CCL2/CCR2可能通过影响血小板聚集率参与心肌梗死疾病进展。MCP-1是由成纤维细胞,平滑肌细胞,人血管内皮细胞分泌的趋化因子CC亚家族成员之一。本研究中通过临床实验证实AMI患者血浆MCP-1浓度显著高于CAG正常组人群,与既往多数研究结论基本一致。其原因可能与趋化并激活单核/巨噬细胞,进而启动动脉管壁炎症级联反应有关。
CCR2受体是MCP-1最具亲和力的G蛋白耦联受体之一,多表达于嗜碱性粒细胞、单核细胞、血管平滑肌细胞、自然杀伤细胞和T细胞等[19]。Franca等[20]认为MCP-1及其受体CCR2表达量升高是心肌缺血再灌注损伤早期主要病理变化之一,两者结合后可激活MCP诱导蛋白MCP-IP,通过上调caspase家族成员的表达,促进心肌细胞凋亡,这可能是引起心肌梗死后心室重构的重要作用机制之一。本研究中,我们证实了外周血单个核细胞CCR2蛋白随着血浆MCP-1表达量升高而增加,且与冠脉病变程度呈正相关性。基于上述结果,MCP-1/CCR2传导途径在心肌梗死发生发展过程中发挥了重要作用,降低该通路的激活可有效防止和改善该疾病进展。而miR-214对于MCP-1/CCR2的激活具有一定的调控作用。通过Pearson相关性分析,AMI组患者外周血单个核细胞miR-214水平和血浆MCP-1浓度、外周血单个核细胞CCR2蛋白水平均呈负相关性(r=-0.590,-0.433,P<0.05),且与冠脉病变程度存在一定的线性关系。提示miR-214在心肌梗死后表达量降低,进而促进调控免疫趋化因子MCP-1/CCR2的作用,使其参与到免疫单核细胞的趋化、聚集、微炎症反应发生及心肌纤维重塑等进程中,从而介导急性缺血后的心肌损伤机制
综上所述,AMI患者外周单个核细胞miR-214表达量降低,且与MCP-1/CCR2传导通路的激活存在负向调控关系,推测这可能是加重AMI疾病进展的重要机制之一,从而为心血管治疗靶点miRNAs的研究提供新的思路,但其具体调控网络尚需进一步深入探索。

