分析保护剂对烟草香味成分的基质效应补偿
史天彩,潘立宁,王晓瑜,秦亚琼,郭 琼,谢 飞,谢复炜,刘惠民
中国烟草总公司郑州烟草研究院,郑州高新技术产业开发区枫杨街2 号 450001
GC-MS 法用于痕量分析时常存在基质效应[1-2],即样品中除待测物以外的其他基质成分对待测物测定的影响。由于GC 进样口和色谱柱内存在金属离子和硅醇基活性位点,敏感性待测物在活性位点发生吸附作用或降解,导致待测物损失或色谱峰拖尾[3]。测定实际样品时,样品基质中的其他活性成分填充了GC 活性位点,减少了待测物与活性位点的相互作用,改善了色谱峰形和峰高,导致相同质量分数待测物在实际样品中的响应值高于纯溶剂中,这种现象被称为“基质增强效应”[1]。目前,对基质效应的补偿方法主要有基质匹配标准溶液校正法[4-6]、同位素内标法[7]、多种内标校正法[8]、进样技术改进法[9-10]、样品多次净化法[11-12]、加入分析保护剂法[13-22]等。其中,最常用的是基质匹配标准溶液校正法,即利用不含待测物的空白基质匹配标准溶液对样品溶液进行校准,从而补偿基质效应。然而,在实际分析检测中,采用基质匹配校正法主要存在以下3 点不足:一是不含待测物的空白基质不易获得,二是不同类型样品基质之间有差异,三是基质匹配标准溶液可使用的时间期限一般很短,需要现用现配,而基质匹配标准溶液的配制复杂且耗时。
在标准溶液中加入分析保护剂(Analyte protectant,AP),使AP 代替基质占据GC 活性位点,从而改善溶剂标准溶液中待测物的响应及峰形,达到基质效应补偿的效果。Anastassiades 等[2]在2003 年选择93 种不同化合物作为AP,评估了其对提高30 种农药残留分析质量的影响,结果表明,AP 的氢键能力和挥发性是影响基质效应补偿效果的重要因素,其中L-古洛糖酸γ-内酯的整体补偿效果最好,然而,单一的AP 并不能使30 种农药残留的响应和峰形均达到最优。Cajka 等[13]在2005 年评价了十几种AP 组合,所选择的最佳组合为3-乙氧基-1,2-丙二醇、L-古洛糖酸γ-内酯和D-山梨醇,三者的挥发性由高到低,组合后可以满足挥发性差异较大的不同农残组分的分析。但是,L-古洛糖酸γ-内酯和D-山梨醇极性较大,配制溶液过程中一般需引入水,这样会影响GC 系统的长期稳定性;同时受溶解性的影响,不适用于极性较弱的溶剂体系中待测物的测定。另外,目前关于AP 补偿基质效应的研究主要针对农残化合物[13-18],对于香味成分在烟草中的基质效应研究尚未见报道。因此,本研究中选择V乙腈∶V二氯甲烷=2∶1体系作为弱极性溶剂体系,开展了AP 对烟草中香味成分的基质效应补偿研究,旨在为AP 适用范围的扩展以及烟草香味成分分析中基质效应的补偿提供技术支撑。
1 材料与方法
1.1 材料、试剂和仪器
2019 年云南产C3F 中部烟叶样品。
QuEChERS 萃取试剂盒(4 g 硫酸镁+1 g 氯化钠,美国Agilent 公司);46 种香味成分标准品及内标己酸甲酯(>98%,美国Sigma 公司、东京化成工业株式会社、加拿大TRC 公司或北京百灵威科技有限公司等);23 种分析保护剂(>95%,上海阿拉丁试剂有限公司、东京化成工业株式会社和北京百灵威科技有限公司等);磷酸(AR,天津市科密欧化学试剂有限公司);磷酸二氢钠(AR,国药集团化学试剂有限公司);乙腈和甲醇(色谱纯,美国J T Baker 公司);二氯乙烷(色谱纯,美国Omni Chem 公司);二氯甲烷(色谱纯,德国Merck 公司);超纯水(自制,电阻率18.2 MΩ·cm)。
7890N 气相色谱-5975C 质谱联用仪(美国Agilent 公司);Multi Reax 试管震荡器(德国Heidolph 公司);Sigma 3-30KS 高速冷冻离心机、CPA225D 电子分析天平(感量0.000 1 g)(德国Sartorius 公司);Milli-Q 超纯水仪(美国Millipore公司);Sigmole-NYL1111A 有机相滤膜(尼龙,13 mm×0.22 µm,上海科醚化学科技有限公司)。
1.2 方法
1.2.1 溶液配制
内标工作溶液:准确称取100 mg 己酸甲酯(精确至±0.1 mg),用二氯乙烷溶解并定容至10 mL,配制成浓度为10 000 mg/L 的内标储备液,于4 ℃下储存;准确移取0.1 mL 内标储备液于10 mL 容量瓶中,用V乙腈∶V二氯甲烷=2∶1 的溶剂定容,配制成浓度为100 mg/L 的内标工作溶液。
混合标准工作溶液:准确称取各香味成分标准品100 mg(精确至±0.1 mg),用二氯乙烷溶解并定容至10 mL,配制成质量浓度为10 000 mg/L 的单标储备液。准确移取0.1 mL 各单标储备液于同一个50 mL 容量瓶中,用V乙腈∶V二氯甲烷=2∶1 的溶剂定容,配制成各香味成分的浓度均为20 mg/L 的混合标准工作溶液。
单一分析保护剂溶液:准确称取200 mg 各分析保护剂(精确至±0.1 mg),选用合适的溶剂溶解并定容至10 mL,配制成质量浓度均为20 000 mg/L的单一分析保护剂溶液。
3 种溶剂体系下的香味成分标准溶液:
①溶剂标准溶液:采用V乙腈∶V二氯甲烷=2∶1 的混合溶剂,配制一定浓度的香味成分标准溶液;移取1 mL 该标准溶液,加入50 μL 如前的混合溶剂。
②“溶剂+AP”标准溶液:采用V乙腈∶V二氯甲烷=2∶1的溶剂配制一定浓度的香味成分标准溶液;移取1 mL 该标准溶液后,加入50 μL AP 溶液(20 000 mg/L)。
③烟草基质匹配标准溶液:采用烟草基质提取液为溶剂,配制一定浓度的香味成分标准溶液;移取1 mL 该标准溶液后,加入50 μL 如①中的混合溶剂。
磷酸盐缓冲溶液:准确称取2.80 g 磷酸以及10.00 g 磷酸二氢钠,加入100 mL 超纯水,超声、搅拌至溶解,常温放置。
色谱、质谱条件:
色谱柱:DB-5MS UI 弹性石英毛细管色谱柱(60 m×0.25 mm i.d.×0.25 μm d.f.);进样口温度:290 ℃;程序升温:40 ℃(3 min);进样模式:不分流进样;不分流时间:1 min;隔垫吹扫流速:3 mL/min;载气:氦气(99.999%);恒流流速:1.5 mL/min;进样量:0.5 μL。电离模式:电子轰击(EI);电离能量:70 eV;灯丝电流:35 μA;离子源温度:230 ℃;四极杆温度:150 ℃;传输线温度:280 ℃;检测方式:选择离子监测(SIM)模式。31 种香味成分及内标的保留时间(RT)和SIM 扫描离子见表1,选择离子流图见图1。

图1 31 种香味成分及内标的选择离子流图Fig.1 Selective ion chromatogram of 31 aroma components and internal standard

表1 31 种香味成分的保留时间和SIM 扫描离子Tab.1 Retention time and SIM ions of 31 aroma components

表1(续)
1.2.2 烟草基质制备
将实验所用烟叶研磨成粉,过0.38 mm(40目)筛。准确称取1.00 g 样品于50 mL 具塞离心管中,加入10 mL 磷酸盐缓冲溶液使其完全浸润样品,静置20 min;加入10 mL 乙腈,以2 500 r/min涡旋萃取10 min,-18 ℃冷冻30 min;取出后加入4.00 g 无水硫酸镁、1.00 g 氯化钠并迅速剧烈摇晃,然后加入5 mL 二氯甲烷,再依次以2 500 r/min 涡旋10 min,8 000 r/min 离心3 min,取上清液过有机相滤膜后转移至储液瓶中。
2 结果与讨论
2.1 分析保护剂的选择
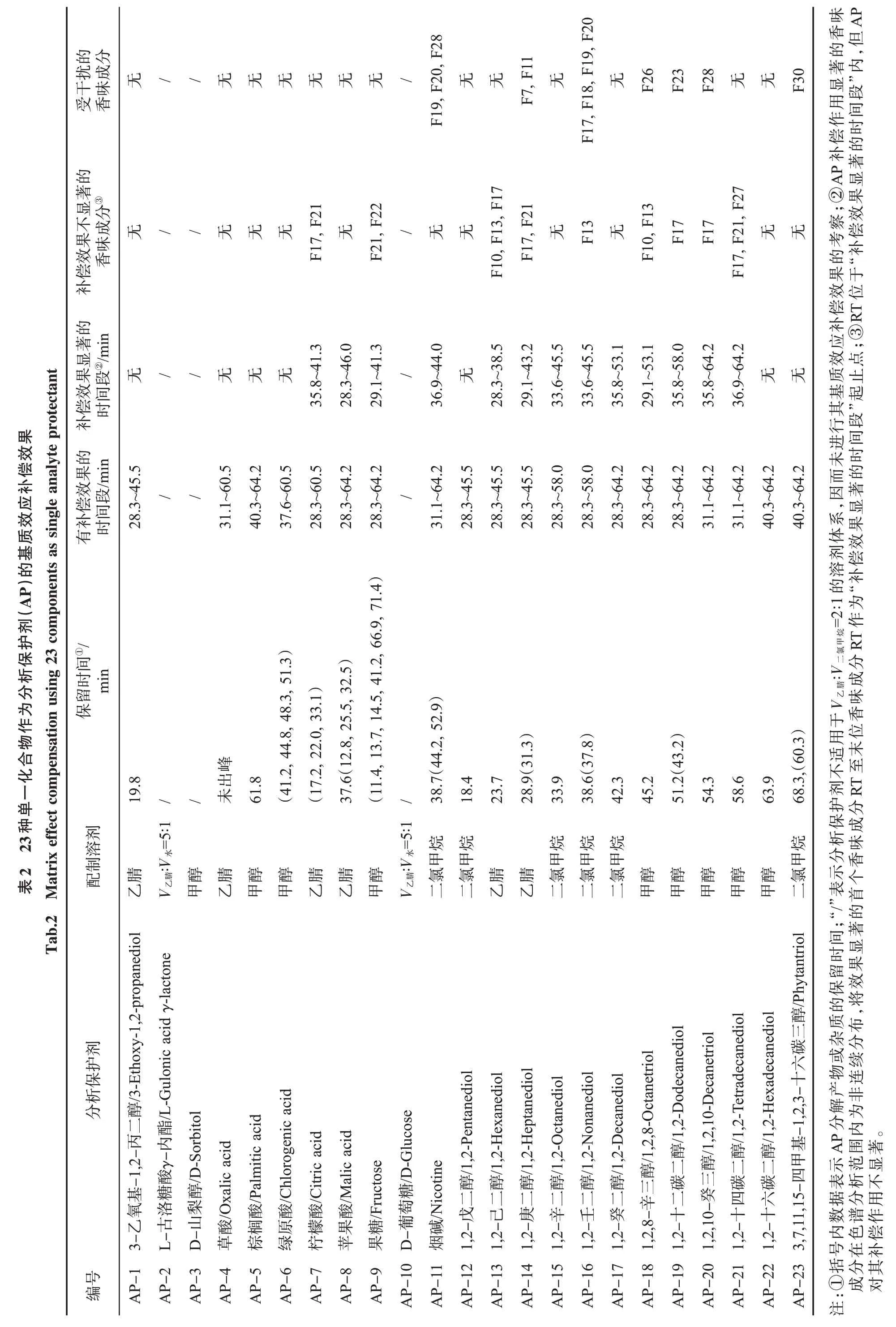
通常,一种理想的分析保护剂(或组合)的选择需要考虑的主要因素有:①在溶液中和GC 系统中与待测物不发生反应;②不干扰待测物的检测;③不影响GC 系统和检测器的性能;④无毒、廉价且实用性高。本研究中初选了23 种分析保护剂(表2),主要包括3 类:①文献中常用的对敏感性化合物色谱峰有良好保护效果的3 种化合物(3-乙氧基-1,2-丙二醇、L-古洛糖酸γ-内酯和D-山梨醇);②在烟叶中质量分数较高的部分化合物(果糖、葡萄糖、绿原酸、烟碱、草酸、苹果酸、柠檬酸、棕榈酸);③含不同碳原子数的二元及三元碳醇类化合物(1,2-戊二醇、1,2-己二醇、1,2-庚二醇、1,2-辛二醇、1,2-壬二醇、1,2-癸二醇、1,2,8-辛三醇、1,2-十二碳二醇、1,2,10-癸三醇、1,2-十四碳二醇、1,2-十六碳二醇、3,7,11,15-四甲基-1,2,3-十六碳三醇)。
根据分析保护剂的溶解性,选择合适的有机溶剂配制成浓度为20 000 mg/L 的单一分析保护剂溶液(配制溶剂见表2)。由于L-古洛糖酸γ-内酯和葡萄糖的极性较强,采用乙腈配制的同时引入了一定量水进行助溶。
2.2 分析保护剂对香味成分色谱峰的影响
2.2.1 香味成分基质效应考察
选择31 种香味成分(表1),种类包括醇、酚、醚、醛、酮、酯/内酯、烷烃和含氮化合物等,沸点为162~360 ℃,覆盖了GC 可测化合物的挥发性范围。为了便于基质效应考察以及分析保护剂效果评价,这31 种香味成分在所选烟草样品中为未检出。
对比了0.2 mg/L各香味成分在V乙腈∶V二氯甲烷=2∶1溶剂与烟草基质中的色谱峰,以峰高[23](己酸甲酯为内标进行校正,己酸甲酯基本不受基质效应影响)和对称因子为评价指标,考察其受基质效应的影响。结果见表3,31 种香味成分基质与溶剂峰高的比值范围为0.99~8.27,在溶剂和烟草基质中的对称因子范围分别为0.96~6.52 和0.90~1.52。其中,10 种香味成分基本不受基质效应影响,基质与溶剂峰高的比值小于1.20;21 种香味成分受基质效应影响,基质与溶剂峰高的比值大于1.20。尤其是有10种香味成分受基质效应影响比较明显,在溶剂中色谱峰较低,拖尾较严重;而在基质中峰形较好(基质与溶剂峰高的比值大于2,溶剂中对称因子大于1.9,基质中对称因子趋于1),分别为3,4-二甲酚、大茴香醛、α-甲基肉桂醛、δ-壬内酯、β-萘甲醚、异丁酸3-苯基丙酯、丙烯基乙基愈创木酚、δ-十二内酯、苯乙酸对甲苯酯和δ-十四内酯。

表3 31 种香味成分在溶剂和烟草基质中的色谱峰对比Tab.3 Chromatographic peaks of 31 aroma components in solvent and tobacco matrix
2.2.2 单一分析保护剂对香味成分色谱峰的影响
以上述受基质效应影响(基质与溶剂峰高的比值大于1.20)的21 种香味成分为分析对象,采用峰高为评价指标[23],考察在0.2 mg/L 香味成分标准溶液中加入1 000 mg/L 单一AP 溶液后色谱峰的变化,并与烟草基质匹配标准溶液中的色谱峰进行对比。通常当待测物在基质中的响应与在溶剂中的响应相比超过定量方法要求的回收率上限时,认为有基质效应存在[23]。GB/T 27404—2008[24]中对于待测物回收率范围要求:当待测组分质量分数为0.1~1.0 mg/kg 时,回收率范围为80%~110%;当待测组分质量分数小于0.1 mg/kg时,回收率范围为60%~120%。综合考虑,本研究中以±20%作为判断基质效应补偿效果的标准,即当“溶剂+AP”标准溶液中香味成分色谱峰高大于溶剂标准溶液中峰高的20%及以上,认为AP 对香味成分有一定的基质效应补偿效果;而达到基质中峰高的80%及以上,认为有比较显著的基质效应补偿效果。23 种单一化合物作为分析保护剂的基质效应补偿效果见表2。
3-乙氧基-1,2-丙二醇、L-古洛糖酸γ-内酯和D-山梨醇为文献中常见的对敏感性化合物色谱峰有良好基质效应补偿效果的分析保护剂[2-3]。本研究结果显示,3-乙氧基-1,2-丙二醇的保留时间为19.8 min,对保留时间范围为28.3~45.5 min 的16 种香味成分具有一定的基质效应补偿作用(受到基质效应影响的21 种香味成分的保留时间范围为28.3~64.2 min),但并未显示出显著的补偿效果,3-乙氧基-1,2-丙二醇的加入不会干扰香味成分的测定。于1 mL 0.2 mg/L 香味成分标准溶液中加入50 μL L-古洛糖酸γ-内酯或D-山梨醇溶液后,溶液出现分层现象,L-古洛糖酸γ-内酯和D-山梨醇极性较强,不适用于当前V乙腈∶V二氯甲烷=2∶1的弱极性溶剂体系。
选用烟叶中质量分数较高的成分作为AP 时,苹果酸、果糖对受到基质效应影响的21 种香味成分均有一定的基质效应补偿作用。苹果酸对保留时间范围为28.3~46.0 min 的17 种香味成分补偿效果显著,可以达到基质匹配标准溶液中相应色谱峰峰高的80%及以上,并且不干扰待测香味成分的定量。果糖对保留时间范围为29.1~41.3 min(除δ-壬内酯和癸酸乙酯外)的10 种香味成分补偿效果显著。图2 中给出了苹果酸对其基质效应补偿效果显著的部分香味成分,可以看出,3,4-二甲酚、大茴香醛、α-甲基肉桂醛、β-萘甲醚、δ-壬内酯和丙烯基乙基愈创木酚6 种香味成分在溶剂标准溶液中的色谱峰响应较低,且存在不同程度的拖尾,加入苹果酸后,其响应值明显增大,峰形变高、变窄,3,4-二甲酚、大茴香醛、α-甲基肉桂醛、β-萘甲醚4 种香味成分在“溶剂+AP”标准溶液中的色谱峰与在基质匹配标准溶液中的色谱峰基本一致,δ-壬内酯和丙烯基乙基愈创木酚2 种香味成分在“溶剂+AP”标准溶液中的色谱峰峰高达到了基质匹配标准溶液的80%以上,与溶剂标准溶液相比色谱峰峰高均增加了约3.5 倍。

图2 苹果酸基质效应补偿效果显著的6 种代表性香味成分Fig.2 Six representative aroma components with remarkable matrix effect compensation by malic acid
绿原酸、草酸、棕榈酸、柠檬酸和烟碱分别对不同保留时间段内出峰的香味成分有一定的基质效应补偿效果。绿原酸、草酸和棕榈酸无显著的补偿效果,柠檬酸对35.8~41.3 min 出峰(除α-甲基肉桂醛和δ-壬内酯外)的6 种香味成分补偿效果较为显著,烟碱对36.9~44.0 min 出峰(除α-甲基肉桂醛和δ-壬内酯外)的5 种香味成分基质效应补偿效果较为显著。烟碱干扰丁酸苯甲酯、乙酸香茅酯和δ-十二内酯3 种香味成分的定量。D-葡萄糖与香味成分标准溶液不混溶,不适用于V乙腈∶V二氯甲烷=2∶1 的弱极性溶剂体系。
考察了12 种二元及三元醇类化合物作为AP对香味成分的基质效应补偿效果。含有相同羟基数量的多元醇类化合物,随分子中碳原子数增加,其保留时间递增。1,2-戊二醇出峰较早,保留时间为18.4 min,对保留时间范围为28.3~45.5 min的16 种香味成分具有一定的基质效应补偿作用,但未显示出显著的补偿效果。1,2-己二醇和1,2-庚二醇分别对保留时间范围为28.3~45.5 min 的部分香味成分具有一定的基质效应补偿作用,1,2-辛二醇和1,2-壬二醇分别对保留时间范围为28.3~58.0 min 的香味成分具有一定的基质效应补偿作用,并且补偿效果显著的时间段随保留时间的增加而向后移动。1,2-癸二醇、1,2,8-辛三醇和1,2-十二碳二醇对受到基质效应影响的香味成分分别表现出不同程度的基质效应补偿作用,1,2-癸二醇对35.8~53.1 min 的13 种香味成分补偿效果显著,1,2,8-辛三醇对29.1~53.1 min(除3,4-二甲酚和大茴香醛外)的14 种香味成分补偿效果显著,1,2-十二碳二醇对35.8~58.0 min(除α-甲基肉桂醛外)的12 种香味成分补偿效果显著。1,2,10-癸三醇、1,2-十四碳二醇、1,2-十六碳二醇和3,7,11,15-四甲基-1,2,3-十六碳三醇出峰时间较晚,随保留时间的增加,有一定基质效应补偿作用的时间段起点向后移动,时间段范围缩短,1,2,10-癸三醇对35.8~64.2 min(除α-甲基肉桂醛外)的14 种香味成分基质效应补偿效果显著,1,2-十四碳二醇对36.9~64.2 min(除α-甲基肉桂醛、δ-壬内酯和丙烯基乙基愈创木酚外)的12 种香味成分基质效应补偿效果显著,1,2-十六碳二醇和3,7,11,15-四甲基-1,2,3-十六碳三醇无显著的基质效应补偿效果。对香味成分具有显著补偿效果的二元及三元醇类AP 中,除1,2-己二醇、1,2-辛二醇、1,2-癸二醇和1,2-十四碳二醇外,其他对待测香味成分的定性定量检测均有不同程度的干扰。图3 为1,2-十四碳二醇对其基质效应补偿效果显著的部分香味成分。

图3 1,2-十四碳二醇基质效应补偿效果显著的6 种代表性香味成分Fig.3 Six representative aroma components with remarkable matrix effect compensation by 1,2-tetradecanediol
综上所述,在溶剂标准溶液中加入分析保护剂后,各香味成分的响应不同程度地增大,色谱峰形得到一定改善。这主要是由于衬管玻璃表面存在游离硅醇基和金属离子活性位点,当样品溶液在衬管中气化时,含有活性基团的分析保护剂在气化过程中迅速占据活性位点,一方面减少了香味成分在衬管中的不可逆吸附和降解,使到达检测器的香味成分增多,响应值增大;另一方面,减少了香味成分与活性位点的相互作用,抑制了色谱峰拖尾和展宽,峰形得到改善。
2.2.3 组合分析保护剂的考察
综上可以看出,单一AP 并不能对所有香味成分均具有显著的基质效应补偿效果,因此需要对不同的AP 进行组合。对比单一AP 基质效应补偿作用显著的时间段,组合后保证能完全覆盖待测香味成分,并且不干扰其定性定量检测。
由上述分析可知,在21 种受基质效应影响的香味成分中,苹果酸对其中17 种香味成分有显著的基质效应补偿作用,对δ-十二内酯、苯乙酸对甲苯酯、δ-十四内酯和香紫苏内酯4 种香味成分有一定的基质效应补偿作用,但未达到烟草基质匹配标准溶液中色谱峰峰高的80%,而1,2-十四碳二醇对这4 种香味成分呈现显著的基质效应补偿作用,同时二者均不干扰待测香味成分的检测。因此,选择苹果酸+1,2-十四碳二醇作为组合AP。
进一步考察了不同浓度的苹果酸+1,2-十四碳二醇(各为200、500、1 000 mg/L)组合AP 对香味成分的基质效应补偿作用。如图4 所示,随苹果酸+1,2-十四碳二醇浓度的增加,其基质效应补偿效果越显著。当苹果酸和1,2-十四碳二醇的浓度均为1 000 mg/L 时,21 种香味成分的色谱峰峰高均达到烟草基质匹配标准溶液中对应色谱峰峰高的80%及以上。
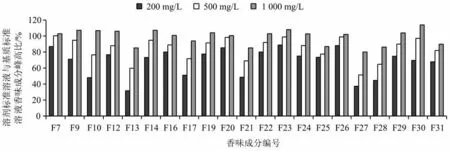
图4 加入不同浓度AP 组合的溶剂标准溶液与基质标准溶液中21 种香味成分峰高百分比Fig.4 The percentages of peak height of 21 aroma components in solvent standard added different concentrations of AP combination versus matrix standard
2.3 校正曲线的比较
分别配制了31 种香味成分的溶剂、“溶剂+AP组合”和烟草基质匹配标准溶液,3 种溶剂体系下标准溶液浓度均为5.00、2.00、1.00、0.50、0.20、0.10、0.05 mg/L,AP 组合为苹果酸和1,2-十四碳二醇(各1 000 mg/L)的组合。以各香味成分与内标的峰面积比对每种香味成分浓度作线性回归,得到31 种香味成分在3 种溶剂体系下的标准工作曲线,线性相关系数(r2)见表4。结果表明,在溶剂配制的混合标准溶液中添加苹果酸和1,2-十四碳二醇(各1 000 mg/L)后,标准工作曲线的线性得到了较大改善,31 种香味成分的r2均大于0.99,其中29 种香味成分的r2大于0.999。图5 以香味成分浓度为横轴,以其与内标峰面积的比值为纵轴,比较了β-萘甲醚、异丁酸3-苯基丙酯和苯乙酸对甲苯酯在3 种溶剂体系下的标准曲线。可以看出,这3 种香味成分的溶剂标准曲线的r2均小于0.99,线性较差;加入苹果酸和1,2-十四碳二醇(各1 000 mg/L)组合后,r2大于0.999,标准曲线与基质匹配标准曲线基本一致。

图5 β-萘甲醚(a)、异丁酸3-苯基丙酯(b)和苯乙酸对甲苯酯(c)标准曲线的比较Fig.5 Calibration curves of β-naphthyl methyl ether(a),3-phenylpropyl isobutyrate(b)and p-tolyl phenylacetate(c)

表4 31 种香味成分的溶剂、“溶剂+AP 组合”和基质匹配标准曲线的线性相关系数(r2)Tab.4 Linear correlation coefficient(r2)for calibration curves of 31 aroma components in solvent,“solvent+AP combination”and matrix
为进一步验证苹果酸和1,2-十四碳二醇(各1 000 mg/L)组合的基质效应补偿效果,选择了15种所选烟草样品中含有的香味成分(表5),比较了其在溶剂、“溶剂+AP 组合”和烟草基质匹配3种溶剂体系下的标准曲线(标准溶液浓度均为10.00、5.00、2.00、1.00、0.50、0.20、0.10、0.05 mg/L)。结果表明,加入AP 组合使烟叶中含有的15 种香味成分标准曲线的线性有了较大改善,r2均大于等于0.999,且标准曲线与基质匹配标准曲线的斜率比在0.9~1.1 之间。紫丁香醇、香兰素和棕榈酸乙酯在3 种溶剂体系下的标准曲线见图6,相比于溶剂匹配标准曲线,在3 种溶剂体系下的标准曲线的线性得到了较大改善,且斜率与基质匹配标准曲线基本一致。

图6 紫丁香醇(a)、香兰素(b)和棕榈酸乙酯(c)标准曲线的比较Fig.6 Calibration curves of 2,6-dimethoxyphenol(a),vanillin(b)and ethyl palmitate(c)
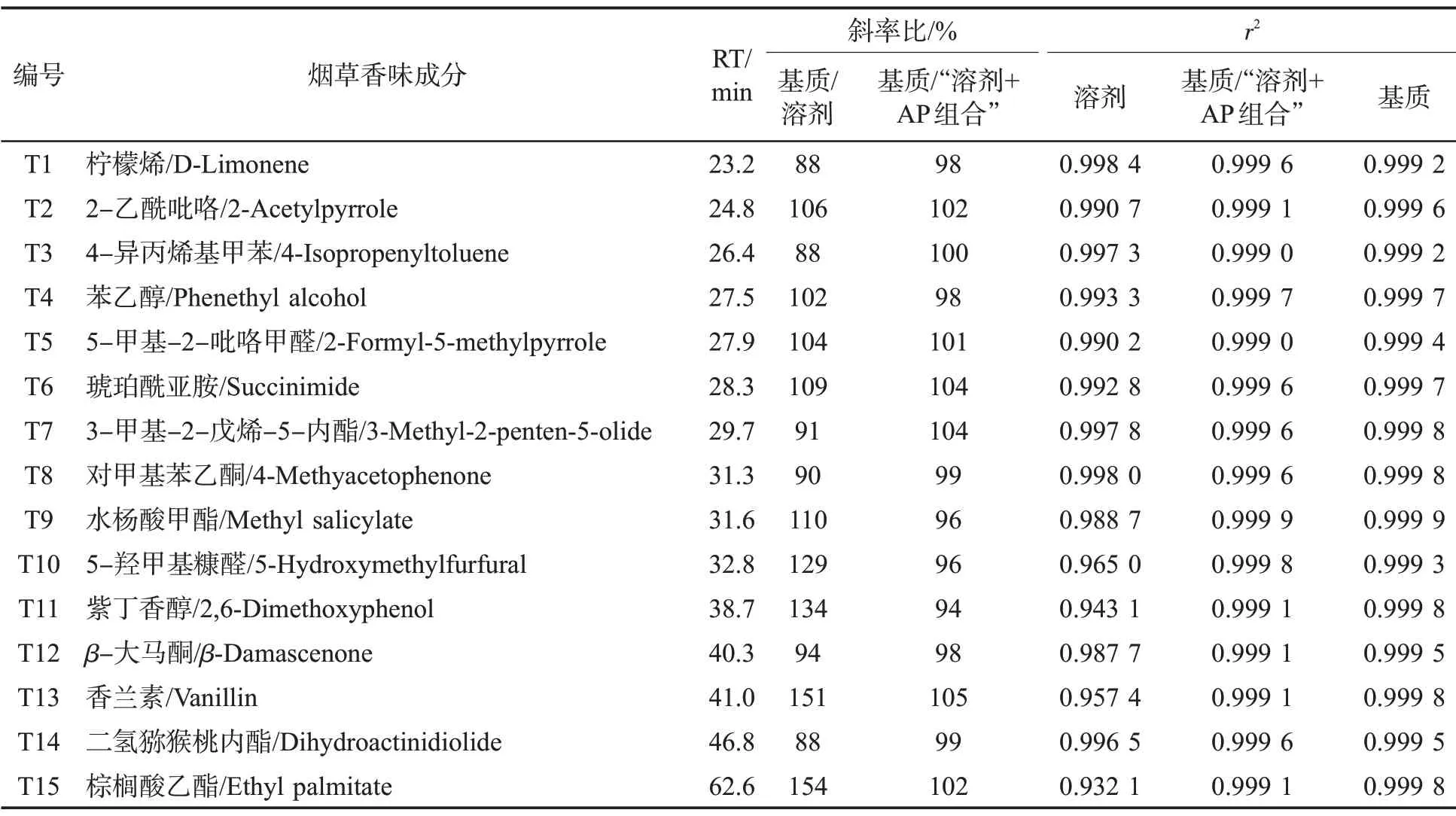
表5 15 种烟草香味成分的溶剂、“溶剂+AP 组合”和基质匹配标准曲线的对比Tab.5 Comparison of calibration curves of 15 tobacco aroma components in solvent,“solvent+AP combination”and matrix
3 结论
①在V乙腈∶V二氯甲烷=2∶1 的弱极性溶剂体系下,在溶剂标准溶液中加入分析保护剂,改善了敏感性香味成分的色谱峰形,提高了峰强度。②通过优化分析保护剂种类、组合及组合浓度,找到了补偿烟草香味成分基质效应的分析保护剂组合:苹果酸+1,2-十四碳二醇(浓度均为1 000 mg/L)。③验证结果显示,加入所选分析保护剂组合后,各烟草香味成分标准曲线的线性得到了较大改善,其斜率及线性相关系数(r2)与烟草基质匹配标准曲线基本一致,基质效应补偿效果良好。

