“秦氏疼痛方”外敷治疗后肢急性软组织损伤大鼠模型的实验研究
冯宇 王莉 张妹妹 董宇启 何荻 李鹤
下肢创伤骨折后伴发的急性软组织肿胀严重影响骨折的后续治疗,而目前临床上的常规方法效果欠佳。炎症反应已被证实是创伤后软组织肿胀等早期并发症的重要病理生理基础。本研究选取的外用中药经验方“秦氏疼痛方”(以下简称“疼痛方”),由全国著名中医秦亮甫教授提供处方,由上海交通大学医学院附属仁济医院中医科研制,拟通过研究其抗炎作用和机制,为“疼痛方”治疗急性软组织损伤提供更有力的基础理论依据。
1 材料与方法
1.1 主要药物、试剂及仪器
“疼痛方”(粉剂):方中豨莶草、马齿苋、防己3种药共为君药,黄柏、黄连、生石膏为臣药,大黄、芒硝、延胡索为佐药;生理盐水(浙江天瑞药业有限公司,批号为113021103);扶他林乳剂(北京诺华制药有限公司,批准文号为国药准字H19990291)。
SPF级健康、雄性、2月龄SD大鼠40只(上海斯莱克实验动物有限公司),体质量(251.91±11.08)g,饲养于上海西普尔-必凯实验动物有限公司,使用许可证号为SYXK(沪)2013-0058。
大鼠IL-1β、IL-6、TNF-α ELISA检测试剂盒(SIEMENS,德国);BCA蛋白定量试剂盒(THERMO,美国);抗大鼠IκBα抗体及NF-κB p65抗体(CST,美国)。
组织研钵(上海艾双商贸公司);恒温水浴箱(上海方瑞医疗器械厂);低温高速离心机(EPPENDORF,德国);Cobas e601自动生化分析仪(Roche,德国);BNII特定蛋白分析仪(SIEMENS,德国);PCR仪(Perkin Elmer,美国);Western-blot电泳设备(BIO-RAD,美国);超纯水仪(Thermo Fisher,美国);标准规格酶标仪(ThermoFisher,美国);超声清洗器(Cole-Parmer,美国);酶联免疫检测仪(BioTek,美国);台式水平离心机(EPPENDORF,美国);台式离心机(Coie-Parmer,美国);涡旋振荡仪(IKA MS2,德国);实时定量PCR仪(Roche,美国);多头磁力加热搅拌器(郑州盛达仪器有限公司);紫外/可见光光度计(NanoDrop,美国);ELISA检测试剂盒(R&D,美国)。
1.2 方法
1.2.1 实验动物分组
成年雄性SD大鼠共40只,随机分组,正常对照组(正常组)10只,另外30只制作急性软组织压榨伤大鼠模型后随机分为模型对照组(模型组)10只、扶他林乳剂对照组(扶他林组)10只以及“疼痛方”治疗组(疼痛方组)10只。
1.2.2 实验动物麻醉与造模
硫化钠(8%)麻醉成功后,使用自制软组织损伤击打器建立SD大鼠急性软组织压榨伤模型,软组织压榨伤模型制备参照文献[1]的方法。造模后,肉眼观察并查体。击打后左后肢出现肿胀、青紫、瘀血,但无皮肤破损,单侧左后肢跛行,无其他异常情况发生,确认造模成功。
1.2.3 实验药物的用药途径、方法
造模后6 h开始给药。正常组、模型组给予常温生理盐水纱布湿敷,环绕覆盖整个左后肢,每次湿敷2 h,间隔10 h后重复1次,共2~4次;扶他林组给予扶他林乳剂外涂于整个左后肢,厚度约3 mm,每次2 h,后用生理盐水洗净,间隔10 h重复1次,共2~4次;疼痛方组给予中药“疼痛方”粉剂,用适量生理盐水调成糊状外敷于整个左后肢,厚度约3 mm,每次2 h,后用生理盐水洗净,间隔10 h重复1次,共2~4次。
1.2.4 取材与标本制备
本实验分别于造模后24、48 h,各组取5只SD大鼠进行断颈处死,在造模局部用手术尖刀快速轻柔割取少量肌肉组织(注意需要沿肌肉纤维走行方向割取,避免对组织标本过度挤压、夹提、揉搅等),置于液氮保存。
1.3 试验指标检测与方法
1.3.1 大鼠损伤部位组织匀浆的制备与相关炎症因子表达评估
用电子分析天平称取已割取的软组织损伤局部肌肉组织标本,剪碎后匀浆,用低温高速离心机离心,收集上清液,采用双抗体夹心ELISA法定量测定IL-1β、IL-6、TNF-α。用酶标仪在450 nm波长下测定光密度(OD)值,通过标准曲线计算样品浓度。
1.3.2 大鼠损伤部位组织RNA、蛋白的提取以及损伤修复相关基因、蛋白的表达评估
组织匀浆后采用Trizol法提取RNA,用分光光度计检测总RNA浓度和OD值,定量PCR在ABI 7500实时定量PCR仪中检测,以聚合酶SYBR Premix Ex TaqTM试剂盒进行。PCR循环条件如下:94 ℃变性10 s→60 ℃退火20 s→72 ℃复性延伸30 s,40个循环。重复3次,取均值。采用2-ΔΔCT计算方法计算目的基因相对表达量。引物序列:IL-1β,TAGCAGCTTTCGACAGTGAGG(F)、CTCCAC GGGCAAGACATAGG(R);IL-6,CCCACCAGGAACG AAAGTCA(F)、TGCCATTGCACAACTCTTTTC(R);TNF-α,GTAGCCCACGTCGTAGCAAA(F)、AAATGGC AAATCGGCTGACG(R);NF-κB p65,GCACCCCACC ATCAAGATCAAT(F)、TCTGGATGCGCTGGCTAATG(R)。
用RIPA裂解液提取组织蛋白,以BCA法测定蛋白浓度。蛋白通过SDS-PAGE分离,转移到PVDF膜,一抗(抗大鼠IκBα抗体及NF-κB p65抗体)4 ℃孵育过夜,TBST洗涤后,二抗室温震荡1 h,再次洗涤后,在Odyssey双色红外激光成像系统中扫描。
1.4 统计学方法

2 结果
2.1 损伤组织局部IL-1β表达水平
正常SD大鼠肌肉组织中IL-1β含量24 h和48 h检测值分别为(2.13±0.11) pg/mL和(2.08±0.13) pg/mL。造模成功后,模型组SD大鼠肌肉组织中IL-1β含量24 h和48 h检测值分别为(4.42±0.42) pg/mL和(3.91±0.26) pg/mL,显著高于正常组大鼠(P<0.05),且组内比较显示,48 h时IL-1β的含量较24 h有所降低,提示组织损伤的自我修复作用,炎症水平有所控制。扶他林组大鼠肌肉组织中IL-1β含量24 h和48 h检测值分别为(3.26±0.41) pg/mL和(3.1±0.11) pg/mL,显著低于模型组(P<0.05),提示扶他林能显著缓解软组织损伤,减少肌肉等局部炎症因子的释放。疼痛方组大鼠肌肉组织中IL-1β含量24 h和48 h检测值分别为(2.97±0.26) pg/mL和(2.36±0.17) pg/mL,显著低于模型组(P<0.05),提示“疼痛方”能显著缓解软组织损伤,减少肌肉等局部炎症因子的释放;同时也低于扶他林组IL-1β水平,提示“疼痛方”在控制炎症因子释放、对软组织损伤的缓解作用方面一定程度上优于扶他林(图1)。

#:与模型组相比,P<0.05#: Compared with model group, P<0.05图1 组织IL-1β水平的比较Fig.1 Comparison of IL-1β levels in tissue
2.2 损伤组织局部IL-6表达水平
正常SD大鼠肌肉组织中IL-6含量24 h和48 h检测值分别为(3.11±0.46) pg/mL和(3.03±0.58) pg/mL。造模成功后,模型组SD大鼠肌肉组织中IL-6含量24 h和48 h检测值分别为(49.63±4.37) pg/mL和(53.87±4.23) pg/mL,显著高于正常组大鼠(P<0.05),且组内比较显示,48 h时IL-6的含量较24 h有所升高。扶他林组大鼠肌肉组织中IL-6含量24 h和48 h检测值分别为(32.62±4.12) pg/mL和(38.21±4.20) pg/mL,显著低于模型组(P<0.05),提示扶他林能显著缓解软组织损伤,减少肌肉等局部炎症因子的释放。疼痛方组大鼠肌肉组织中IL-6含量24 h和48 h检测值分别为(29.67±3.16) pg/mL和(31.56±4.09) pg/mL,显著低于模型组(P<0.05),提示“疼痛方”能显著缓解软组织损伤,减少肌肉等局部炎症因子的释放;同时也低于扶他林组IL-6水平,提示“疼痛方”在控制炎症因子释放、对软组织损伤的缓解作用方面一定程度上优于扶他林(图2)。
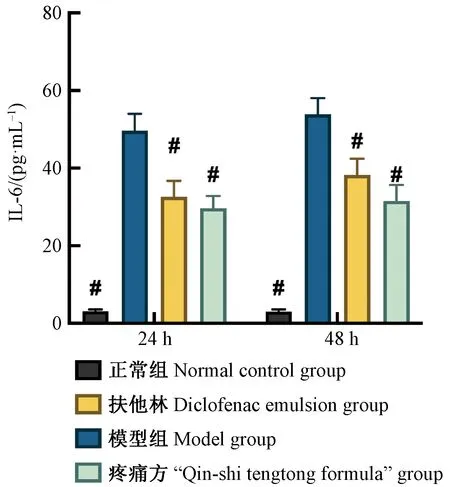
#:与模型组相比,P<0.05#: Compared with model group, P<0.05图2 组织IL-6表达水平的比较Fig.2 Comparison of IL-6 levels in tissue
2.3 损伤组织局部TNF-α表达水平
正常SD大鼠肌肉组织中TNF-α含量24 h和48 h检测值分别为(23.38±1.17) pg/mL和(22.73±1.16) pg/mL,造模成功后,模型组SD大鼠肌肉组织中TNF-α含量24 h和48 h检测值分别为(59.84±5.98) pg/mL和(63.18±5.79) pg/mL,显著高于正常组大鼠(P<0.05),且组内比较显示,48 h时IL-6的含量较24 h有所升高。扶他林组大鼠肌肉组织中TNF-α的含量24 h和48 h检测值分别为(31.57±1.59) pg/mL和(36.41±3.24) pg/mL,显著低于模型组(P<0.05),提示扶他林能显著缓解软组织损伤,减少肌肉等局部炎症因子的释放。疼痛方组大鼠肌肉组织中TNF-α含量24 h和48 h检测值分别为(28.35±1.66) pg/mL和(27.96±1.25) pg/mL,显著低于模型组(P<0.05),提示“疼痛方”能显著缓解软组织损伤,减少肌肉等局部炎症因子的释放;同时也低于扶他林组TNF-α水平,提示疼痛方在控制炎症因子释放,对软组织损伤的缓解作用方面一定程度上优于扶他林(图3)。
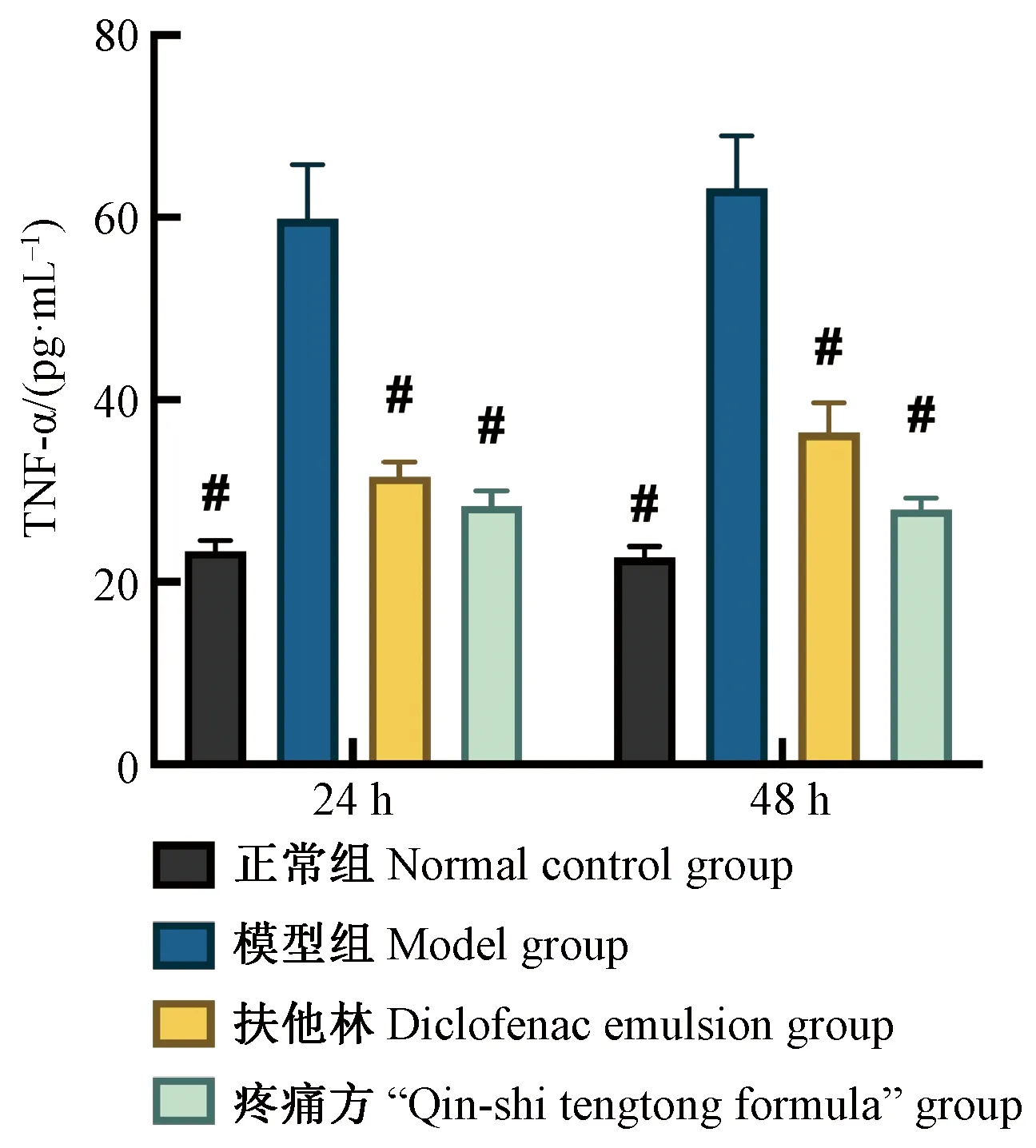
#:与模型组相比,P<0.05#: Compared with model group, P<0.05图3 大鼠组织局部TNF-α水平的比较Fig.3 Comparison of TNF-α levels in tissue
2.4 组织急性损伤期局部特异性基因及蛋白表达水平改变
本研究中,将48 h时的肌肉组织匀浆,提取组织中RNA,利用RT-PCR定量检测软组织中mRNA含量,以反映损伤软组织的各炎症因子的基因表达水平。48 h时模型组SD大鼠肌肉组织中IL-1β、IL-6、TNF-a和NF-κB p65定量检测显示mRNA水平均不同程度高于其他各组,且具有统计学意义(P<0.05)。疼痛方组48 h时大鼠肌肉组织中IL-1β、IL-6、TNF-a和NF-κB p65基因表达量均显著低于模型组(P<0.05);同时除了NF-κB p65之外,也在一定程度上低于扶他林组mRNA水平,提示疼痛方能够在分子基因水平抑制炎症因子的合成释放,降低炎症水平,减少组织损伤,并在一定程度上优于扶他林(图4)。
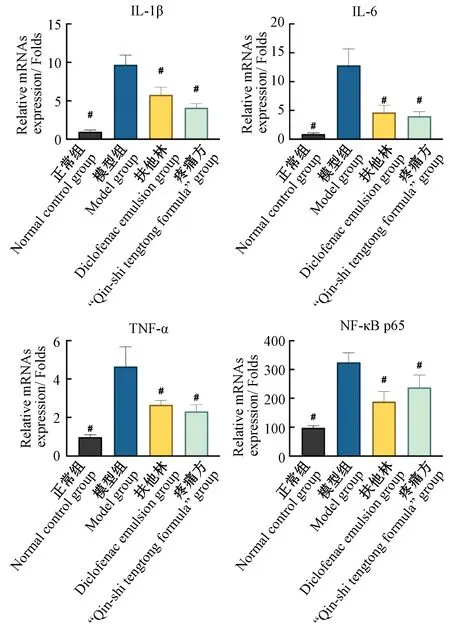
#:与模型组相比,P<0.05#: Compared with model group, P<0.05图4 组织急性损伤期局部特异性基因表达水平改变Fig.4 Changes in local specific gene expression levels during acute tissue injury
NF-κB是参与炎症反应调控的关键性信号通路。其活性主要受上游IκBα磷酸化降解水平影响,被激活后释放下游核蛋白亚基入核,结合特定DNA序列发挥促转录翻译作用,其中以p65最为重要。本研究发现,模型组的IκBα蛋白水平显著降低(P<0.05),提示其磷酸化水平增高,降解增多。而扶他林组和疼痛方组的IκBα水平显著高于模型组(P<0.05),磷酸化进程被显著抑制,提示“疼痛方”具有抑制IκBα磷酸化降解,进而抑制NF-κB活化的作用。此后,进一步观察了NF-κB下游核蛋白p65的表达情况,发现扶他林乳剂和“疼痛方”确实能够减少细胞核内p65的蛋白水平,提示p65释放减少,转录入核水平降低。进一步证实了“疼痛方”与扶他林乳剂均具有抑制NF-κB信号通路的生物学作用(图5)。

#:与模型组相比,P<0.05#: Compared with model group, P<0.05图5 组织急性损伤期局部特异性蛋白表达水平改变Fig.5 Changes in local specific protein expression levels during acute tissue injury
3 讨论
软组织损伤(Soft tissue injury)是临床多发病,是指因急性外伤或慢性劳损或其他原因导致的皮肤、肌肉、肌腱、关节囊及神经等组织的病理损伤,但不包括骨骼病变[2]。急性软组织损伤通常由于外部打击(如撞击、碾压)等引起,出现局部肿胀、淤青、疼痛、功能障碍等症状。其主要病理变化为创伤性无菌性炎症,其主要特征在于局部组织坏死、毛细血管扩张、炎症细胞浸润、局部水肿和出血等。
目前,药物对急性软组织损伤的抗炎作用评估,绝大多数是使用动物急性软组织钝击损伤模型[1,3-4],具有造模成功率高、方法简单、造模时间短等优点[5]。尽管该模型的病因与临床急性软组织损伤的病因不同,但由于其病理学和临床病理学表现相似,因此仍被认为是可靠的急性软组织损伤模型。本研究中,我们使用自制软组织损伤击打器,建立成年雄性SD大鼠急性软组织压榨伤模型,以模拟临床急性软组织损伤的发生,并评估“疼痛方”对这种损伤的疗效。另外,扶他林乳剂通常用于治疗临床上的急性和慢性软组织损伤,因此我们使用扶他林乳剂作为阳性对照药物来评估“疼痛方”治疗急性软组织损伤的疗效。
急性软组织损伤主要病理基础为创伤性无菌性炎症,其中炎症细胞在其发病机制中起重要作用。创伤性损伤早期释放自由基,其随后破坏局部组织中的细胞。炎症细胞释放许多炎症介质,包括IL-1β、IL-6、TNF-α、COX-2、PGE2等,可进一步加剧炎症细胞的黏附聚集以及炎症因子的释放,同时激活新的炎症反应。在复杂的炎性反应中,IL-1β是整个炎症持续进展中一直存在的炎性因子, TNF-α是众多炎性因子中最先释放分泌的促炎前因子,可导致多种生化作用,如刺激集落刺激因子、血小板生长因子等细胞因子的产生和使T细胞产生IL-2等,从而形成瀑布式炎症级联反应[6-9]。IL-6促进嗜中性粒细胞活化和聚集,其水平可反映组织损伤的强度[10-12]。
近年来的研究已经证明,NF-κB在炎症反应中具有关键和核心的调控作用,是调控转录多种炎性因子的中心环节和共同通路[13]。NF-κB的活化可以诱导促炎因子(如TNF-α、IL-6和IL-1β)、趋化因子、黏附分子(如ICAM-1、VCAM-1和ELAM-1)以及一些与炎症级联放大相关的酶(如iNOS和COX-2)的基因表达,控制它们的生物合成,进而趋化大量的中性粒细胞等炎性细胞浸润、聚集到炎症部位,最终导致炎症反应[14-15]。活化的NF-κB是一个同源或者异源二聚体,均由NF-κB/Rel家族成员组成,具有与靶基因增强子的特定序列(5′-GGGACHTCC-3′)结合并促进转录的能力,而通常所说的NF-κB指的即是p65∶p50复合体。NF-κB激活的经典过程为其与抑制因子IκB家族成员结合,当上游信号导致IκB蛋白的磷酸化并降解时,NF-κB就被释放出来并向核内迁移,激活靶基因的转录。已有研究证实,NF-κB信号通路参与了创伤后软组织损伤的炎症反应。炎性因子可激活多种细胞内信号分子,如NF-κB,从而触发相关基因的表达。在急性软组织损伤期间,炎症细胞通过NF-κB途径参与早期炎症的各种促炎细胞因子和蛋白酶的分泌。在本项研究中,急性软组织损伤模型组的NF-κB p65基因水平升高。而扶他林和“疼痛方”的治疗均可降低NF-κB p65的基因表达水平,据此我们推测“疼痛方”可抑制组织的NF-κB信号通路,进一步的Western blot检测结果同样表明,“疼痛方”的作用可能与NF-κB信号通路的抑制有关。

