前臂同种异体移植大鼠模型的建立
朱海男 顾斌 谢峰
带血管复合组织同种异体移植(Vascularized composite tissue allotransplantation,VCA)是一个新的有前景的移植医学领域,可以用来治疗严重的、无法用传统重建方法修复的软组织损伤。目前,这项技术已经在世界范围内的很多国家开展,许多不同种类的组织或器官被成功移植,比如手移植、前臂移植、面部移植、腹壁移植、气管移植等[1-4],其中上肢移植是开展最多的VCA移植类型。
然而,不同于实质性器官的移植,包括上肢移植在内的VCA仍然被认为处于实验阶段,目前仅个别患者接受了此类手术。原因是大部分的VCA是用于改善生活质量,而非拯救生命;另外,患者术后必须应用具有各种副作用的免疫抑制剂。这类手术对患者的风险和收益应在术前进行谨慎且全面的评估。目前,还需要大量的实验研究来减少VCA手术面临的风险,为VCA真正应用于临床奠定基础。
大鼠个体较小,容易操控,价格较低,遗传背景相对固定,被广泛地应用于VCA实验[5-9]。但目前还没有大鼠的肢体移植模型,为此我们尝试建立该移植模型,以期为今后开展同种异体前臂移植的相关研究提供基础。
1 材料与方法
1.1 实验动物和实验设计
近交系雄性Brown Norway(BN)大鼠(基因表达:RT1n),体质量250~275 g,用作供体(n=8);近交系雄性Lewis大鼠(基因表达:RT1l),体质量250~275 g,用作受体(n=8)。供受体大鼠均购自上海斯莱克实验动物有限公司。供者大鼠在移植物被取下后使用过度异氟烷吸入的方法处死,随后使用脱颈椎的方法确认死亡。受者大鼠在术前、术后即刻和术后4 d给予止痛药美洛昔康(2 mg/kg)。本研究共进行了8例前肢的同种异体移植。受者鼠与供者鼠之间跨越了完全的主要组织相容性复合体(Major histocompatibility complex,MHC)屏障。其中,3例受者鼠在术后未接受免疫抑制治疗,设为对照组;5例受者鼠在术后给予剂量递减的免疫抑制剂CsA(Novartis Pharma Schweiz AG,Switzerland)直到实验结束,以防止免疫排斥反应,设为实验组。CsA给予剂量:第一周16 mg/kg·d,第二周8 mg/kg·d,第三周4 mg/kg·d,第四周及以后2 mg/kg·d。本研究获上海交通大学医学院附属第九人民医院伦理委员会批准。
1.2 建立动物模型方法(图1)
1.2.1 供者鼠手术
受者鼠的切口线包括围绕肘关节的环形切口,上臂正面、前臂正背面的3条正中线切口。在上臂近端1/3处确认和离断3条前臂的主要神经,即尺神经、桡神经和正中神经。随后,在上臂前面向下追踪正中神经和尺神经直到肘关节水平。在肘关节水平,从尺神经沟内游离并前置尺神经。桡神经同样被追踪,深入到二头肌和肱骨后向外侧走行直到肱骨的三角突,在这里桡神经被游离并前置。游离腋动静脉和肱动静脉从肘关节水平直到进入胸壁段。随后在起始处离断伸肌和屈肌肌群。所有的肌肉连同血管蒂和神经从尺桡骨骨膜下层被掀起直到二头肌止点水平。术中应特别注意确认和保护骨间血管,需要小心地从骨面剥离骨间血管。随后,使用直径0.35 mm的钻头在尺骨上钻2个小孔,钻孔位置大约在骨离断位置远端1~2 mm,随后在骨间膜近端离断尺桡骨。在显微镜下打磨平整离断平面。最后,取下的移植物被包在盐水纱布中,放入50 mL离心管,保存于4 ℃冰箱,等待移植。
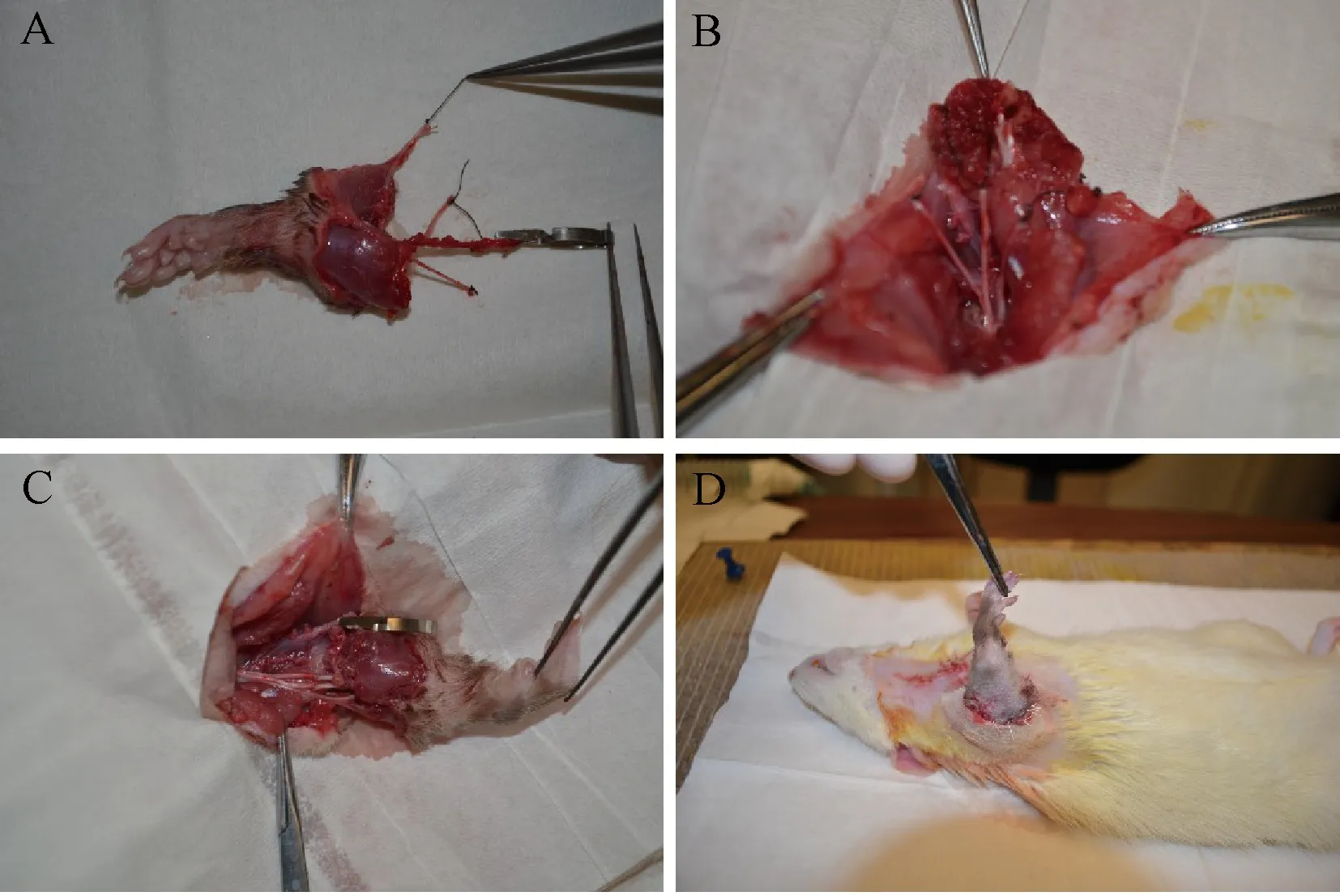
A:取下的移植物;B:受区准备;C:骨固定、神经吻合和肌肉群修复后;D:切口关闭。A: Harvested graft; B: Preparation of the recipient; C: After bone fixation, nerve anastomosis and muscular reconstruction; D: Closure of the wound.图1 大鼠前肢同种异体移植模型的建立Fig.1 Establishment of a rat model of forelimb allotransplantation
1.2.2 受者鼠准备
切口线包括前正中切口和前臂近端1/3处的环形切口。确认尺神经、正中神经和桡神经并向下追踪到肘关节水平后离断。另外,桡神经由后方前置到前方。屈肌和伸肌肌群在前臂近端1/3处离断,并在骨膜下平面从尺桡骨表面剥离下来直到二头肌止点位置。受者的二头肌和三头肌止点被完整保留,以维持肘关节的活动功能。在尺骨上打2个直径0.35 mm的小孔,位置为骨离断平面近端1~2 mm,随后在骨间膜近端位置离断尺桡骨。
在颈部另行一2 cm长切口。暴露颈外静脉并将其作为受体静脉。在胸锁乳突肌内侧找到颈内动脉并将其作为受体动脉。接着,在尽可能远的位置同时结扎、离断动静脉,目的是保留尽可能长的受者血管蒂,方便吻合。颈内动脉通过颈部肌肉的隧道穿到上臂前面位置,目的也是延长血管蒂,方便吻合。
移植前,供者的前臂和切下的受者前臂并列放在一起,以调节两者长度,确保移植后肢体的长度合适。
1.2.3 移植物的植入
对受者鼠和供者鼠的桡骨骨髓腔使用27号针头进行扩髓,随后使用适当长度的27号针作为髓内针,将两侧桡骨连接起来。通过之前钻的0.35 mm直径小孔,用0.2 mm的铁丝连接受者和供者尺骨。7-0单根丝线缝合受者伸肌和屈肌肌群的相对应部分。随后3根神经以端端吻合的方法依次进行吻合。使用11-0显微缝合线进行血管的端端吻合,最后使用4-0可吸收线缝合切口。
1.3 大体评估和移植物的组织学评估
术后观察移植前臂的存活情况、免疫排斥反应情况、感觉运动恢复情况。术后90 d时进行移植物组织学观察。
术后每天对移植前臂的血供、免疫排斥反应情况(包括颜色的变化、水肿情况、有无变硬等)进行观察。术后每周记录移植前臂的运动和感觉恢复情况。前肢的运动恢复包括步态和在日常生活中是否使用移植的前肢。移植前臂的感觉恢复通过指压实验确定。术后90 d,存活移植物取材,切片,HE染色,镜下观察,评估移植物组织学改变。
2 结果
2.1 手术一般情况
供者鼠的平均手术时间为2 h,受者鼠的平均手术时间为4 h,热缺血时间为30 min。所有受者鼠都能较好地耐受手术。
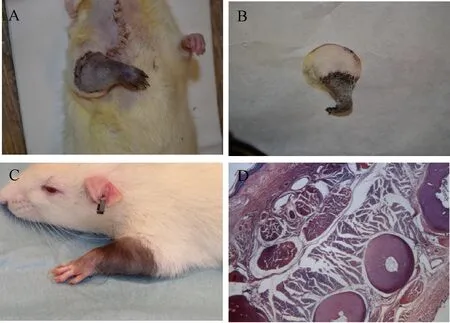
A:术后12 d对照组移植物;B:术后20 d对照组移植物;C:术后1个月实验组移植物;D:术后3个月实验组移植物组织学评估。A: Graft in control group on POD 12; B: Graft in control group on POD 20; C: Graft in experimental group on POD 30; D: Histological observatin of the graft in experimental group on POD 90.图2 术后移植物观察Fig.2 Postoperative graft observation
2.2 大体观察(图2)
实验组术后7 d内术区水肿明显,其中小部分皮肤发生表皮溶解坏死。但在脱痂后直到实验结束为止,所有移植物的皮肤保持颜色粉红、质地柔软,提示所有移植物的血供良好。所有移植前臂的指甲和毛发在术后20~25 d内重新开始生长。术后,受者鼠没有发生自噬移植物的现象。实验过程中前臂的连续性保持良好,没有发生前肢的关节僵硬。其中,肩关节和肘关节活动在术后10 d恢复正常,并在之后保持了正常的关节活动度。腕关节和指关节在术后2~3个月开始出现肌肉震颤,到实验结束时,仍没有恢复正常的大幅度关节运动。但是,受者鼠在术后1~2个月,开始在日常活动中使用移植的前臂,例如捧食物、挠脸等。感觉的恢复,即触觉或保护性收回运动在术后4~6周出现。实验组有1只大鼠在术后75 d出现排斥反应,表现为皮肤变红,表皮剥脱伴散在细小出血点。但通过重新加大CsA剂量到8 mg/kg·d,并逐渐递减到2 mg/kg·d,排斥反应很快得到控制。
对照组,即受者鼠未接受免疫抑制治疗组,移植物在术后早期获得存活,术后12 d开始出现持续加重的红肿,后逐渐出现皮肤溶解、坏死,肢体变黑,最终萎缩并木乃伊化。
2.3 组织学评估(图2)
组织学检测显示,实验组移植物内骨组织结构正常,骨细胞活力好,没有缺血坏死,吸收等情况;骨髓结构正常,可见大量正常骨髓细胞;移植物内肌肉组织、皮肤组织、皮肤附属器、皮肤下筋膜组织、肌腱等结构无明显异常。表明移植物血供可靠,且没有发生明显排斥反应。
3 讨论
自Dubernard等于1998年在法国里昂第一次成功完成了手移植,至今全世界范围内已经进行了超过100例手或前臂的移植手术。但是,由于术后需要长期使用免疫抑制剂治疗,使得这一能显著提高患者生活质量的新技术至今无法在临床得到全面开展[10]。
各种VCA相关研究中,实验动物模型具有非常重要的作用,例如移植后的排斥现象、缺血再灌注损伤、开发更低毒性的免疫抑制剂、更好的组织保存方法等。目前还没有前臂移植的大鼠模型。虽然在已发表的VCA模型中,有一些模型提供了与前臂相同或者相似的组织构成,例如后肢移植模型、髂骨肌皮瓣模型、带神经的面部移植模型[11-12]。尤其是1978年建立的后肢移植模型,是最早发表的VCA模型,之后又陆续发表了许多该模型的改进模型。这一模型对VCA的相关研究,包括不同的免疫抑制的方案、嵌合问题、移植物抗宿主反应、免疫耐受诱导等都具有重要意义[13-17]。然而,大鼠的前肢和后肢存在诸多不同。在功能上,后肢主要负责承重和跑动,包括了更多的大块肌肉组织,而前肢更多负责精细运动。另外,后肢包括更粗大强壮的骨结构,尤其是股骨,是最为常用的带血供的骨髓移植模型。也就是说,后肢移植与前肢移植相比,往往带入大量的骨髓组织。而骨髓在移植后的移植物排斥、免疫耐受等现象中都起到较大的作用[18-20]。前肢和后肢同样存在不同的神经支配和血供系统,并且前肢和后肢中各种组织成分的比例不同。所有的不同均可能导致实验结果的不同。
基于Greens[21]《大鼠的解剖》一书和针对大鼠前肢和后肢的解剖学研究,大鼠的前肢和人的上肢具有高度相似性,包括极其相似的骨骼肌肉系统、神经系统和血液循环系统。因此,我们认为使用大鼠前肢移植模型应该能更好地研究上肢移植的相关基础问题。
建立大鼠的前臂移植模型主要有两个关键点:骨的固定和血管蒂的设计。在骨的固定中,有两个因素需要考虑,即固定的平面和固定的方法。出于对肘关节功能完整性的考虑,本研究中我们保留了上臂的所有肌肉,所以前臂的截骨平面设计在肱二头肌的止点远端,在移植物切取过程中要特别小心,不要损伤骨间血管,因为这一血管对尺桡骨的营养非常重要,并且非常靠近肱二头肌止点的位置。我们需要小心地将骨间血管从尺桡骨上剥离下来,直到骨间膜的位置,随后在骨间膜平面进行截骨。动物实验中使用过的骨的固定方法包括克氏针[16,22]、由注射针改成的髓内针[18,23]和细钢丝[24]。本研究动物模型中使用的固定方法是髓内针和钢丝固定的组合,其中髓内针可以防止截骨部位的成角畸形,钢丝固定可以防止截骨部位的分离畸形,两者可共同防止旋转畸形。由于大鼠的尺桡骨非常小,在显微镜下进行骨面的平整对于接合后的牢固度非常重要。
肱血管的管径非常细小(约0.4~0.5 mm),直到与自肩胛下的血管汇合后到达胸壁表面时,才明显变粗(约1 mm)。我们发现这一动脉与颈内动脉的口径相似,虽然同一平面的腋静脉会比供区的颈外静脉粗一些、薄一些,但是由于供者鼠与受者鼠的血管管径都较粗,静脉的吻合通常不是问题。合适的血管蒂的张力主要通过控制移植物长度来获得,要尽量切取较长的受者和供者的血管蒂。因为颈内动脉位置较深,我们通常在颈部和肩缝位置打通肌肉下隧道后穿过颈内动脉到前臂位置进行吻合,而不是将颈内动脉跨过这些肌肉后进行吻合。有时候,我们会临时将移植的前臂固定到胸壁,保持前臂的内收位置,以免术后外展造成对血管的过度牵拉。
递减剂量的CsA治疗是在VCA实验中被广泛应用的免疫抑制剂方案,本研究进一步确定了这一方案的可行性。骨的愈合大约在术后3个月时可以完成,与其他大鼠骨折愈合相关实验的愈合时间吻合[25-27]。我们没有发现移植肢体的骨形态与对侧正常侧有明显不同,也与移植前的状态一致,表明没有骨组织的吸收,没有关节的脱位、骨折等。由于术后观察时间较短,加之没有康复训练计划,术后3个月时移植侧肢体没有恢复正常的活动功能,但是感觉功能的恢复比较全面,速度也与以往报道的大鼠自体神经损伤后的再生长速度一致[28]。
本研究与以往报道的大鼠后肢模型相比,需要更长的手术时间,骨固定和血管吻合对显微外科技术的要求较高;移植物中用于组织学或其他实验分析的组织量较后肢模型少。
4 结论
同种异体前臂移植的大鼠模型是可行的,可较好地模拟临床前臂移植模型,为相关研究奠定了基础。

