中药发酵制剂对家禽痛风的防治研究
林雪玉,林松泉
(1.上海交通大学医学院,上海200025;2.厦门惠盈动物科技有限公司,福建厦门361023)
痛风是由尿酸盐沉积直接导致的疾病。当家禽过多的饲喂动物内脏、鱼粉、豆粕等高蛋白饲料,家禽会出现蛋白质代谢功能障碍。养殖密度大、环境潮湿阴冷、家禽缺乏运动等原因均会导致家禽痛风病的发生[1-2]。痛风症状一般表现为精神萎靡、厌食、羽毛杂乱,颈椎、翅膀、腿等关节处肿胀,行动迟缓或行走障碍[3]。家禽痛风病的发病死亡率较高,尤其是群体发病,给养殖户造成极大的经济损失。
研究表明,长期使用化学类药物治疗家禽痛风,会降低家禽的免疫能力,对机体有较大程度的损坏,且多存在毒副作用、药物残留等问题[1-4]。中药作为天然药物,其成分多样、药性温和、毒副作用少[5],是绿色、安全养殖用药的优选之一。
中药发酵是炮制中药的一种重要方法[6],是利用益生菌生长代谢过程中产生的酶类与有机酸等对中药进行炮制。利用益生菌发酵中药能够有效保护中药活性成分免遭破坏,提高中药有效成分的提取率及药渣的利用率,降低中药的毒副作用[7-9]。在传统的中药制剂中引入益生菌发酵,益生菌进入机体可参与机体功能代谢,起到益生的作用。研究表明,乳酸菌可以有效分解食物中的嘌呤,减少尿素形成。所以,益生菌在辅助治疗或预防痛风上能够起到一定的作用[10-11]。研究表明,车前草具有抑制嘌呤转化为尿酸的功能,从根本上降低尿酸含量[12]。本研究在前人针对中药治疗痛风的研究基础上[13-16],利用赤苍藤、甘草、姜黄、薏仁4味中药,采用益生菌发酵再经过喷雾干燥,从而制备可以用于防治家禽痛风的中药发酵制剂,为治疗家禽的痛风提供参考。
1 材料与方法
1.1 培养基
中药发酵(筛选)培养基:赤苍藤20 g/L、姜黄10 g/L、甘草10 g/L、薏仁10 g/L、葡萄糖30 g/L、牛肉膏8 g/L、琼脂20 g/L,中药经过超微粉碎处理。
降解尿酸菌株筛选培养基[17]:硫酸镁0.5 g/L、氯化钠0.1 g/L、磷酸氢二钾0.5 g/L、磷酸二氢钾0.5 g/L、尿酸2 g/L、琼脂20 g/L。
1.2 试验菌株
植物乳杆菌GDM1.191(Lactobacillus plantarum)、干酪乳杆菌GDM1.80(Lactobacillus casei)、嗜 杆 菌GDM1.208(Lactobacillus acidophilus)、嗜热链球 菌GDM1.1808(Streptococcus thermophilus)、屎肠球 菌GDM1.388(Enterococcus faecium)、德氏乳杆 菌GDM1.1801(Lactobacillus delbrueckii)、产朊假丝酵 母GDM2.148(Candida utilis)、酿酒酵 母GDM2.90(Saccharomyces cerevisiae)、凝结芽孢杆菌GDM1.645(Bacillus coagulans),均购自广东省微生物菌种保藏中心;鼠李糖乳杆菌(Lactobacillus rhamnosus)、戊糖片球菌(Pediococcus pentosaceus)、纳豆芽孢杆菌(Bacillus natto)为本实验室分离纯化。
1.3 试验药物
肌苷(生产批号:20210112)、鸟苷(生产批号:20210325)购自国药集团化学试剂有限公司;尿酸(生产批号:20210120)购自上海沃凯化学试剂有限公司;高嘌呤鼠粮(100 g含嘌呤800 mg,生产批号:20210414)购自江苏美迪森生物医药有限公司。
1.4 试验动物
28日龄BALB/c小鼠购自武汉巴菲尔生物技术服务有限公司;30日龄雏鹅、45日龄肉鸡由红星养殖场提供。
1.5 试验方法
1.5.1 中药发酵菌株筛选
1.5.1.1 中药耐受性菌株筛选
采用以中药发酵(筛选)培养基为中药耐受性筛选固体培养基,115℃灭菌30 min,倒平板,冷却待用。分别接入供试验用菌株,36℃厌氧培养48 h,观察有无菌落长出。
1.5.1.2 降解利用尿酸菌株筛选
以尿酸为唯一氮源、碳源,采用降解尿酸菌株筛选培养基为尿酸固体培养基,115℃灭菌30 min,倒平板,冷却待用。分别接入供试验用菌株,36℃厌氧培养48 h,观察有无菌落长出。
1.5.1.3 降解嘌呤菌株筛选[11]
嘌呤核苷以肌苷和鸟苷为试验检测对象,配置0.1 mol/L中性磷酸缓冲液,分别各加入肌苷和鸟苷使最终浓度为15 mmol/L。将供试验用菌株液体培养活化,离心收集菌体,再将菌体用无菌生理盐水稀释至活菌数约108CFU/mL的菌悬液备用,取4 mL菌悬液与2 mL中性磷酸缓冲液36℃厌氧培养1 h,沸水浴保温5 min,离心取上清;经0.22µm的无菌过滤器过滤,用于HPLC分析计算接种试验菌株前后嘌呤核苷的变化量;采用4 mL生理盐水与2 mL中性磷酸缓冲液36℃厌氧培养1 h作为空白对照组。以试验组数据扣除空白对照组的影响,从而确定试验菌株是否能降解嘌呤核苷。
1.5.2 中药发酵制备
以中药发酵(筛选)培养基所需原料按100 L量称取,加入150 L发酵罐中,加水100 L,开启电机,80 r/min搅拌,以115℃灭菌蒸煮30 min,冷却,按5%接入筛选获得的复合益生菌菌种,36℃厌氧培养48 h,获得中药发酵液。所获得的中药发酵液直接进行喷雾干燥,设置进风温度为100℃,出风温度65℃,收集获得喷雾干燥粉末,即为中药发酵粉末制剂,后续检测活菌数及水分。其中,复合益生菌菌种比例为:鼠李糖乳杆菌2%、植物乳杆菌1%、嗜酸乳杆菌1%、酿酒酵母菌1%。
中药对照组为中药发酵(筛选)培养基以115℃灭菌蒸煮30 min,冷却,直接进行喷雾干燥,收集获得喷雾干粉粉末,即为中药粉末。益生菌对照组为不加中药成分,以葡萄糖30 g/L、牛肉膏8 g/L发酵复合益生菌,36℃厌氧培养48 h,进行喷雾干燥,收集获得喷雾干粉粉末,即为益生菌粉末。
1.5.3 小鼠痛风模拟试验
选取100只小鼠,先适应喂养1 w,随机分为5组,每组20只,雌、雄各半。饲养期间,各组小鼠饮水自由。试验前4 d,5组小鼠均饲喂正常鼠粮,空白组为不做任何处理(正常小鼠模型);对照模型组为4 d后饲喂高嘌呤鼠粮(高尿酸血症模型);试验1组为试验前4 d给药灌服中药发酵粉末制剂,4 d后饲喂高嘌呤鼠粮3 d;试验2组为试验前4 d给药灌服纯中药粉末制剂,4 d后饲喂高嘌呤鼠粮3 d;试验3组为试验前4 d给药灌服纯益生菌粉末制剂,4 d后饲喂高嘌呤鼠粮3 d。收集所有组小鼠的尾静脉血液,3 000 r/min离心15 min分离血浆,取血浆测定血尿酸含量[18]。
1.5.4 雏鹅预防痛风试验
在福建漳州诏安桥头鹅养殖场,随机选取30日龄健康的雏鹅,共计400只,随机分为4组,每组100只。空白组不给药灌服;试验1组给药灌服中药发酵粉末制剂;试验2组给药灌服纯中药粉末制剂;试验3组给药灌服纯益生菌粉末制剂。试验组按雏鹅体重1 g/kg给药灌服,每2 d供药1次,试验期20 d。
试验期间,鹅自由饮水,所喂饲料及管理一致。试验20 d结束后统计雏鹅痛风发病只数及发病只数中死亡的只数,计算发病率、死亡率。

雏鹅痛风诊断标准[19]:行动迟缓、有障碍,腿、翅肿胀,厌食、精神萎靡、腹泻等。
1.5.5 肉鸡痛风治疗试验
在福建漳州红星肉鸡养殖场,随机挑选45日龄,患有痛风病的肉鸡共计200只,随机分为4组,每组50只。空白组不给药灌服;试验1组给药灌服中药发酵粉末制剂;试验2组给药灌服纯中药粉末制剂;试验3组给药灌服纯益生菌粉末制剂。试验组按肉鸡体重1 g/kg给药灌服,每2 d供药1次,试验期10 d。
试验期间,肉鸡自由饮水,所喂饲料及管理一致。试验10 d结束后统计每组肉鸡痛风病治愈数量及死亡数量,计算治愈率、死亡率。
肉鸡痛风诊断标准[20]:食欲下降、鸡冠泛白、粪便多为白色稀水状态,腿、翅关节肿胀和疼痛,行动迟缓、不愿站立或久站。
肉鸡痛风治愈标准:肉鸡精神状态恢复正常,行动敏捷、步态有力,勤于觅食,腿、翅关节的肿胀消失。
1.6 数据统计与分析
试验数据采用Excel 2020进行整理,采用SPSS 22.0软件中Duncan's法对数据进行多重比较分析,结果以“平均值±标准差”表示,P<0.05表示差异显著,P<0.01表示差异极显著。
2 结果与分析
2.1 中药发酵菌株筛选(见表1)
由表1可知,试验选用的12株益生菌中多数能够降解嘌呤核苷,但同时具备在高浓度中药成分中正常生长、降解尿酸与嘌呤核苷的菌株有植物乳杆菌、嗜酸乳杆菌、鼠李糖乳杆菌、酿酒酵母,且以鼠李糖乳杆菌与植物乳杆菌的降解能力最佳。因此,选取这4株益生菌为中药发酵试验菌种。

表1 中药发酵菌株筛选结果Tab.1 Screening results of Chinese medicine fermentation strains
2.2 中药发酵制备结果
试验组经复合益生菌发酵,喷雾干燥设备进风温度为100℃,出风温度65℃,收集的粉末水分为8.80%,乳酸菌总活菌数3.84×109CFU/g,酿酒酵母活菌数1.80×107CFU/g,粒度为90目通过率100%。中药对照组所获得的为纯中药制剂,无益生菌成分,粒度为90目通过率100%。益生菌对照组,无中药成分,乳酸菌总活菌数为4.18×109CFU/g,酿酒酵母活菌数1.2×107CFU/g,粒度为90目通过率100%。
2.3 小鼠痛风模拟试验结果(见表2)
由表2可知,经过3 d饲喂高嘌呤鼠粮,血尿酸值上升至367.84µmol/L。与对照模型组相比,试验1组血尿酸降解74.07%,试验2组血尿酸降解61.56%,试验3组血尿酸降解50.34%,血尿酸含量显著或极显著降低(P<0.05,P<0.01)。结果表明,本研究制备的药物能有效降低小鼠血尿酸含量。试验1组与试验2组、试验3组的血尿酸值分别相差46.03、87.27µmol/L,说明单一的中药或益生菌制剂降低血尿酸的效果较差于中药与益生菌的复合制剂。

表2 小鼠血尿酸检测结果Tab.2 Results of serum uric acid in mice 单位:µmol/L
2.4 雏鹅预防痛风试验结果(见表3)
由表3可知,试验1组的鹅痛风病的发病率和死亡率极显著低于空白组(P<0.01);试验2组鹅痛风病发病率显著低于空白组(P<0.05),死亡率极显著低于空白组(P<0.01);试验3组鹅痛风病死亡率显著低于空白组(P<0.05)。试验1组的发病率与死亡率皆低于试验2组、试验3组,说明单一的中药或益生菌成分防治雏鹅痛风的功效较中药与益生菌复合制剂差。
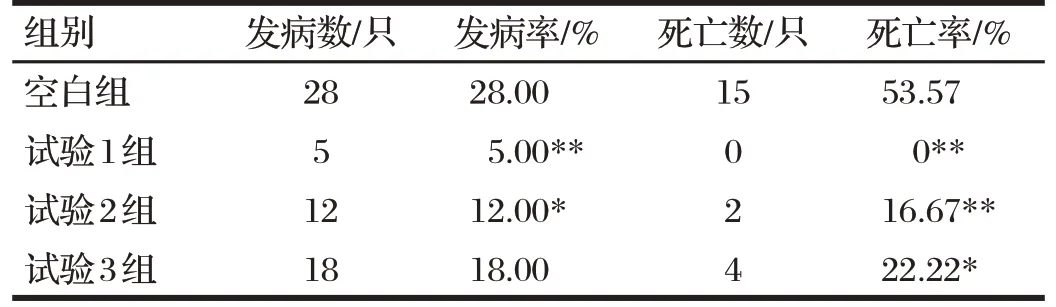
表3 雏鹅预防痛风试验结果Tab.3 Results of gosling gout prevention test
2.5 肉鸡痛风治疗试验结果(见表4)
由表4可知,随机挑选的痛风病肉鸡200只,不进行药物干预的空白组死亡率达42.00%,而进行药物干预的试验组死亡率分别为0、8.00%与16.00%,与对照组相比,达显著或极显著水平(P<0.05,P<0.01)。试验1组的治愈率高于试验2组和试验3组的治愈率,说明单一的中药或益生菌成分治疗肉鸡痛风的功效较中药与益生菌复合的制剂差。

表4 肉鸡痛风治疗试验结果Tab.4 Results of gout treatment in broilers
3 讨论
3.1 中药发酵菌株的筛选
目前,用于中药发酵领域的菌株主要包括:乳酸杆菌、芽孢杆菌、酵母菌等[21]。研究表明,无论采用单一菌株或者复合菌株发酵中药,效果皆明显优于未发酵[22-27]。本研究通过对实验室12株益生菌进行相关试验测试,结果发现,8株乳酸菌具有降低嘌呤核苷的能力,不同乳酸菌菌株,其降解能力不同,与麻菊美等[28]、Yamada等[10]、王垚[11]的研究结果一致。结合12株益生菌对配方中中药浓度的耐受能力及降解尿酸能力,筛选出植物乳杆菌、嗜酸乳杆菌、鼠李糖乳杆菌与酿酒酵母为发酵菌株,进行中药发酵相关试验。
3.2 中药发酵制剂对家禽痛风的防治作用
家禽痛风病多发于鸡、鹅,其病程缓慢,但发病率高。目前,家禽痛风病主要以苯基喹啉羟酸、嘌呤醇、秋水仙碱等化学类药物治疗为主[1-4],但存在毒副作用、药物残留等问题。刘玉花[29]采用中药煎煮或者拌料方式进行防治,其缺点是中药药效释放较慢。本研究采用中药先经超微粉碎后进行微生物发酵,再经喷雾干燥,中药有效成分释放快速,益生菌菌株发酵代谢产物及药材成分皆保留在该中药发酵粉末制剂中,避免造成浪费。
在以小鼠做降解血尿酸的模拟试验中,小鼠血尿酸值经过3 d饲喂高嘌呤鼠粮后,由78µmol/L上升至368µmol/L,血尿酸模型构成。试验组在饲喂高嘌呤鼠粮的同时,连续灌服用药,明显血尿酸含量有所下降,分别为95.38、141.41、182.65µmol/L,与金方等[30]利用干酪乳杆菌ZM15、杨殿斌[31]利用植物乳杆菌对高尿酸血症大鼠模型的研究一致。
雏鹅、肉鸡发生痛风,如果不进行药物干预,其死亡率较高。在雏鹅预防痛风与肉鸡治疗痛风试验中,结果表明,使用本研究的中药发酵制剂能够有效预防与治疗痛风病,且中药发酵制剂的效果优于单纯的中药或益生菌制剂,说明益生菌在辅助治疗或预防家禽痛风病的发生起到一定的作用。在后续的研究中,将根据中药发酵制剂对家禽痛风的防治效果寻找出最佳使用剂量及在其他家畜中的应用。
4 结论
研究表明,该中药发酵制剂能够有效预防家禽的痛风病。益生菌与中药相结合治疗家禽痛风方式在预防或辅助治疗家禽痛风病具有良好的应用前景,同时也为后续的相关产品研发奠定基础。
——痛风

