乳源金黄色葡萄球菌生物被膜形成能力及多位点序列分型分析
王晗晟,阮红日,付琳清,刘 梦,靳育琦,葛延松,宋 军
(黑龙江八一农垦大学动物科技学院,黑龙江大庆163316)
奶牛乳房炎(bovine mastitis)是奶牛最常见的疾病之一,会引起弃奶、奶制品质量下降及患病牛淘汰等[1-2]。引起奶牛乳房炎的病因复杂,其中金黄色葡萄球菌是引起接触传染型奶牛乳房炎的主要病因之一。金黄色葡萄球菌引起的奶牛乳房炎具有传染性强、治愈率低、复发率高的特点。同时,抗生素的滥用导致金黄色葡萄球菌的耐药性愈来愈强,严重阻碍我国奶牛养殖业的健康发展[3]。
细菌生物被膜是细菌及其自生分泌的胞外聚合物组成的细菌聚集膜样物。形成生物被膜的细菌具有较高的代谢能力,隐蔽在生物被膜的细菌难以被抗生素清除,生物被膜对抗生素的抗性问题日趋严重[4-6]。生物被膜的形成受多种因子的调控。Ica操作子(icaADBC)编码的细胞间多糖黏附素在生物被膜的形成过程中起决定性的作用[7]。Ica操作子主要由IcaA、IcaB、IcaC和IcaD组成,能够诱导葡糖胺转移酶的合成,从而促进生物被膜的黏附过程。Ica的表达又受到IcaR、σ因子sigB的调控。此外,Eno、Atl、aap、Bap等基因对于生物被膜形成过程中的初始黏附有着重要的影响[8-9]。近年来,金黄色葡萄球菌的耐药菌株不断出现,尤其是耐甲氧西林金黄色葡萄球菌(methicillin-resistantStaphylococcus aureus,MRSA)[10]。MRSA是一种具有多重耐药性、流行性强、病死率高的病原菌。目前,分子分型已被证明是研究MRSA流行病学的重要工具。现已开发出多种技术来分型MRSA分离株,包括脉冲场凝胶电泳(PFGE)、金黄色葡萄球菌染色体mec盒(SCCmec)、A蛋白(spa)分型和多位点序列分型(MLST),均具有较高的鉴别能力[11]。本试验通过分析乳源金黄色葡萄球菌的生物被膜形成能力、被膜相关基因和MLST,为控制乳源金黄色葡萄球菌感染提供参考。
1 材料与方法
1.1 试验材料
1.1.1 试验菌株
55株临床分离的金黄色葡萄球菌由黑龙江八一农垦大学牛病防制重点实验室提供。菌株经鉴定后,由本实验室保存。S.aureusATCC 43300购自美国典型微生物菌种保藏中心(ATCC),实验室保存。
1.1.2 试剂及材料
试剂:蛋白胨、酵母提取物、氯化钠、胰蛋白胨大豆培养基、琼脂粉、结晶紫、PBS缓冲液、2×Taq DNA聚合酶、DNA Marker DL-2000、琼脂糖、50×TAE缓冲液。
仪器:超净工作台(北京东联哈尔仪器制造有限公司)、电热恒温振荡器(上海森信实验仪器有限公司)、台式室温离心机(德国Eppendorf公司)、分光光度计(北京普析通用仪器有限责任公司)、高压蒸汽灭菌锅(松下健康医疗器械(上海)有限公司)、PCR扩增仪(美国BIO-RAD)、电泳仪(美国BIO-RAD)、凝胶成像系统(美国BIO-RAD)、电子天平(上海菁海仪器有限公司)。
1.2 试验方法
1.2.1 菌株复苏
将-80℃冰箱中保存的金黄色葡萄球菌接种至LB固体培养基,于37℃过夜培养。次日,挑取LB固体培养基上一个形态较好的菌落,接种于1 mL液体LB培养基中,37℃、180 r/min振荡培养8~10 h,4℃储存备用。
1.2.2 结晶紫半定量法测定乳源金黄色葡萄球菌生物被膜形成能力
将1.2.1中复苏的55个临床分离株再次转接到2 mL TSB培养基中,37℃振荡培养6~8 h至对数生长期,并调整菌液浓度至OD600nm为0.5(细菌浓度约为109CFU/mL)。取96孔细胞培养板,每孔加入180μL液体TSB培养基和20μL对数生长期的菌液,每个菌株重复3孔。每一培养板中同时设标准菌株组和空白对照组(只含培养液)各3孔。将加过样品的96孔板于37℃静置培养48 h。弃去培养基,每孔用200μL无菌PBS洗3次。每孔加入95%的甲醇溶液200μL,固定30 min。弃去固定液,每孔用PBS冲洗3次,自然风干。每孔加入250μL 1%的结晶紫染色液,室温静置30 min。弃去染色液,用流水冲洗每孔3~5次,彻底洗去未结合的染色液,放入烘箱烘干。每孔加入33%的乙酸溶液250μL,摇床上振荡15 min,充分释放生物被膜中结合的染色液,最后用酶标仪测定600 nm波长的OD值。
判断方法:以空白对照孔所测得OD600nm的两倍作为临界点ODc。当ODc>OD时,判断细菌无生物被膜形成能力(-);当ODc≤OD≤2×ODc时,判定细菌生物被膜形成能力较弱(+);当OD>2×ODc时,判定细菌形成生物被膜的能力较强(++)。
1.2.3 乳源金黄色葡萄球菌生物被膜形成相关基因的分布情况
将1.2.1中复苏的55株金黄色葡萄球菌和标准菌株转接到2 mL LB液体培养基中,37℃振荡8~10 h。按照细菌DNA提取试剂盒说明书步骤提取细菌DNA。以ATCC 43300作为标准菌株,根据GenBank上的DNA序列设计IcaA、IcaD、IcaR、Eno和Bap等生物被膜形成相关基因,由北京擎科生物科技有限公司合成,引物信息见表1。使用提取好的细菌DNA作为模板,根据近岸蛋白质科技有限公司2×Taq DNA聚合酶说明书设计PCR反应体系和反应程序,反应体系(总体积20μL):2×Taq DNA聚合酶10μL,正向引物1μL,反向引物1μL,DNA模板1μL,ddH2O 7μL。PCR反应程序:94℃预变性90 s,94℃变性30 s,退火(温度根据引物设定)30 s,72℃延伸30~60 s,以上3个步骤循环30次,最后72℃延伸5 min,4℃保存,以ATCC 43300作为阳性对照。取PCR产物5μL进行琼脂糖凝胶电泳,之后放于凝胶成像系统成像。

表1 生物被膜形成相关基因引物Tab.1 Biofilm formation-related gene primer
1.2.4 乳源耐甲氧西林金黄色葡萄球菌多位点序列(MLST)分型
将耐甲氧西林金黄色葡萄球菌耐药基因(mecA)引物mecA F:5'GTGAAGATATACCAAGTGATT3'和mecA R:5'ATGCGCTATAGATTGAAAGGAT3'送至北京擎科生物科技有限公司合成,利用PCR扩增mecA基因,PCR体系同1.2.3所用反应体系。PCR反应程序:94℃预变性90 s,94℃变性30 s,56℃退火30 s,72℃延伸1 min,以上3个步骤循环30次,最后72℃延伸5 min,4℃保存,以ATCC 43300作为阳性对照。
取PCR产物5μL进行琼脂糖凝胶电泳,之后放于凝胶成像系统成像,如果为阳性则表示该细菌属于耐甲氧西林金黄色葡萄球菌(MRSA)。
根据MLST数据库中金黄色葡萄球菌数据库(https://pubmlst.org/saureus/)提及的管家基因(arcC、aroE、glpF、gmk、pta、tpi和yqiL)对本试验分离的MRSA进行检测。相关引物均由北京擎科生物科技有限公司合成。金黄色葡萄球菌管家基因引物信息见表2。使用之前提取好的细菌DNA作为模板,使用近岸蛋白质科技有限公司2×Taq DNA聚合酶,PCR体系同1.2.3所用反应体系。反应程序94℃预变性90 s,94℃变性30 s,56℃退火30 s,72℃延伸30~60 s,以上3个步骤循环35次,最后72℃延伸5 min,4℃保存。以ATCC 43300作为阳性对照。

表2 金黄色葡萄球菌管家基因引物Tab.2 Primer sequences of MLST PCR
取PCR产物3~5μL进行琼脂糖凝胶电泳,放于凝胶成像系统成像,观察目的条带。将PCR产物送至北京擎科生物科技有限公司测序。将测序后的结果使用DNASTAR进行拼接,上传至金黄色葡萄球菌多位点分型数据库中比对,即得到相应的基因型和序列型(STs)。
2 结果与分析
2.1 乳源金黄色葡萄球菌生物被膜形成能力(见表3)
由表3可知,55株金黄色葡萄球菌中34株生物被膜形成能力较强,17株生物被膜形成能力较弱,4株无生物被膜形成能力。

表3 乳源金黄色葡萄球菌生物被膜形成能力Tab.3 Formation ability of milk-derived Staphylococcus aureus biofilm
2.2 乳源金黄色葡萄球菌生物被膜形成相关基因的分布情况(见表4)
由表4可知,Eno和Alt检出率分别为89%和60%,表明乳源金黄色葡萄球菌具有较强的黏附能力。IcaA、IcaD和IcaR基因的检出率分别为44%、36%和27%,表明大多数生物被膜的形成都由ica系统参与调节。sigB基因的检出率为25%,Bap的检出率为18%,aap检出率为42%。统计结果发现,生物被膜形成能力强的菌株都携带多个生物被膜形成相关基因,说明生物被膜的形成过程可能是受多个基因共同调节。

表4 乳源金黄色葡萄球菌生物被膜形成相关基因分布情况Tab.4 Results of detection of genes related to the formation of milk-derived S.aureus biofilm
2.3 乳源耐甲氧西林金黄色葡萄球菌多位点序列(MLST)分型(见图1、表5)
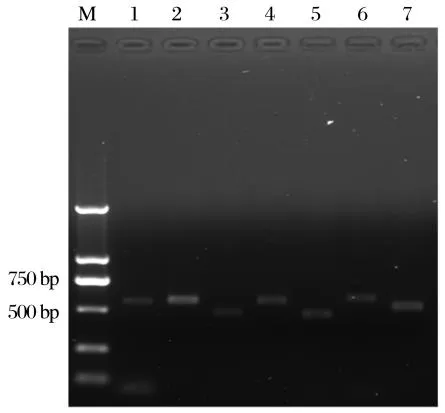
图1 部分金黄色葡萄球菌MILS分型PCR结果Fig.1 Part of S.aureus MILS typing PCR results
由图1可知,通过PCR扩增mecA基因,发现55株临床分离金黄色葡萄球菌中有17株为MRSA。
由表5可知,对这17株MRSA进行MLST分型,结果显示,17株金黄色葡萄球菌分为9个不同ST,但均属于已发现的ST型,其中ST97型5株,ST398型4株,ST239型2株,ST1、ST5、ST9、ST2157、ST5796和ST5817型各1株。本试验对这9个ST型进行了聚类分析,发现9个ST共聚类为5种克隆复合群,包括CC1、CC5、CC8、CC97和CC398。
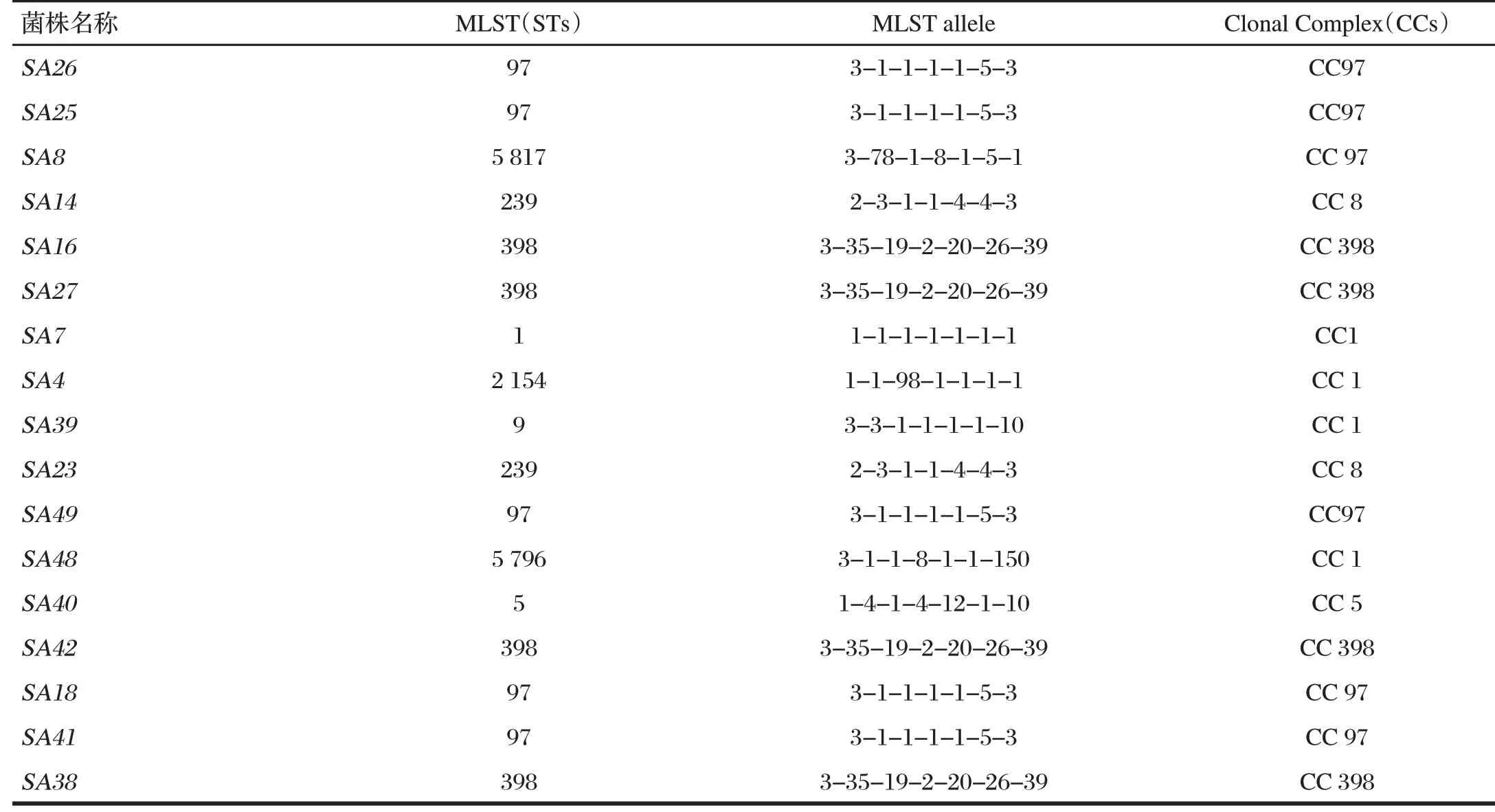
表5 金黄色葡萄球菌的MLST分型Tab.5 MLST typing of S.aureus
3 讨论
结晶紫可对细菌细胞以及生物被膜基质中的一些成分进行染色,非常适合量化生物被膜,因此常被用于测定各种细菌生物被膜形成能力。本研究中,34株(62%)生物被膜能力较强,17株(31%)生物被膜形成能力较弱,4株(7%)无生物被膜形成能力,说明乳源金黄色葡萄球菌普遍具有较强的生物被膜形成能力。Ica操纵子主要包括IcaA、IcaD和IcaBC,可以调控胞间多糖黏附素(PIA)的表达,能够促进生物被膜的形成,而IcaR能够抑制ica系统的表达,起到调控生物被膜生长的作用[12]。本试验中,IcaA、IcaD和IcaR基因的检出率分别为44%、36%和27%,表明大部分金黄色葡萄球菌都具有ica操纵子。本试验中,Eno、Atl、aap和Bap的检出率分别为89%、60%、42%和18%,表明乳源金黄色葡萄球菌具有较强的黏附能力。本研究中,生物被膜形成能力较强的菌株都携带多个生物被膜相关基因,但也有生物被膜形成能力较弱的菌株携带多个基因的现象,说明生物被膜的形成是个复杂生物过程。这些基因在形成过程中可能发挥一定的作用,但也会受其他因素的影响,如细菌密度、环境胁迫等[13]。
由于临床乳房炎致病菌的耐药性问题愈发严重,本研究检测乳源金黄色葡萄球菌携带mecA基因的情况,发现55株细菌中有17株(31%)携带该耐药基因,说明乳源致病菌的耐药性已十分严重。对这部分MRSA进行MLST分型,17株金黄色葡萄球菌分为9个ST型,但都属于已发现的ST型,其中ST97和ST398为优势株,与王登峰[14]调查牛源金黄色葡萄球菌优势流行菌株结果相似,表明引起奶牛乳房炎的细菌型别相对较集中。但是,也有研究显示,不同地区养殖场的金黄色葡萄球菌ST分型存在较大区别,可能是致病菌在某一区域扩散,从而使其在这一区域流行[15-16]。已有文献报道,ST398型金黄色葡萄球菌可以在人和动物之间传播[17]。本研究中,ST398也为优势菌株,说明在本地区乳源金黄色葡萄球菌可能会引起人畜共同感染。
4 结论
本试验通过对55株乳源金黄色葡萄球菌被膜形成能力及多位点序列分型分析,发现本地区的乳源金黄色葡萄球菌普遍具有较强的生物被膜形成能力,并且分型主要集中在ST97和ST398。

