叶黄素纳米结构脂质载体的制备与表征
孙清瑞,申哲伟,李晶,赵雪龙,郝冬雪
(黑龙江八一农垦大学食品学院,大庆 163319)
叶黄素是一种重要的具有多种生理活性的含氧类胡萝卜素,其具有降低多种慢性疾病的发病风险的功效。其生理活性主要有防治因老年黄斑变性病引起的视力下降与失明、抗氧化、抗癌、抗诱变、延缓动脉硬化等作用[1-4]。因其分子含18 个碳原子的共轭长链和位于两侧的两个不同的紫罗酮环,叶黄素易受光、热、氧及加工条件的影响而降解,此外,其还具有水分散性差和生物利用度低的缺陷,从而限制了其应用范围[3]。
近年来,纳米结构脂质载体(Nanostructured Lipid Carriers,NLC)作为一种包埋食品功能成分的技术,已引起越来越多的关注[5-9]。作为在固体脂质纳米粒基础上发展而来的新一代载运技术,纳米结构脂质载体是以液体脂质部分地取代固体脂质,这样其固体脂质中大量的无序晶格可更多地容纳生物活性物质[10-12]。NLC 技术具有生物相容性好、生物利用度高、物理稳定性高、良好缓释特性及易于规模化生产的优点[8],从而该技术在载运功能性食品成分方面极具应用前景。目前,食品领域的纳米结构脂质载体相关文献报道主要集中在运载β-胡萝卜素、DHA、辅酶Q10、姜黄素、虾青素、番茄红素。这些被脂质包埋的活性成分都具有生物利用度较低,水分散性及稳定性较差的共同特点。通过纳米结构脂质载体技术可提高这些活性成分的生物利用度、水分散性及理化稳定性。因此,研究通过叶黄素纳米结构脂质载体(L-NLC)包埋技术的研究,以期提高叶黄素的水分散性和生物利用度。
目前,国内尚未见有关叶黄素纳米结构脂质载体(L-NLC)的报道。研究旨在为L-NLC 工业化生产提供前期的理论和技术参考,这对拓宽叶黄素在功能性食品等领域的应用具有十分重要的意义。
1 材料与设备
1.1 主要材料与试剂
叶黄素原料(纯度92%),华北制药股份有限公司;叶黄素标品(货号X6250),Sigma-Aldrich 公司;分析纯试剂正己烷、无水乙醇、丙酮、化学纯试剂吐温80,国药集团化学试剂有限公司;山嵛酸甘油酯(ATO),嘉法狮有限公司;辛癸酸甘三酯(MCT),上海通用药业有限公司。
1.2 主要仪器与设备
Zetasizer Nano-ZS90 型激光粒度仪,英国Malvern 公司;Dimension Icon 型扫描探针显微镜(AFM),美国Bruker 公司;D8 型X-射线衍射仪(XRD),Bruker AXS(德国)有限公司;IS10 型傅立叶变换红外光谱仪,Nicolet(美国)公司;LabRAM HR Evolution 型共聚焦显微拉曼光谱仪,Horiba Jobin Yvon(法国)公司;UV765 型紫外-可见分光光度计,上海仪电分析仪器有限公司。
DF-101S 型集热磁力搅拌器,常州金坛良友仪器有限公司;TGL-16M 型离心机,湘仪离心机仪器有限公司;Alpha 1-2 LD plus 型冷冻干燥机,德国CHRIT 公司;FS450N 超声波细胞破碎仪:上海生析超声仪器有限公司。
2 试验方法
2.1 叶黄素纳米结构脂质载体的制备
在预试验的基础上,叶黄素纳米结构脂质载体的制备采用溶剂扩散-超声分散联用法:首先,在回流装置中,于磁力搅拌条件下,基于100 mL 质量分数为2%的吐温80 水溶液,将一定量的固体脂质ATO、叶黄素、液体脂质MCT 及5 mL 无水乙醇加热回流(75 ℃,10 min),使其呈均一相;然后,快速加入100 mL 同温的质量浓度为2%的吐温80 水溶液,磁力搅拌(200 r·min-1)5 min,再经超声分散(超声功率350 W,脉冲为每运行20 s 间歇5 s)5 min;最后,用冰水浴将其迅速冷却至室温,得到L-NLC 溶液,置于冰箱(4 ℃),备测。
2.2 包封率、有效载量的测定
叶黄素总含量的测定采用丙酮增溶法[13-14]。取适量叶黄素纳米结构脂质载体(L-NLC)放入10 mL 刻度试管中,加入1 mL 丙酮,漩涡震荡1 min,用丙酮定容至10 mL。同法以空白-NLC 为对照,用紫外-可见光分光光度计测定其波长440 nm 下的吸光值并计算叶黄素含量。叶黄素含量测定的标准曲线方程为y=0.229 73 x-0.032 67。其中,y 为吸光值;x 为试样的浓度,μg·mL-1;线性范围为0.5~4.5 μg·mL-1,R2=0.996 89。同条件下试样平行测定3 次,取其算数平均值。
游离叶黄素的测定采用改进的有机溶剂萃取法[14-15]。取适量L-NLC 放入15 mL 刻度试管中,加入1 mL 正己烷,漩涡震荡1 min,离心(5 000 r·min-1)2 min,取上层正己烷萃取液。重复萃取2 次,合并正己烷萃取液,再用正己烷定容至10 mL。用紫外—可见分光光度法测游离叶黄素含量。标准曲线方程为y=0.254 57 x+0.008 71,其中,y 为440 nm 处吸光值;x为试样的浓度,μg·mL-1;线性范围为0.5~4.5 μg·mL-1,R2=0.996 05。同条件下的试样平行测定3 次,取其算数平均值。
包封率、载量及有效载量分别按公式(1)、(2)和(3)计算。

2.3 粒径的测定
首先,用去离子水稀释叶黄素纳米结构脂质载体(L-NLC)试样至适当倍数。接着将稀释后的试样置于聚苯乙烯比色皿(折光指数1.33)中,在(25±0.1)℃恒温3 min,用配有He/Ne 激光器(λ=633 nm)的Nano-ZS90 粒径分析仪测定粒径(散射角为90 °),记录平均粒径和多分散指数PDI 值。PDI 数值越小,表明粒径分布越集中,数值在0~0.3 之间表明具有较好的分散均匀性[16]。
2.4 叶黄素纳米结构脂质载体的表征
表征叶黄素纳米结构脂质载体(L-NLC)微观结构时所用的原子力显微镜(AFM)、X-射线衍射仪(XRD)、红外光谱仪(IR)及拉曼光谱仪的分析操作采用文献[14]的方法,具体方法如下:
原子力显微镜(AFM):首先将适量L-NLC 用超纯水稀释2 000 倍,随后取1 μL 样品在新解离的云母表面铺展,接着将其于室温下放置30 min,使LNLC 颗粒充分吸附于云母表面。待样品室温干燥24 h 后,将其置于原子力显微镜的扫描探头(Si 探针)下,以ScanAsyst 模式扫描(频率320 kHz,弹簧系数42 N·m-1),进行检测。图像采集采用高度模式,设置参数如下:0.977 Hz 扫描速率,512×512 分辨率,5 μm×5 μm 扫描尺寸。图像处理采用NanoScopeTM 软件。
X-射线衍射(XRD):L-NLC 及空白-NLC 冻干粉的晶相用D8 X-射线衍射仪分析,辐射源为Cu Kɑ,管电压为45 kV,管电流为40 mA,扫描范围为0 °~40 °,扫描速率为2 °·min-1。
红外光谱(IR):L-NLC 及空白-NLC 冻干粉的IR 谱图采用IS10 傅立叶变换红外光谱仪(美国,Nicolet 公司)测试,测试分辨率为2 cm-1,扫描次数为36 次,测试范围为400~4 000 cm-1,测试温度范围为23~25 ℃。
拉曼光谱:取适量L-NLC 或空白-NLC 样品滴于覆有锡箔纸的载玻片上,选用50 倍物镜将激光束聚焦于凸起的球状液滴上,并观测和记录谱线。测定条件:以He-Ne 激光器为光源,激发波长为632.81 nm,扫描范围为600~3 000 cm-1,由CCD 多道探测,积分时间为30 s×1。
L-NLC 产品中叶黄素构型变化,参照文献[21]的HPLC 法进行分析,柱温25 ℃;流动相为甲醇-水(98∶2,V·V-1);流速1.0 mL·min-1;进样量20 μL。
3 结果与分析
3.1 制备条件对叶黄素纳米结构脂质载体品质的影响
在预试验的基础上,重点考察叶黄素载量和液脂MCT 质量分数(基于固液总脂质的质量)对叶黄素纳米结构脂质载体(L-NLC)品质的影响,试验结果如图1 所示。


图1 制备条件对L-NLC 品质的影响Fig.1 Effects of preparation parameters on quality of L-NLC
包封率和有效载量是评价L-NLC 品质与应用价值的两个重要参数。固定总脂质质量浓度为5%(g·mL-1)和MCT 质量分数为30%的条件下,测定所得样品的包封率、粒径和PDI。图1(A1)显示,随载量的升高,叶黄素的包封率有一定程度的下降,当载量为3%时,包封率降至73.6%。有效载量可以直观评价叶黄素载入脂质的能力。叶黄素的有效载量随载量增大而逐渐增加的趋势表明,在所试载量范围内,叶黄素能够有效地载入到NLC 中。图1(A2)表明,随载量的提高,L-NLC 的平均粒径逐渐增加,当载量为2%时,平均粒径为168.2 nm。PDI 值随载量的升高呈逐渐增大的趋势,载量2.5%时,PDI 值已大于0.3,表明此时体系分散性较差。因此,在后续研究中固定叶黄素载量为2%。
固定总脂质质量浓度为5%和载量为2%的条件下,测定所得样品的包封率、粒径和PDI。图1(B1)显示,液脂MCT 含量为30%时,包封率最高均值达到88.9%。图1(B2)表明,MCT 含量在15%~40%范围内,L-NLC 粒子的平均粒径先减小后增大,PDI 值呈逐渐增大趋势。在MCT 含量为30%时,对应的平均粒径最小值为168.2 nm,PDI 值为0.28(小于0.3)。平均粒径的先下降,可能是液态脂质和固态脂质黏度不同,脂相的黏度随液态脂质含量的增加而降低,从而降低了NLC 粒子的内部黏度,也相应地降低了固-液界面张力,易于生成粒径小且表面光滑的粒子[13]。平均粒径随后的增大,说明除了黏度因素影响外,还有表面能随分散度增高而增大的影响。初始生成的小粒子表面能高,未及时吸附其他物质或未及时被包覆时,可能自发地聚集成较大粒子,导致NLC 粒子的粒径增加。
固定MCT 质量分数为30%和载量为2%的条件下,测定所得样品的包封率、粒径和PDI。图1(C1)显示,随着L-NLC 中总脂质质量浓度的增加,包封率出现先上升后下降的趋势,相比较而言,在总脂质质量浓度为5%时,包封率具有最高值88.9%。同时图1(C2)显示,随着总脂质质量浓度的增加,L-NLC 粒子的平均粒径呈逐渐增加的趋势,PDI 值亦呈不断增加的趋势,当总脂质质量浓度为5%时,平均粒径为168.9 nm,PDI 值仍小于0.3。为进一步优化L-NLC的制备工艺,后续进行了正交试验。
3.2 正交试验
叶黄素纳米结构脂质载体(L-NLC)制备的正交试验因素水平表见表1,正交试验结果及极差分析见表2,正交试验结果方差分析见表3。

表1 正交试验因素与水平表Table 1 Factors and levels of the orthogonal experiments
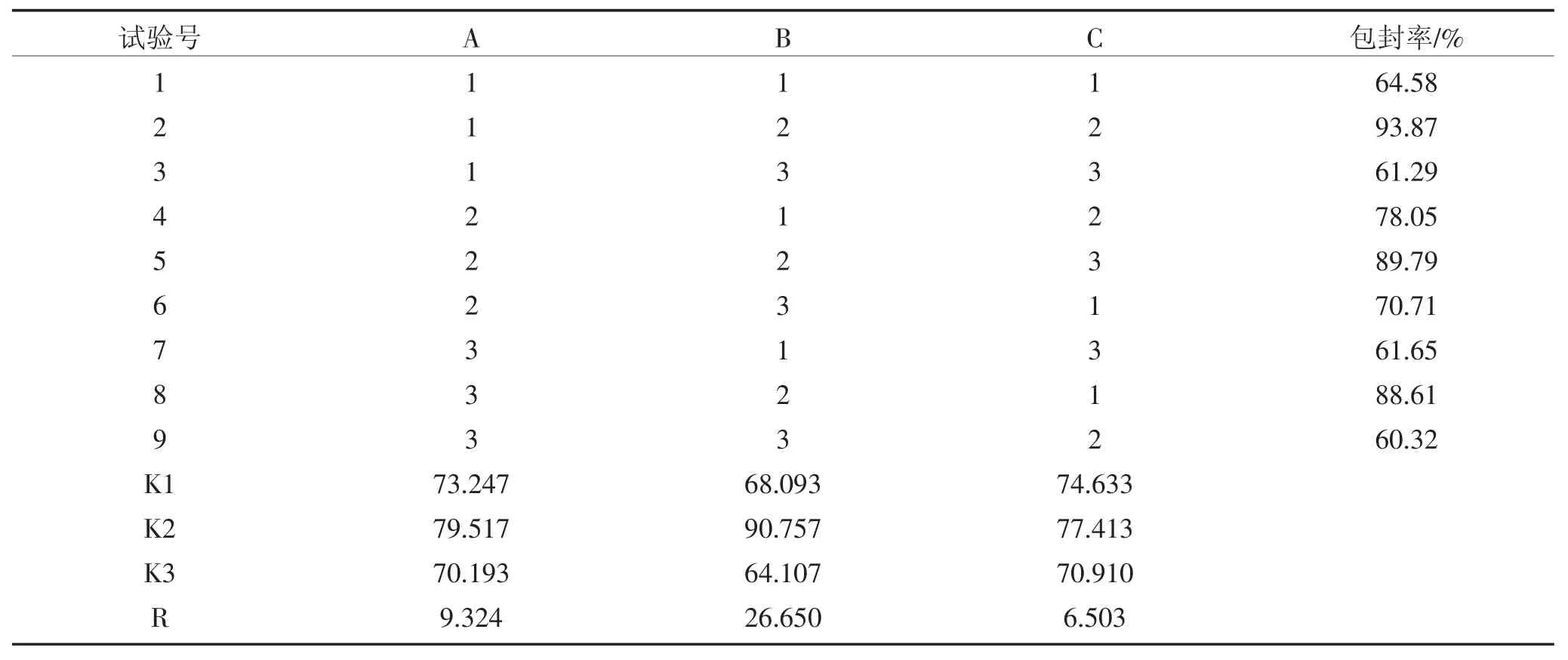
表2 正交试验结果表Table 2 Design and the results of the orthogonal experiments
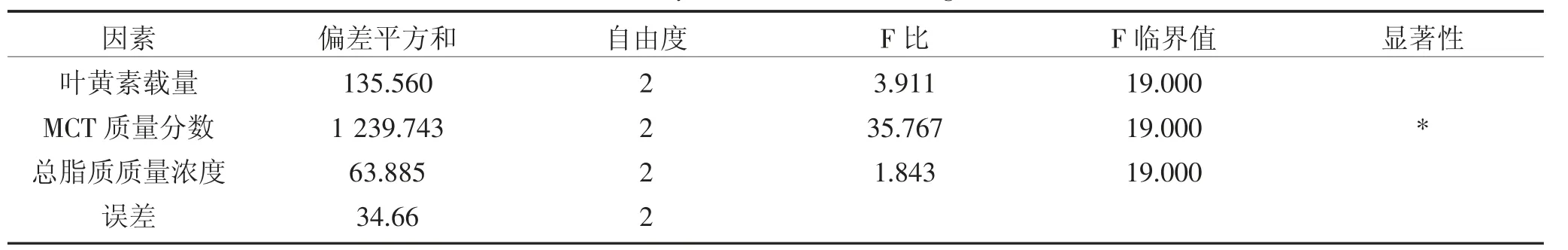
表3 正交试验方差分析结果Table 3 Analysis of variance of orthogonal test
极差分析结果表明,各因素对叶黄素纳米结构脂质载体的影响大小依次为MCT 质量分数>叶黄素载量>总脂质质量浓度,方差分析结果表明,MCT 质量分数对包封率有显著影响(P<0.05)。制备叶黄素纳米结构脂质载体的最佳反应组合为A2B2C2。为得到较高含量的叶黄素纳米结构脂质载体水溶液,并综合单因素试验的结果,该工艺确定为:叶黄素载量为2%,总脂质质量浓度5%(g·mL-1),MCT 质量分数(液体脂质占总脂质的比率)为30%,表面活性剂质量浓度2%(g·mL-1),超声功率337.5 W,脉冲为每运行20 s间歇5 s,总时长5 min。按最佳组合方案A2B2C2作验证试验,经3 次重复试验,包封率均值为89.0%,表明正交试验得出的最佳工艺符合实际试验要求。
3.3 粒径分布及光学特征
图2(A)为叶黄素纳米结构脂质载体(L-NLC)的粒径分布图。该图显示,L-NLC 粒子的平均粒径为168.2 nm,PDI 值为0.28,小于0.3,表明L-NLC 试样的粒子分散较均一。图2(B)表明,L-NLC 胶体体系的丁达尔效应明显(试样B2和B3),这体现了胶体体系中纳米粒子的共有光学特征。

图2 L-NLC 的粒径分布与光学特征Fig.2 The size distribution and the outer appearance of L-NLC sample
3.4 叶黄素纳米结构脂质载体(L-NLC)结构特征
3.4.1 形貌
图3 是试样的AFM 分析图像,在5 μm×5 μm的扫描范围内,可观测到类球形的粒子的平均粒径为162 nm,这些粒子无聚集、融合现象,分散均匀。相比较而言,AFM 测得的平均粒径略小于动态光散射(DLS)法测的结果(168 nm),这因DLS 法测得的是L-NLC 水化粒子的粒径,而AFM 法观测的是其经干燥后的试样粒径。

图3 新制得的L-NLC 试样的AFM 分析图Fig.3 AFM image of fresh L-NLC sample
3.4.2 晶态
在NLC 粒子中,NLC 的载量和包封率由起到骨架作用的固体脂质晶型所影响[17];液体脂质的加入可促进固体脂质非完美晶格生成,从而增大NLC 的包埋空间。L-NLC 冻干粉、空白-NLC 冻干粉及山嵛酸甘油酯(ATO)的XRD 分析结果如图4 所示。3 种试样在2 θ 值为21.2 °和23.5 °处均出现较强的衍射峰,反映出ATO 的β 晶型特征[7]。此外,在该图中未发现叶黄素晶体的衍射峰,说明叶黄素分子以非晶态形式分散于NLC 脂质中,这有利于叶黄素的稳定包埋。

图4 ATO、L-NLC 冻干粉和空白-NLC 冻干粉的XRD 谱图Fig.4 XRD patterns of L-NLC freeze-dried powders,Blank-NLC freeze-dried powders and ATO
3.4.3 红外光谱特性
图5 是采用FTIR 技术研究NLC 包埋叶黄素的状况。图中显示,L-NLC 冻干粉和空白-NLC 冻干粉的红外光谱几乎一致。现有的研究[18-19]表明,叶黄素分子在964 cm-l左右存有一个典型的特征吸收峰,该峰为叶黄素共轭多烯链中C-H 面外弯曲振动所产生。而L-NLC 冻干粉的红外光谱中,964 cm-l处吸收峰几近消失,这表明叶黄素已被包埋于NLC 中。
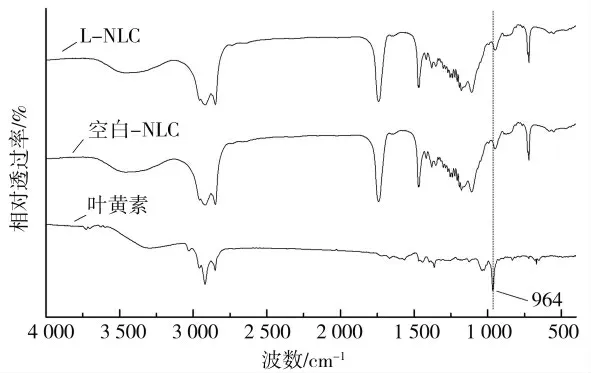
图5 L-NLC 冻干粉、空白-NLC 冻干粉及叶黄素的红外光谱Fig.5 FTIR spectra of L-NLC freeze-dried powders and Blank-NLC freeze-dried powders
3.4.4 拉曼光谱特性
拉曼光谱法具有试样无需前处理和破坏、分析结果不受溶剂水分子振动干扰的优点。如图6 所示,利用拉曼光谱技术对NLC 粒子中的叶黄素分子包埋状况进行了研究。叶黄素的拉曼光谱主要由4 个峰组成,即分子中多烯链的C=C 键的同相伸缩振动(ν1)、C-C 键的同相伸缩振动(ν2)、甲基的平面内摆动(ν3)和氢原子的平面外摆动(ν4)[20]。图6 中,LNLC 冻干粉试样在波数1 532、1 197、1 164 cm-l处分别对应叶黄素的ν1、ν2和ν3的3 个主要拉曼峰。结合3.4.3 的红外光谱分析结果,可认为叶黄素分子已被包埋于NLC 的固液脂基粒子中。

图6 L-NLC 试样和空白-NLC 试样的拉曼光谱Fig.6 Roman spectra of L-NLC sample and Blank-NLC sample
3.4.5 产品中叶黄素构型变化
为了进一步鉴定叶黄素纳米结构脂质载体(LNLC)中叶黄素异构体的组成,采用配有DAD 检测器的HPLC 对L-NLC 进行分析,结果如图7 所示。试验结果表明,L-NLC 制备前(图7B)所用原料叶黄素99%以上为全反式结构(All-E),仅含有少量9 顺式异构体(9Z);而L-NLC 制备后,图7A 显示,其载运的叶黄素发生了部分构型转化现象,依据李大婧等[21]的研究,可鉴别出13Z 叶黄素和13`Z 叶黄素明显增加,且经峰面积归一化法可得总顺式叶黄素异构体占比达到8.5%,这是由于制备L-NLC 过程的热致全反式叶黄素异构化所导致。
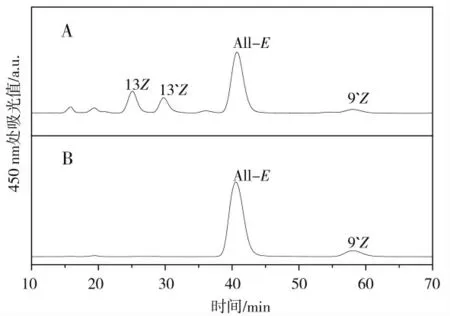
图7 L-NLC 的液相色谱图Fig.7 Liquid chromatography of L-NLC
4 结论
叶黄素的载量和液脂MCT 含量和总脂质浓度影响着L-NLC 的包封率、平均粒径和分散均匀性。在叶黄素载量2%、MCT 质量分数30%及总脂质质量浓度5%(g·mL-1)的条件下,通过溶剂扩散-超声分散联用法可制备出粒径较小(低于170 nm)、体系分散性良好(PDI<0.3)的L-NLC,被包埋的叶黄素分子以非晶态形式分散到其固液脂基体系中。在载运叶黄素方面,该NLC 制备方法辅以少量绿色试剂乙醇为扩散助剂,具有操作简单、设备要求不高的优势,所得产品有望应用到功能性食品等领域。此外,关于LNLC 中叶黄素生物利用度变化及在贮藏过程中化学稳定性方面的研究,有待下一步开展。

