CD4+ CD25+ FOXP3+ Treg细胞在高危多发性骨髓瘤治疗中预测复发及治疗意义
王晓丽 江妤 曾玉晓 刘永华 章俏雷

[關键词] CD4+ CD25+ FOXP3+;调节性T淋巴细胞;高危;多发性骨髓瘤;化疗;疗效;复发
[中图分类号] R733.3 [文献标识码] A [文章编号] 1673-9701(2021)16-0032-05
Significance of CD4+ CD25+ FOXP3+ Treg cells in predicting recurrence and therapeutic effect in treatment of high-risk multiple myeloma
WANG Xiaoli JIANG Yu ZENG Yuxiao LIU Yonghua ZHANG Qiaolei
Department of Hematology,Lishui People′s Hospital in Zhejiang Province, Lishui 323000, China
[Abstract] Objective To explore the significance of CD4+ CD25+ FOXP3+ regulatory T lymphocytes (Treg) in predicting recurrence and therapeutic effect in the treatment of high-risk multiple myeloma. Methods A total of 126 patients with high-risk multiple myeloma admitted to our hospital from March 2018 to March 2019 were selected as the case group, and 100 healthy patients who received physical examination in our hospital during the same period were selected as the control group. The proportions of CD4+ CD25+ FOXP3+ Treg cells in the peripheral blood were compared between the case group and the control group,and among patients with different chemotherapy effect and recurrence conditions. Spearman correlation was used to analyze the correlation between the proportion of CD4+ CD25+ FOXP3+ Treg cells and the recurrence. Receiver operating characteristic curve (ROC) was used to analyze the value of the proportion of CD4+ CD25+ FOXP3+ Treg cells in predicting recurrence. Kaplan-Meier analysis was used to analyze the progression-free survival during follow-up of patients with different proportions of CD4+ CD25+ FOXP3+ Treg cells. Results The proportion of CD4+ CD25+ FOXP3+ Treg cells in the case group was significantly higher than that in the control group (P<0.001). The proportion of CD4+ CD25+ FOXP3+ Treg cells in chemotherapy-ineffective patients was significantly higher than that in chemotherapy-effective patients(P<0.001). The proportion of CD4+ CD25+ FOXP3+ Treg cells in patients with recurrence was significantly higher than that of patients without recurrence(P<0.001). The proportion of CD4+ CD25+ FOXP3+ Treg cells was positively correlated with patient recurrence(P<0.05). The AUC of the proportion of CD4+ CD25+ FOXP3+ Treg cells in predicting recurrence was 0.809 (95%CI: 0.759-0.856), with sensitivity of 62.80%, specificity of 95.80%, accuracy of 89.30%, and cutoff value of 3.66%. The patients with CD4+ CD25+ FOXP3+ Treg cell ratio >3.66% had a significantly lower progression-free survival rate during follow-up than those with CD4+ CD25+ FOXP3+ Treg cell ratio <3.66%(P<0.05). Conclusion The proportion of CD4+ CD25+ FOXP3+ Treg cells has an increasing trend in the peripheral blood of patients with high-risk multiple myeloma. The detection of its level has a certain predictive value for recurrence after chemotherapy,which is helpful for clinical prediction of chemotherapy effect, monitoring of early recurrence and prognostic judgment.
[Key words] CD4+ CD25+ FOXP3+; Regulatory T lymphocytes; High risk; Multiple myeloma; Chemotherapy; Therapeutic effect; Recurrence
多发性骨髓瘤是一种由浆细胞增殖异常所致的血液系统恶性肿瘤,目前以硼替佐米为主的化学药物治疗方案的临床疗效获得肯定,但该病的复发仍是一大难题,特别相较于低危患者,高危患者预后差异性明显,其中肿瘤免疫逃逸扮演了重要角色[1-2]。CD4+ CD25+ FOXP3+ 调节性T细胞(Treg)作为肿瘤免疫逃逸的重要调控因素,在多发性骨髓瘤发病和病情进展过程中发挥重要作用[3-4]。Treg细胞的增加可使机体抗肿瘤免疫系统受损,造成肿瘤免疫逃逸和肿瘤进展。现已发现,在多发性骨髓瘤患者发病过程中肿瘤微环境Treg细胞比例异常增加,其增加程度因个体与疾病阶段而异,且Treg细胞与多发性骨髓瘤更高的进展风险关系密切[5],这与即将要重点研究的高危多发性骨髓瘤患者方向一致。本研究分析了CD4+ CD25+ FOXP3+ Treg细胞在高危多发性骨髓瘤治疗中预测复发的意义,希望为高危多发性骨髓瘤的临床治疗和预后指导提供依据,现报道如下。
1 资料与方法
1.1一般资料
征得我院医学伦理委员会批准,选择2018年3月至2019年3月我院收治的126例高危多发性骨髓瘤患者为病例组,同期在我院体检健康者100例为对照组。病例组男87例,女39例;年龄30~75岁,平均(56.20±4.85)岁;体质量指数(22.41±2.23)kg/m2;Durie-Salmon(D-S)分期:Ⅰ期3例,Ⅱ期16例,Ⅲ期107例;国际分期系统(ISS)分期:Ⅰ期14例,Ⅱ期67例,Ⅲ期45例。对照组男62例,女38例;年龄30~78岁,平均(55.29±5.07)岁;体质量指数(22.17±2.92)kg/m2。两组一般资料比较,差异无统计学意义(P>0.05),具有可比性。纳入标准:①多发性骨髓瘤根据《中国多发性骨髓瘤诊治指南(2017年修订版)》中相关标准确诊[6];②mSMART3.0分期高危,即合并t(14,16)、1q21扩增、t(4,14)、17p缺失/突变、t(14,20)[7];③初诊患者;④无其他血液系统疾病或其他恶性肿瘤;⑤自愿签订知情同意书。排除标准:①妊娠期或哺乳期妇女;②重要功能异常者,如心、肝、肺、脑等;③临床资料不齐全、依从性差者;④入院前接受相关治疗者;⑤合并精神系统疾病者;⑥随访期间失访者。
1.2 方法
所有患者应用硼替佐米(江苏豪森药业集团有限公司,国药准字H20173307,规格:3.5 mg)联合环磷酰胺(江苏盛迪医药有限公司,国药准字H32020857,规格:0.2 g)、地塞米松(天津金耀集团湖北天药药业股份有限公司,国药准字H14021151,規格:1 mL∶5 mg)(PCD方案)化疗:第1、4、8、11天给予硼替佐米 1.3 mg/m2皮下注射,第1、8、15、22天给予环磷酰胺300 mg/m2口服,第1、2、4、5、8、9、11、12天给予地塞米松20 mg静脉滴注。4周为1个疗程,均治疗2~8个疗程。
1.3 观察指标及评价标准
(1)比较病例组和对照组不同化疗疗效、不同复发情况患者外周血CD4+ CD25+ FOXP3+ Treg细胞比例。①外周血CD4+ CD25+ FOXP3+ Treg细胞比例检测:入院次日清晨,采集肘静脉血2 mL,用乙二胺四乙酸(Ethylenediamine tetraacetic acid,EDTA)抗凝,用人淋巴细胞分离液(杭州联科生物技术股份有限公司)将外周血中的单个核细胞分离,再通过三色直接免疫荧光法将单个核细胞膜表面的CD4、CD25、FOXP3进行标记,所有操作严格按照试剂盒说明进行,以CD4 T细胞设门,通过BD FACSCalibur流式细胞仪(上海实维实验仪器技术有限公司)检测外周血CD4+ CD25+ FOXP3+ Treg细胞比例。②疗效判定标准:通过国际骨髓瘤工作组(International working group on myeloma,IMWG)标准对疗效进行判定,疗效等级包括病情进展(PD)、疾病稳定(SD)、部分缓解(PR)、十分好的部分缓解(VGPR)、完全缓解(CR)。有效=(CR+VGPR+PR)例数/总例数×100%,否则为无效[8]。CR:患者血尿免疫固定电泳阴性,无软组织浆细胞瘤表现,骨髓内浆细胞≤5%;VGPR:患者血蛋白和尿蛋白电泳均无隐形,血清M蛋白下降≥90%;PR:患者24 h尿M蛋白下降90%或90%异常,24 h尿蛋白量<0.2 g,血清M尿蛋白量下降≥50%。若患者的血清M尿蛋白测量结果不可靠,可测量血清单克隆游离轻链和非血清单克隆游离轻链之间的距离,若两者之间的距离缩小50%或>50%也判定为部分缓解;SD:不符合CR、VGPR、PR判定标准的患者;PD:患者尿M蛋白、血清M蛋白增加≥25%。如果血、尿M蛋白不能检测,则根据血清单克隆游离轻链和非血清单克隆游离轻链之间的距离进行判断,两者之间距离的差值增加25%或超过25%即可判断为病情进展。(2)随访情况:随访时间18个月,统计复发比例及无进展生存率。①用Spearman相关性分析CD4+ CD25+ FOXP3+ Treg细胞比例与患者复发的相关性。②用ROC分析CD4+ CD25+ FOXP3+ Treg细胞比例预测患者复发的价值。③进行CD4+ CD25+ FOXP3+ Treg细胞比例不同患者随访期间无进展生存的Kaplan-Meier分析。
1.4 统计学方法
采用SPSS 22.0统计学软件对数据进行分析。计量资料以(x±s)表示,采用独立样本t检验;计数资料以[n(%)] 表示,采用χ2检验;相关性分析用Spearman检验;生存分析采用Kaplan-Meier法;ROC分析CD4+ CD25+ FOXP3+ Treg细胞比例预测患者复发的价值。P<0.05为差异有统计学意义。
2 结果
2.1 病例组和对照组CD4+ CD25+ FOXP3+ Treg细胞比例比较
病例组CD4+ CD25+ FOXP3+ Treg细胞比例远高于对照组,差异有统计学意义(P<0.001)。见表1。
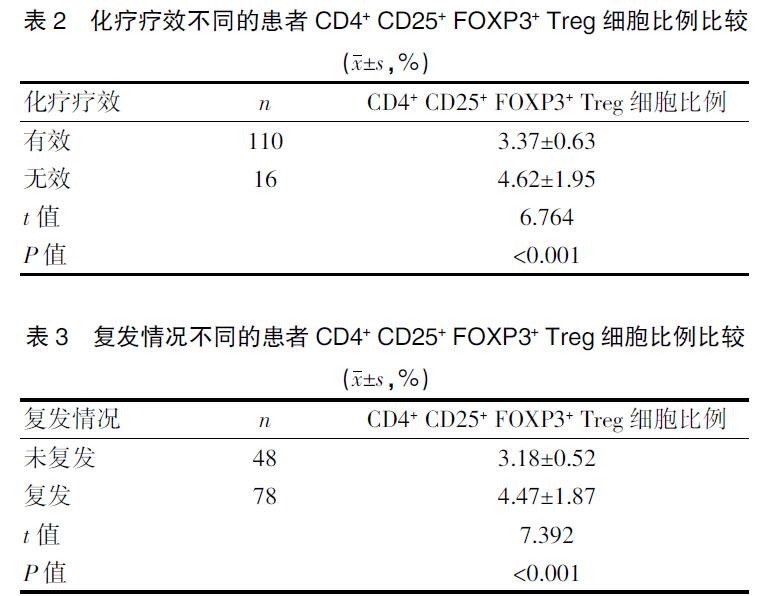
2.2 化疗疗效不同的患者CD4+ CD25+ FOXP3+ Treg细胞比例比较
126例患者的治疗总有效率为87.30%(110/126),其中CR 59例,VGPR 27例,PR 24例。化疗无效患者CD4+ CD25+ FOXP3+ Treg细胞比例远高于化疗有效患者,差异有统计学意义(P<0.001)。见表2。
2.3 复发情况不同的患者CD4+ CD25+ FOXP3+ Treg细胞比例比较
126例患者化疗后复发78例。复发患者CD4+ CD25+ FOXP3+ Treg细胞比例远高于未复发患者,差异有统计学意义(P<0.001)。见表3。
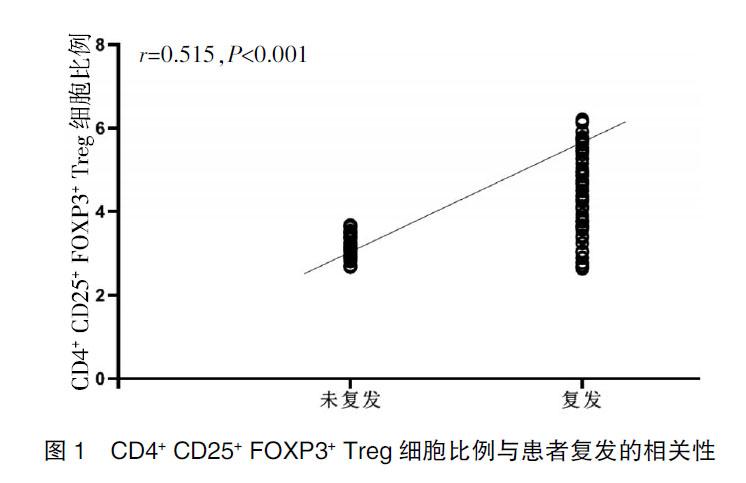
2.4 Spearman相关性分析
CD4+ CD25+ FOXP3+ Treg细胞比例与患者复发呈正相关(r=0.515,P<0.001)。见图1。
2.5 ROC曲线分析
CD4+ CD25+ FOXP3+ Treg细胞比例预测患者复发的AUC(95%CI:0.759~0.856)为0.809,敏感性为62.80%,特异性为95.80%,准确性为89.30%,截断值为3.66%。见图2。
2.6 Kaplan-Meier生存曲线分析
CD4+ CD25+ FOXP3+ Treg细胞比例>3.66%组随访期间无进展生存率显著低于CD4+ CD25+ FOXP3+ Treg细胞比例<3.66%组[52.24%(35/67) vs. 76.27%(45/59)],差异有统计学意义(Log-rank χ2=7.296,P=0.007)。见图3。
3 讨论
Treg细胞是免疫抑制CD4 T细胞的特殊亚群,占CD4+T细胞的5%~10%,其中最关键的亚型是CD4+ CD25+ FOXP3+ Treg细胞,在肿瘤免疫逃逸中有着重要作用[9-10]。Treg细胞是一类有着负调节功能的T细胞亚群,是机体免疫耐受维持的必要条件,根据其来源可分为天然型和诱导型[11-13]。抗原刺激CD4+T细胞后,在转化生长因子β(Transforming growth factor β,TGF-β)充分诱导下,可通过Janus激酶(Janus kinase,JAK)/信号转导因子和转录活化因子5(Signal transduction factor and activator of transcription 5,STAT5)通路,促进FOXP3分化为诱导型Treg,其表型为CD4+ CD25+ FOXP3+[14-15]。FOXP3为天然型Treg细胞的特征性转录因子,在天然型Treg细胞分化及发育中具有关键作用;且FOXP3的遗传缺陷可造成Treg功能异常和免疫失调,诱发恶性肿瘤[16-17]。CD4+ CD25+ FOXP3+ Treg细胞与恶性肿瘤的关系是近年来临床的研究热点。文献指出[18],Treg可与靶细胞接触,通过表达于细胞表面的TGF-β和细胞毒T淋巴细胞相关抗原4(Cytotoxic T lymphocyte associated antigen 4,CTLA-4)的作用,抑制白细胞介素-2受体α(Interleukin-2 receptor alpha,IL-2Rα)表达,下调靶细胞增殖活性;此外,Treg还可通过分泌白细胞介素10(Interleukin 10,IL-10)和TGF-β等细胞因子,抑制T 细胞活化而起到免疫負调节的作用。有研究发现[19],恶性肿瘤患者外周血(或骨髓)中CD4+ CD25+ FOXP3+ Treg细胞数量的增加与恶性肿瘤的发病及病情发展有着强烈的正相关关系,抑制Treg细胞功能有助于恶性肿瘤疾病的免疫治疗。有研究显示[20],Treg在多发性骨髓瘤患者外周血中异常积累,可下调抗肿瘤免疫效应以促进肿瘤生长,其作用机制包括分泌颗粒酶杀伤效应细胞、调节树突状细胞影响Treg增殖、干扰效应细胞的代谢功能等。
本研究结果显示,病例组CD4+ CD25+ FOXP3+ Treg细胞比例远高于对照组(P<0.001),与既往研究一致[21],提示在多发性骨髓瘤患者外周血中Treg表达上升。化疗无效、复发患者CD4+ CD25+ FOXP3+ Treg细胞比例远高于化疗有效、未复发患者(P<0.001),提示CD4+ CD25+ FOXP3+ Treg细胞比例与患者化疗无效和复发呈正相关,CD4+ CD25+ FOXP3+ Treg细胞检测可能有助于临床预测化疗效果、监测早期复发,以提供更精准的化疗药物治疗方案。ROC分析显示,CD4+ CD25+ FOXP3+ Treg细胞比例预测患者复发的AUC(95%CI:0.759~0.856)为0.809,敏感性为62.80%,特异性为95.80%,准确性为89.30%,截断值为3.66%,提示外周血CD4+ CD25+ FOXP3+ Treg细胞比例预测患者复发有一定价值,当患者初诊时外周血CD4+ CD25+ FOXP3+ Treg细胞比例大于3.66%,可提示其化疗后复发风险大,临床应予以重视和密切观察,适当调整干预方案,以降低治疗难度。此外,Kaplan-Meier分析显示,CD4+ CD25+ FOXP3+ Treg细胞比例>3.66%组随访期间无进展生存率显著低于CD4+ CD25+ FOXP3+ Treg细胞比例<3.66%组(P<0.05),提示监测CD4+ CD25+ FOXP3+ Treg细胞水平对于高危多发性骨髓瘤患者预后判断有一定积极意义,可为患者提供更精确的预后咨询。
综上所述,CD4+ CD25+ FOXP3+ Treg细胞比例在高危多发性骨髓瘤患者外周血中呈上升状态,其水平检测对于化疗后复发有一定预测价值,有助于临床预测化疗效果、监测早期复发及预后判断。但本研究纳入病例数有限且随访时间较短,有待扩大样本数及延长研究时间进一步观察加以证实。
[参考文献]
[1] 谭鑫.多发性骨髓瘤患者血清β2-微球蛋白,TNF-α,CRP及IL-6水平检测[J]. 中国现代医生,2019,57(26):13-16.
[2] Gu C,Cheng H,Yang H,et al. FOXM1 is a therapeutic target for high-risk multiple myeloma[J]. Leukemia,2018, 30(4):873-874.
[3] Xu F,Yu S,Qin M,et al. Hydrogen-rich saline ameliorates allergic rhinitis by reversing the imbalance of Th1/Th2 and up-regulation of CD4+ CD25+ Foxp3+ regulatory T cells, interleukin-10,and membrane-bound transforming growth factor-β in guinea pigs[J]. Inflammation,2018,4(9):1023-1025.
[4] Wang J,Yang J,Yan Y,et al. Effect of adoptive transfer of CD4+CD25+Foxp3+ Treg induced by trichostatin A on the prevention of spontaneous abortion[J]. Journal of Reproductive Immunology,2018,131(8):30-35.
[5] 許婷,唐亚男,何月茹,等. NK细胞及调节性T细胞在多发性骨髓瘤中的表达水平及其意义[J]. 临床血液学杂志,2020,247(2):42-45.
[6] 中国医师协会血液科医师分会,中华医学会血液学分会,中国医师协会多发性骨髓瘤专业委员会. 中国多发性骨髓瘤诊治指南(2017年修订)[J]. 中华内科杂志,2017,7(11):89-92.
[7] 刘珊,陈为民,林芸,等. mSMART3.0不同危险分层多发性骨髓瘤患者临床疗效与预后分析[J]. 中国实用内科杂志,2020,40(4):67-72.
[8] 中国医师协会血液科医师分会,中华医学会血液学分会,中国医师协会多发性骨髓瘤专业委员会. 中国多发性骨髓瘤诊治指南(2020年修订)[J]. 中华内科杂志,2020,59(5):341-346.
[9] 单国栋,宁龙贵,陈文果,等. 外周血CD4+CD25+叉头样转录因子3+在炎症性肠病和肠结核鉴别诊断中的应用价值[J]. 中华消化杂志,2019,39(12):871-873.
[10] 贾敏,刘震,罗义,等. 微小RNA-155和CD4+调节性T细胞与冠状动脉不稳定斑块的关系[J]. 中国心血管杂志,2019,24(3):11-15.
[11] 李罗娜,刘芸,张鸿晨,等. 幽门螺杆菌感染对AOM/DSS诱导的小鼠炎症相关性结直肠癌的影响及免疫机制[J]. 中华医学杂志,2020,100(34):2689-2695.
[12] 何方,高艳,齐海燕,等. 化疗联合PD-1抑制剂一线治疗Lewis肺癌移植瘤的疗效及其调控机体细胞免疫功能的机制[J]. 国际肿瘤学杂志,2019,46(8):453-459.
[13] 李胜利,姜杨,王琰,等. 依鲁替尼对多发性骨髓瘤Treg细胞的影响及相关作用机制[J]. 临床和实验医学杂志,2020,5(17):874-876.
[14] 张勇. 肿瘤微环境中CD4+Foxp3+Treg对鼻咽癌患者预后影响[J]. 中国实验诊断学, 2019,23(10):1723-1727.
[15] Wang K,Song ZL,Wu B,et al. Different phenotypes of CD4+CD25+Foxp3+ regulatory T cells in recipients post liver transplantation[J]. International Immunopharmacology,2019,69(10):194-201.
[16] Vlaho MO,Tomic V,Vukojevic K,et al. CD25+FOXP3+ and CD4+CD25+ cells distribution in decidual departments of women with severe and mild pre〆clampsia:Comparison with healthy pregnancies[J]. American Journal of Reproductive Immunology (New York, N.Y.: 1989),2020,6(8):147-150.
[17] 余杨,付艳丽,卫玮,等. 高危型人乳头瘤病毒载量和调节性T细胞对宫颈癌诊断阈值的确定和意义[J]. 实用医学杂志,2019,35(5):703-708.
[18] Zhang G,Wang Q,Song Y,et al. Intravenous immunoglobulin promotes the proliferation of CD4+CD25+Foxp3+ regulatory T cells and the cytokines secretion in patients with Guillain-Barré syndrome in vitro[J]. Journal of Neuroimmunology,2019,336(18):577 042-577 045.
[19] He R,Li L,Kong Y,et al. Preventing murine transfusion-related acute lung injury by expansion of CD4+CD25+Foxp3+ Tregs using IL-2/anti-IL-2 complexes[J]. Transfusion,2019, 59(2):7878-7879.
[20] 李胜利,姜杨,王琰,等. 依鲁替尼对多发性骨髓瘤Treg细胞的影响及相关作用机制[J]. 临床和实验医学杂志,2020,7(17):850-851.
[21] 易雪,关军,周英,等. CD4+ CD25+ FOXP3+调节性T细胞,黏蛋白1,干扰素-γ水平与多发性骨髓瘤关系的研究[J]. 临床内科杂志,2017,23(34):751-752.
(收稿日期:2021-01-27)

