Tnn基因对小鼠听功能影响的研究△
陆菲 吴玉丽 范贝 刘珍珍 梁鹏飞 李薇 查定军
腱糖蛋白家族是细胞外基质中的一种多功能、表达模式各异的糖蛋白家族[1],由N-末端头区、半胱氨酸域、表皮生长因子(EGF)重复序列、Ⅲ型纤维连接蛋白(FN-Ⅲ)样重复结构、C-末端纤维蛋白原结构组成[2]。家族成员包括腱糖蛋白-C(tenascin-C)、腱糖蛋白-R(tenascin-R)、腱糖蛋白-X(tenascin-X)及腱糖蛋白-W(tenascin-W,TN-W)。Tenascin-W 由TNN基因编码,搜索NCBI数据库,在人类该基因称为TNN,位于常染色体1q23-24。在鼠类称为Tnn,在鱼类为Tnw。研究发现TN-W蛋白,在中枢神经系统中多由神经元细胞表达[3]。在人体多数正常的组织中,TN-W几乎不表达,而在肿瘤组织中显著表达[4]。此外,研究发现TN-W可以促进肿瘤细胞迁移[5,6]、促进血管生成[7]及肿瘤的转移[8],这使得TN-W有可能成为肿瘤间质标记物和抗癌治疗的新靶点。
TN-C 和TN-W可通过N-末端的二硫键形成六臂体结构[1],二者结构在腱糖蛋白家族中最接近,推测其功能相似。TN-C蛋白中某些结构的功能已经实验证实,因而TN-W蛋白潜在的功能可通过目前已发表的研究结果进行预测。TN-W、TN-C的FN-Ⅲ样结构均包含整合素结合位点,可以结合并激活toll样受体4(TLR4)[9],且EGF重复序列几乎相同,后者被证实可以激活EGF受体[10]。二者可以与Wnt3a结合,可能通过调节Wnt经典通路发挥作用[11]。
已有对耳聋家系的研究证实TNC基因的突变可引起常染色体显性遗传性聋,该基因定位于常染色体9q31.3-q34.3,编码TN-C ,其突变引起的耳聋为渐进性听力下降[12]。研究表明TN-C在毒性损伤所致的鸟类前庭器官感觉受体的修复中发挥作用[13],推测其突变可能引起耳蜗内修复功能的异常。前期工作已证实Tnn基因在小鼠耳蜗中有表达,且主要定位于螺旋神经节神经元(spiral ganglion neurons, SGNs)[14],本研究分析Tnn基因敲除后对小鼠听觉功能的影响,初步探讨其在听觉系统中的作用。
1 材料与方法
1.1实验动物及分组 实验用C57BL/6野生型(wild-type,WT)小鼠来源于空军军医大学实验动物中心SPF级动物房,C57BL/6Tnn基因敲除(knock-out, KO)小鼠委托北京百奥赛图公司构建,设计敲除Tnn基因外显子2-4,sgRNAs分别设计在内含子1-2和内含子4-5之间的非保守区中,f1杂合子小鼠与cre-deleter小鼠交配,得到Tnn杂合全敲小鼠(Tnn+/-),将其饲养于空军军医大学SPF级动物房。取出生后1 m、2 m、3 m各阶段WT和Tnn+/-小鼠各8只用于听力检测,另分别取3只野生型P2 m、P3 m小鼠耳蜗制作冰冻切片用于免疫荧光染色。
1.2实验主要试剂 水合氯醛购自上海山浦化工有限公司,2×Taq Mastermix、DNA marker(MD2000)购自中国天根生化科技公司,PCR仪及凝胶成像分析系统购自美国Bio-Rad公司,DPOAE及ABR检测仪购自美国TDT公司。Tnn抗体、免疫荧光二抗抗体购自美国Invitrogen公司,Ⅲ型β-tubulin抗体购自美国Gene Tex公司,DAPI购自北京Solarbio公司。驴血清购自西安晶彩生物科技公司,TnnKO小鼠鉴定引物由擎科泽西生物科技公司合成。免疫荧光抗体稀释液购自上海碧云天生物技术公司。
1.3免疫荧光检测tenascin-W 基于前期已发表的结果[16],tenascin-W在1 m小鼠耳蜗中主要表达于SGNs。此次实验对出生后2月、3月(2 m、3 m)小鼠耳蜗进行取材,方法同前期研究[16]。采用免疫荧光的方法检测小鼠耳蜗中的tenascin-W的表达情况,Ⅲ型β-tubulin标记SGNs。Triton打孔,驴血清37 ℃封闭30 min,一抗4℃孵育3d,二抗4℃孵育1 d,DAPI染核10 min。同时设置PBS空白对照组。
1.4TnnKO小鼠基因型鉴定 将百奥赛图构建的Tnn+/-小鼠放置于空军军医大学SPF级动物房进行繁殖、扩群,Tnn+/-雄鼠与Tnn+/-雌鼠进行交配,新生小鼠于出生后第3天至第7天进行编号,并剪取约2 mm鼠尾进行鉴定。根据公司提供的方法及引物进行小鼠基因型的验证及鉴定,鉴定引物设计如下(表1)。

表1 鼠尾鉴定PCR引物设计序列
鉴定方法如下:剪取鼠尾2 mm放入PCR管中,每管加入180 μl 50 mM的NaOH于PCR仪消化90 min;离心后每管加入20 μl的1 M Tris-HCl,涡轮震荡1 min;配置25 μl PCR反应体系,ddH2O 9.8 μl,2×Taq Mastermix 12.5 μl,正向引物(Forward Primer,FP)0.1 μl,反向引物(Reverse Primer,RP)0.1 μl,DNA模板2.5 μl;PCR反应条件设置:94 ℃预变性4 min 30 s,PCR反应采用三步法,94 ℃变性30 s,60 ℃退火1 min,72 ℃延伸1 min,循环35次。PCR反应完成后将样品离心,于1%琼脂糖凝胶中电泳,电泳仪设置150 V恒压,20 min后于凝胶成像分析系统进行显影。
1.5听性脑干反应(ABR)检测 对不同月龄(1 m、2 m、3 m)的Tnn+/-小鼠与WT小鼠分别进行短声(click)和短纯音ABR检测并进行比较,每个阶段每组至少测8只小鼠。5%水合氯醛于小鼠腹腔注射麻醉后置于双侧隔声屏蔽室恒温板上,参考电极置于颅中线前囟处正中皮下,记录电极置于测试耳耳后皮下,接地电极置于鼠尾根部皮下。以交替短声和短纯音刺激进行检测,由MF1 1172耳机输出,听觉检测仪器滤波范围100~3 000 Hz,叠加1 024次,由功放喇叭输出,耳机距小鼠外耳道口1 cm。刺激声强度为90 dB SPL的短声(频率21次/秒)和短纯音(检测频率4、8、16、24、32 kHz)开始,以10 dB步幅递减,以能正常引出波Ⅰ的最小刺激强度为受试耳的ABR阈值。

2 结果
2.1Tnn基因在2 m、3 m的WT小鼠耳蜗中的表达 高倍镜下(×60)观察2 m、3 m小鼠耳蜗SG,用DAPI染核,Ⅲ型β-tubulin抗体特异性标记SGNs显示目的蛋白与核荧光显示部位不重合,Tnn主要表达于SGNs胞体的胞浆中,PBS空白对照均未显示目的蛋白红色荧光(图1)。

图1 耳蜗冰冻切片荧光染色 显示P2 m、P3 mWT小鼠 螺旋神经节中tenascin-W与Ⅲ型β-tubulin共定位(×60);蓝色荧光为DA-PI,红色荧光为目的蛋白tenascin-W,绿色荧光为Ⅲ型β-tubulin,control为不加tenascin-W抗体的PBS空白对照。bar=20 μm
2.2TnnKO小鼠鉴定结果 因长度为4 433 bp的引物扩增不出,加入Tnn-Mut-5’-F及Tnn-Mut-5’-R这对引物扩增出530的片段即表示含有Tnn突变型等位基因(Mut)。由Tnn-WT-5’-F及Tnn-WT-5’-R引物扩增出308 bp片段即表示含有野生型等位基因(表2)。Tnn+/-雄鼠与雌鼠进行交配,经过一段时间繁殖,新生小鼠中未鉴定出Tnn-/-小鼠,只繁殖出野生型Tnn+/+及全敲杂合Tnn+/-小鼠。

表2 Tnn 突变小鼠鉴定结果
对Tnn+/-雄鼠与Tnn+/-雌鼠交配后的孕鼠,取胚胎期的小鼠进行基因型鉴定,在胚胎期小鼠中仍未鉴定到Tnn-/-小鼠(图2)。

图2 Tnn KO小鼠鼠尾鉴定 电泳结果出现308 bp条带提示含有野生型等位基因,出现530 bp条带提示含Tnn突变型等位基因。图左侧条带为小鼠鼠尾鉴定为野生型(+/+),图中间条带为鉴定结果为Tnn杂合全敲小鼠(+/-),图右侧条带为marker。
2.3Tnn+/-小鼠ABR阈值检测结果 随着小鼠鼠龄的增长,Tnn+/-小鼠与WT型小鼠相比,其click-ABR阈值逐渐升高,在1月、2月龄时阈值无统计学差异,但在3月龄小鼠,各频率反应阈均有差异统计学意义(P<0.01)(表3)。Tnn+/-小鼠的短纯音ABR阈值亦升高,在3月龄时与WT型小鼠相比在4、8、16、24、32 kHz处差异有统计学意义(表4)。

表3 野生型和Tnn+/-小鼠不同月龄click-ABR阈值比较
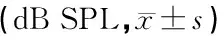
表4 不同月龄WT小鼠和Tnn+/-小鼠各频率短纯音ABR阈值比较
3 讨论
本课题组前期已验证Tnn在不同天龄小鼠(P1、P3、P7、P14、P28)耳蜗中的表达及定位[14],提示tenascin-W在P1至P28的小鼠耳蜗均有表达,在P7及小于P7小鼠目的蛋白弥漫表达于蜗管结构,包括血管纹、Corti器及螺旋神经节;P14、P28时在Corti器不表达,而在螺旋神经节荧光强度仍较强,不同发育时期血管纹处均检测到tenascin-W,且有下降趋势。本研究显示Tnn基因在2 m、3 m小鼠耳蜗中有表达,且主要定位于SGNs中,不与DAPI共染,与前期研究结果一致,亦佐证了文献报道的Tnn多由神经元细胞表达[3]。
目前尚无关于Tnn基因敲除小鼠的特征描述,有研究表明Tnn在肾、脑、脾、小肠、肝脏、骨膜等重要部位均有表达[1,3],推测Tnn在小鼠的正常生长发育中具有重要作用。本实验通过Tnn+/-小鼠的繁殖未得到Tnn-/-小鼠,可能是由于Tnn在小鼠重要部位表达,其表达缺失可导致小鼠胚胎期死亡或胚胎不发育;故选用Tnn+/-小鼠进行后续听觉功能的研究,观察Tnn表达量的下降对听觉的影响。结果显示,Tnn+/-小鼠听力与野生型相比,表现为进行性的听力下降,且在3 m时,click ABR和短纯音ABR反应阈值均升高,差异统计学意义,证实Tnn的异常表达可影响小鼠听觉功能。
Tenascin-C是一个经典的黏附调节蛋白[2]。黏附调节功能可影响细胞运动、增殖及分化。体外研究显示细胞可与tenascin-C结合,但一般不会形成扩散及黏着斑。细胞在加入了纤连蛋白的培养基上会形成黏着斑,但当加入tenascin-C时就会失去这种粘连。Tenascin-W也有作为黏附调节蛋白的潜力。例如,成肌细胞来源的成骨小鼠细胞系C2C12在纤连蛋白培养基中会扩散并形成黏着斑,但在加入tenascin-W的培养基中,C2C12维持星形或圆形的形态,不形成黏着斑或应力纤维;并且C2C12在加入了tenascin-W的纤连蛋白培养基或是纤连蛋白与tenascin-W的混合培养基中,细胞都会维持星形的形状[15]。文献报道tenascin-W的表达量的改变可以引起C2C12细胞(小鼠成肌细胞)黏附功能的异常[1],tenascin-W表达异常可能与细胞黏附功能异常相关。由此推测Tnn表达量下降引起细胞黏附功能异常,导致小鼠听力进行性下降。
有研究通过原位杂交证实Tnn在小鼠海马体神经元中表达,影响海马体神经元的神经突生长及神经元迁移[1],提示Tnn在神经元发育中的潜在作用。SGNs是特异的双极神经元及听觉系统的初级神经元,伸出树突与毛细胞基底部形成突触连接,可激发产生动作电位,将毛细胞的听觉信号传至中枢神经系统[18]。推测Tnn表达异常或可影响SGNs神经突的向外生长及细胞迁移,导致听觉信号的传入受阻,引起听功能受损。
本研究证实Tnn在听觉系统中表达且具有重要作用,其异常表达可引起小鼠听力下降,但机制需进一步的实验证实,未来可通过转录组学或蛋白组学进行相关通路的筛选,对其致聋机制进行更深入、更精准的研究。

