美丽硬仆骨舌鱼Raf激酶基因的克隆、组织表达及原核表达分析
刘 奕,杨叶欣,刘 超,宋红梅,2,汪学杰,牟希东*
(1.中国水产科学研究院 珠江水产研究所/农业农村部休闲渔业重点实验室/广东省现代休闲渔业工程技术研究中心,广东 广州 510380;2.广东省水产动物免疫技术重点实验室,广东 广州 510380)
【研究意义】美丽硬仆骨舌鱼(Scleropages formosus),俗称金龙鱼,隶属于骨舌鱼目(Osteoglossiformes),骨舌鱼科(Osteoglossidae),是世界上昂贵的淡水观赏鱼品种,被誉为“观赏鱼之王”[1]。其古老而珍稀,从化石依据的推断,起源可以追溯到中生代[2],由于过渡捕捞导致濒临绝种,被列入《濒危野生动植物种国际贸易公约》(CITES,简称华盛顿公约)附录I。美丽硬仆骨舌鱼具有进化地位古老、濒危、繁殖力不高,繁殖习性及生理结构特殊、性成熟周期较长的特征[3]。国内外涉及美丽硬仆骨舌鱼研究报道则多数集中在其资源分布[4]、遗传结构[5]和基因组学研究[6-7]等方面,对其基因表达和调控通路方面的研究则极为有限。raf是调控细胞增殖、分泌等生命活动的重要基因,但在骨舌鱼类中该基因的结构特征及功能研究则尚未有报道。【前人研究进展】Raf 激酶是一个高度保守的酶,可激活丝裂原活化蛋白信号通路(mitogen-activated protein kinase,MAPK),也是该通路的重要组成部分[8]。MAPK 信号通路将细胞外受到的刺激传递至细胞内以及细胞核内,是生命体内传导细胞内外信号网络的重要系统之一。该通路以Raf 激酶、MAP 细胞外调节激酶(mitrogen-activated protein extracellular regulated kinase,MEK)和细胞外调节蛋白激酶(extracellular regulated protein kinases,ERK)为主干,在真核生物体内较为广泛的表达,参与调节基因表达、细胞增殖、细胞代谢、细胞凋亡和免疫反应等多种重要的细胞生命活动[9]。Raf 激酶则调控细胞增殖、分泌和运动等,在调节该信号通路方面起着重要的作用[10]。在对稀有鮈鲫(Gobiocypris rarus)的研究中发现raf基因在性腺和肝中表达量最高[11]。在杂交鳢(Channa maculata♀×Channa argus ♂)的免疫相关组织脾脏、胸腺和头肾中,raf有较高的表达量,证实其在自身免疫系统发育中起到重要作用[12]。【本研究切入点】2015 年Austin 等[13]最先完成美丽硬仆骨舌鱼全基因组测序。2016 年,Bian 等[6]也完成了美丽硬仆骨舌鱼的基因组测序,并且组装质量得到了改善。Shen 等[14]构建了美丽硬仆骨舌鱼第一张遗传连锁图谱,并完成了性腺和脑的转录组测序。以上研究为美丽硬仆骨舌鱼功能基因的研究提供了条件。【拟解决的关键问题】本研究从raf的克隆和表达分析入手,探讨美丽硬仆骨舌鱼raf基因的结构和组织表达特征,构建原核表达载体并在大肠杆菌中诱导出融合蛋白,为进一步研究raf在美丽硬仆骨舌鱼体内的生物功能奠定基础。
1 材料与方法
1.1 试验材料
试验用美丽硬仆骨舌鱼采自国家淡水水产种质资源库珠江分库,是以2009 年珠江水产研究所从马来西亚引进个体为原代亲本,于2017 年自繁所得的F2 代。根据组织切片方法鉴定性别,选取性腺发育Ⅲ期的美丽硬仆骨舌鱼6 尾(3 雌3 雄)。雌性体质量(807.78±4.57)g,全长(38.07±1.73)cm;雄性体质量(900.83±5.92)g,全长(42.25±1.91)cm。
1.2 试验方法
1.2.1 总RNA 的提取及cDNA 第一链的合成 用Total RNA KitⅡ(OMEGA)RNA 提取试剂盒分别提取美丽硬仆骨舌鱼性腺、肝、脾、肾、鳃、心、头肾、脑等8 种组织总RNA,用BioTek Cytation™5 多功能酶标仪测定总RNA 浓度和纯度,以及10 g/L 琼脂糖电泳检测总RNA 完整性。各取1 ng RNA 运用Prime-ScriptTMⅡ1stStrand cDNA Synthesis Kit(TaKaRa)反转录试剂盒,进行反转录,获得cDNA 第一链,-20 ℃保存备用。
1.2.2 基因克隆 取美丽硬仆骨舌鱼精巢组织提取的总RNA,反转录获得cDNA。参考美丽硬仆骨舌鱼基因组序列设计raf基因中间序列扩增序列引物raf-F1/R1(表1)。PCR 反应体系(25 μL):ddH2O 18.9 μL,10×Buffer 2.5 μL,dNTPs(2.5 mmol/L)2 μL,上下游引物(10 μmol/L)各0.4 μL,cDNA模板0.6 μL,TaqE 0.2 μL。PCR 条件为:95 ℃预变性5 min;95 ℃变性30 s,55 ℃退火30 s,72 ℃延伸90 s,30 个循环;72 ℃延伸10 min。PCR 产物用10 g/L 的琼脂糖凝胶电泳分离,经TIANgel Midi Purification Kit 琼脂糖凝胶DNA 回收试剂盒回收,连接pMD19-T Vector 载体,转化E.coliDH5α 感受态细胞,筛选阳性克隆测序。
根据测序结果设计5'RACE 和3'RACE 巢式PCR 引物raf-5'-1、raf-5'-2 与raf-3'-1、raf-3'-2(表1),用SMARTerT M RACE cDNA Amplification Kit 扩增raf的5'端和3'端序列,并测序。将中间扩增序列、5'端和3'端序列经Vector NTI软件拼接,获得完整的美丽硬仆骨舌鱼rafcDNA全序列(图1)。

图1 美丽硬仆骨舌鱼raf基因cDNA序列及其推导蛋白序列Fig.1 The cDNA sequence of raf gene and deduced protein sequence

表1 研究中所用的引物序列Tab.1 Primers used in experiments
1.2.3 基因序列分析 运用Vector NTI 查找raf基因的开放阅读框(ORF),并推导出氨基酸序列。用Prot Param(http://web.expasy.org/protparam/)软件在线分析蛋白质理化性质;用TMHMM(http://www.cbs.dtu.dk/services/TMHMM-2.0/)预测跨膜区结构;用Phyre2(http://www.sbg.bio.ic.ac.uk/phyre2/html/page.cgi?id=index)软件进行蛋白质二级和三级结构预测;用ProtScale(http://web.expasy.org/protscale/)软件分析亲疏水性;用SignalP(http://www.cbs.dtu.dk/services/SignalP)软件分析信号肽;运用TMpred(http://www.ch.embnet.org/software/TMPRED_form.html)进行蛋白质跨膜结构预测;用NetPhos 2.0 Server软件进行磷酸化分析(http://www.cbs.dtu.dk/services/NetPhos-2.0/);运用SMART 软件进行结构域分析(http://smart.emblheidelberg.de/);用ClustalX1.83 软件进行氨基酸序列多序列比对,并用MAGE 5.2 软件构建系统进化树(表2)。

表2 用于构建系统进化树的物种Tab.2 Species used to construct phylogenetic trees
1.2.4 组织表达 选用美丽硬仆骨舌鱼GAPDH 作为内参基因,参考Pan等[15]发表的引物序列合成引物。根据克隆所得的rafcDNA 全序列设计一对荧光定量PCR(qRT-PCR)引物raf-F2 和raf-R2(表1)。分别将以上2 对引物的PCR 扩增产物连接到pMD19-T Vector 并转入E.coliDH5α 感受细胞中,挑取阳性克隆进行扩培,然后用TIANprep Mini Plasmid Kit提取质粒。
用BioTek Cytation™5 多功能酶标仪测定质粒浓度,然后对其以10 倍梯度稀释,共设12 个梯度。用QuantStudio6 Flex 仪器制作标准曲线,若R2>0.99,斜率在-3.0~-3.6,则说明标准曲线制作合格。qRTPCR 体系共20 μL,包括10 μL SYBR Green Master Mix,1 μL cDNA,8 μL ddH2O,各0.5 μL 上下游引物(10 μmol/L)。反应条件:50 ℃2 min;95 ℃5 min;95 ℃15 s,55 ℃30 s,72 ℃30 s,40 个循环;溶酶曲线:95 ℃,15 s;60 ℃,2 min;95 ℃,15 s;每个样品重复3 次。用QuantStudioTM Real-Time PCR Solftware v1.2软件计算每个样品的目的基因和内参基因扩增后的拷贝数(Qty),各样品的目的基因和内参基因Qty 值之比即为目的基因相对定量值。用Excel 作图,试验数据统计分析用SPSS 20 软件进行单因素方差分析法(One-Way ANOVA)和Duncan多重比较分析显著性差异。
1.2.5 原核表达载体的构建及重组蛋白诱导表达 选取同源区域相对较少的前297 个氨基酸区段制备抗原(预测分子量为33.2 ku),上游引物raf-F:5'-CGGACCG-ATGTCCCCGACCGTTGGCC-3',下游引物raf-R:5'-GCGGCCGCCTTGTCCCTCGGTCTA-ATT-3'。其中在该对引物的5'端分别加入RsrII和NotI酶切位点(下划线标注)。反应条件为94 ℃预变性4 min;94 ℃30 s、55 ℃30 s、72 ℃1 min,共30 个循环;72 ℃延伸10 min。PCR产物经胶回收纯化后,与pET-B2m载体分别经过RsrII和NotI双酶切(37 ℃,2 h),然后放置恒温金属浴仪器中16 ℃连接过夜。次日将连接产物转化至大肠杆菌DH5α,阳性克隆菌落进行双酶切鉴定和测序(广州艾基),经序列比对后确定插入片段为正确序列,将阳性菌落扩大培养,用质粒提取试剂盒(北京天根)抽提重组质粒(pET-B2m-raf)。
将构建成功的重组质粒转化BL21(DE3)感受态细胞,涂布含有Amp+(100 μg/mL)的LB 固体培养基上,挑取单个菌落,接种至含有Amp+(100 μg/mL)的液体LB 培养基中,37 ℃振荡过夜培养,次日按1∶50扩大培养,37 ℃培养至OD600=0.4~0.6,加0.1 mmol/L IPTG,30 ℃诱导表达4 h。菌液经8 000 r/min、4 ℃离心5 min,收集菌体。添加100 mL 破碎液在冰浴条件下进行超声波裂解。裂解条件:功率60%、超声2 s、间隔2 s、时间15 min。12 000 r/min、4 ℃离心15 min,收集上清和沉淀进行SDS-PAGE 分析,经考马斯亮R-250染色,脱色观察结果。
2 结果与分析
2.1 美丽硬仆骨舌鱼raf基因的克隆及序列分析
用VectorNTI 软件拼接得到rafcDNA 全序列为3 734 bp,ORF 为1 827 bp,共编码609 个氨基酸。序列两端分别存在1 110 bp 的5'非编码区(untraslated region,UTR)和797 bp 的3'UTR,且3'端含有典型的poly(A)尾(图1)。经ProtParam 和ProtScale 软件预测该基因的蛋白分子量为68.8 ku,等电点PI 为9.45,分子式为C3046H4822N870O881S34,亲水性平均系数为-0.409,说明其亲水性较强。
2.2 raf编码氨基酸序列生物信息学分析
2.2.1 信号肽与跨膜区域分析 用SignalP 4.1 软件分析结果显示,该序列信号肽区域分值(S)为0.117,信号肽剪切位点分值(C)为0.141,剪切位点分值(Y)为0.120,meanS和D分别为0.097、0.108,低于临界值0.450,表明该蛋白不存在信号肽。经TMHMM 软件分析表明,该序列含有1 个跨膜螺旋结构,是由膜外向膜内的跨膜螺旋,位于第312至332位氨基酸之间,说明该蛋白为跨膜蛋白。
2.2.2 磷酸化位点分析 用NetNGlyc 1.0 软件分析发现该序列不存在潜在的糖基化位点。用NetPhos 2.0 软件分析表明该序列共含有47 个磷酸化位点,其中32 个丝氨酸(Ser),13 个苏氨酸(Thr)和2 个酪氨酸(Tyr)磷酸化位点。
2.2.3 结构域分析 用Smart 软件分析显示该基因编码蛋白序列含有:1 个Ras 结合域(Ras-binding domain,RBD),该结合域包含76 个氨基酸;1 个蛋白激酶C 保守区(C1)结构域(Protein kinase C conserved region 1(C1)domains),共46个氨基酸;1个低合成复杂度区域,共12个氨基酸;1个丝氨酸/苏氨酸蛋白激酶催化结构域(Serine/Threonine protein kinases,catalytic domain),该结构域共258个氨基酸(图2)。

图2 美丽硬仆骨舌鱼raf基因编码蛋白质序列保守域Fig.2 The raf gene of S.formosus encodes conserved domains of protein sequences
2.2.4 蛋白质二级结构三级结构预测 通过Phyre2软件预测蛋白质二级结构发现,raf编码蛋白由α-螺旋,β-折叠、无规则卷曲和跨膜螺旋构成,分别占26%、15%、43%和3%。预测所得蛋白质三级结构显示该蛋白符合丝氨酸/苏氨酸-蛋白激酶b-raf 的结构特征,预测的可信度为100%。结合口袋是指蛋白质与其它分子作用的区域,位于第545位到第567位氨基酸之间(图3)。
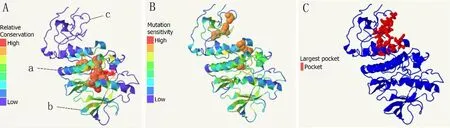
图3 美丽硬仆骨舌鱼raf编码蛋白的三级结构预测Fig.3 S.formosus raf encoded amino acid sequence secondary structure and tertiary structure
2.3 raf基因编码氨基酸序列的同源性和系统进化分析
用ClustalX1.83 软件将美丽硬仆骨舌鱼raf基因编码氨基酸序列与GenBank 中收录的其他一物种同源蛋白序列进行比对分析,发现美丽硬仆骨舌鱼raf氨基酸序列保守性较高,在所比对的序列中,除斑马鱼(78.36%)外,与其他鱼类序列的相似性都高于80%。美丽硬仆骨舌鱼raf氨基酸序列与雀鳝相似度最高,达到84.28%;而与北美绿蜥蜴、智人和小家鼠的相似度分别是77.59%、77.01%和76.08%,而与果蝇的相似度最低,为37.90%(图4)。
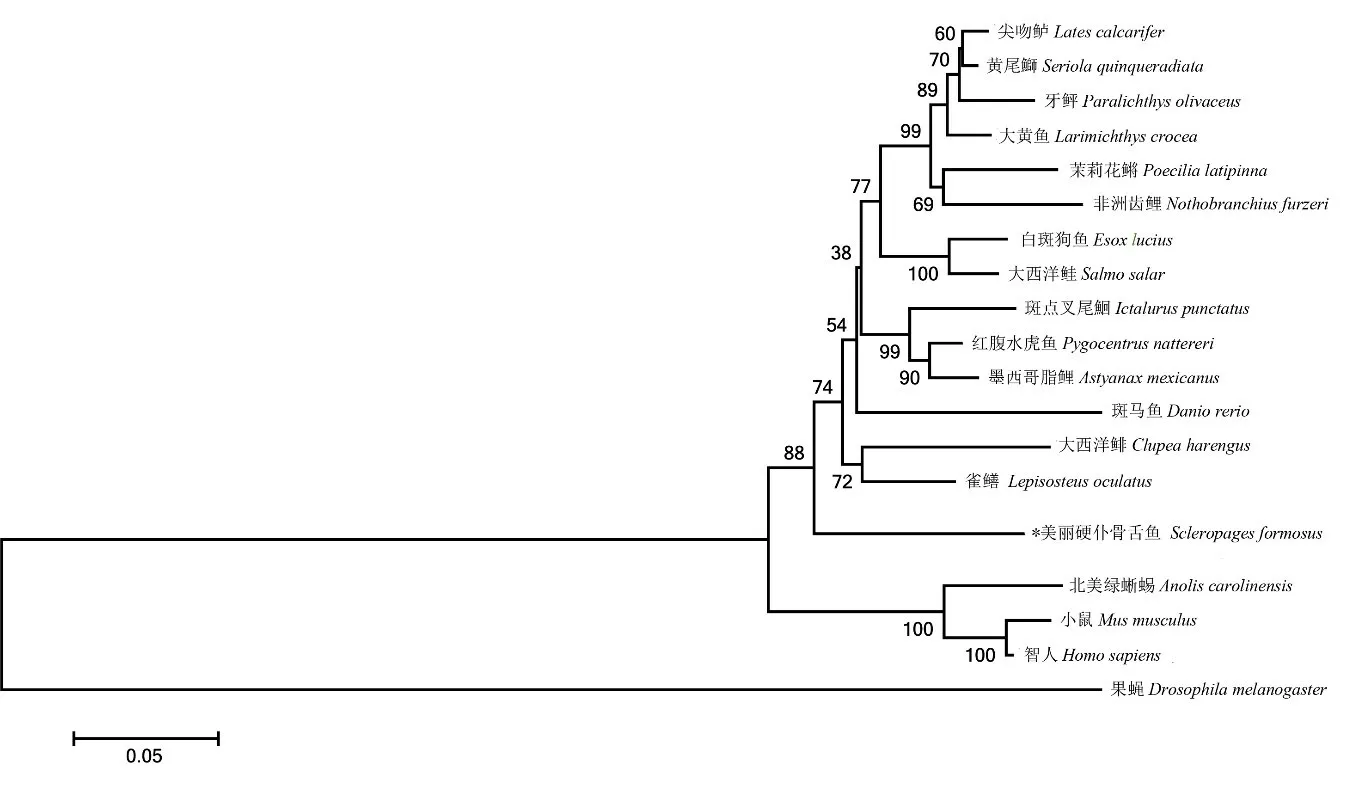
图4 基于raf编码氨基酸序列构建进化树Fig.4 Phylogenetic tree constructed based on raf gene coding amino acid sequence
2.4 raf在不同性别、不同组织内的表达水平分析
运用荧光定量PCR 方法检测美丽硬仆骨舌鱼raf在8 个不同组织表达水平分析见图5。raf在8个组织中均有表达,其中在肝中表达水平最高,其次是性腺、头肾和脾,脑中的表达量最低。在雄性个体中精巢、肝、头肾和脾组织的raf表达量显著高于鳃、肾、心和脑组织(P<0.05)。在雌性个体中,肝raf表达量最高,其次是头肾和脾,肝中raf表达量显著高于卵巢、鳃、肾、心、和脑组织(P<0.05)。将雌雄鱼相同组织raf表达量进行差异显著性分析发现,雄鱼的精巢显著高于雌鱼的卵巢(P<0.05),而其他7个组织则均无性别显著差异(P>0.05)。

图5 美丽硬仆骨舌鱼不同组织raf相对表达水平Fig.5 Relative expression levels of raf in different tissues of S.formosus
2.5 美丽硬仆骨舌鱼raf基因的原核表达分析
重组的pET-B2m-raf 原核表达载体经测序和序列比对确认未出现移码现象和碱基突变,表明表达载体构建成功。将重组质粒转化至BL21(DE3)、表达感受态细胞中,在经IPTG进行诱导表达后,得到分子量约为49 ku的重组蛋白。预测目的蛋白分子量33.2 ku,表达载体约14.6 ku,重组蛋白分子量为目的蛋白(33.2 ku)与表达载体(14.6 ku)分子量相加,所得结果与预期相符。经SDS-PAGE 检测结果显示,上清液中无相应条带出现,表明在该载体的表达体系中重组蛋白的表达形式为包涵体形式存在(图6)。
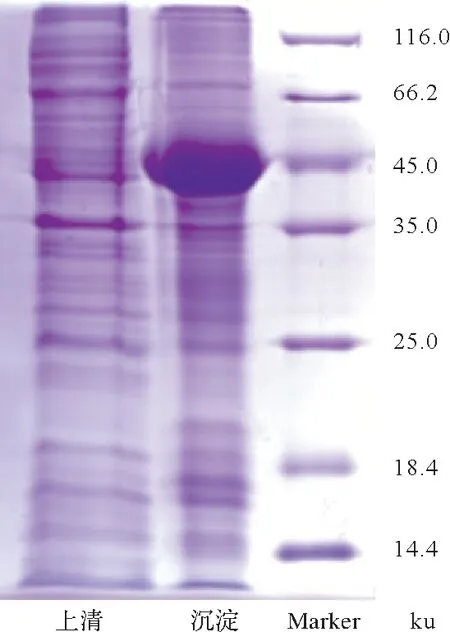
图6 美丽硬仆骨舌鱼raf氨基酸在大肠杆菌中的重组表达Fig.6 Expression of S.formosus raf in E.coli
3 讨论
Raf 激酶是高度保守的酶,活化的Raf 通过将MEK 和ERK 级联激活,进而磷酸化相应的底物,实现细胞增殖和分化、适应环境应激以及细胞凋亡[16]。Raf 激酶的激活机制与磷酸化关系密切,哺乳动物Raf 是通过丝/苏氨酸在胞膜上被磷酸化从而被激活[17],本研究发现美丽硬仆骨舌鱼raf基因含有丝氨酸、苏氨酸和酪氨酸磷酸化位点,并且预测的三级结构与哺乳动物一致,推测美丽硬仆骨舌鱼raf与哺乳动物的功能类似。
物种的氨基酸序列比对结果显示,除斑马鱼(78.36%)外,美丽硬仆骨舌鱼与文中所用其他鱼类序列的相似性都高于80%,说明美丽硬仆骨舌鱼raf蛋白序列保守性较高。雀鳝与美丽硬仆骨舌鱼,都是辐鳍鱼类中较早分化出来的物种,属于进化地位古老的物种[13],本研究中美丽硬仆骨舌鱼raf氨基酸序列与雀鳝的相似度最高,为84.28%,这也与两种鱼类的进化关系相符。
王妙等[11]在对稀有鮈鲫的研究中发现,raf基因在雌性肝脏和卵巢中的表达量最高,在鳃、肾脏和脑中表达量较低,而在雄鱼中,raf基因在精巢中表达量最高,且精巢表达量远高于卵巢。这与本研究中raf在美丽硬仆骨舌鱼中表达量结果相似,推测raf基因在鱼类中的功能比较保守。有研究表明,精巢中精子的产生是由卵泡刺激素和睾酮调节的,从而向体细胞支持细胞发出信号,以产生维持发育中的精子生存和成熟所需的因子[18]。睾酮通过激活Src 激酶和表皮生长因子受体(EGFR),启动MAPK 级联激酶(RAF,MAPK,ERK)的转录调控,从而发挥作用[19-20]。Raf 激酶同时也是支持细胞中卵泡刺激素的靶点[21]。raf在美丽硬仆骨舌鱼精巢中的表达量显著高于卵巢,推测其可能参与精巢的发育和精子的发生,并且在精巢中支持细胞固定及精子释放的调节过程中发挥作用。
有研究表明,Raf 激酶及其下游转录因子被激活后可促进细胞DNA 合成和细胞增殖,进而参与调控肝脏再生[22]。而抑制Raf 激酶则会抑制肝星状细胞的迁移[23],从而调控肝脏的形态发育和免疫机能[24],所以推测raf在美丽硬仆骨舌鱼肝中表达量较高可能与肝细胞发育及免疫功能有关。本研究发现在美丽硬仆骨舌鱼脾和头肾组织也有较高的raf表达。脾脏和头肾是鱼类重要的造血器官和免疫器官[25]。Riegel 等[8]发现Raf 激酶在具有免疫功能的树突细胞分化时一直保持活化状态,而抑制Raf 激酶则会削弱树突细胞的激活从而无法激活T 细胞,且T 细胞激活和增殖也需要Raf 激酶的直接参与。本实验中,肝、脾和头肾中raf的表达说明其在美丽硬仆骨舌鱼机体的免疫应答过程中可能也起到一定的作用。
原核表达所选用的pET-B2m 表达载体是目前应用的成熟载体pET 系列表达系统之一。pET-B2m是在pET-28a(+)中插入了一个β2-微球蛋白基因,可促进外源基因的表达[26]。本研究中获得的融合蛋白是以包涵体形式存在,有研究表明包涵体中的大部分蛋白质是有功能的,不需要溶解和重新折叠[27],但后续研究还将尝试通过优化条件或在载体上添加助溶标签来诱导可溶性蛋白。
本研究克隆得到美丽硬仆骨舌鱼raf基因的cDNA 全序列,了解了raf基因的组织表达特征,构建原核表达载体并进行诱导表达,获得了重组蛋白,为下一步制备抗体,筛选所调控的下游基因,探究美丽硬仆骨舌鱼raf基因的调控机制奠定基础。

