X线立体定位真空辅助活检术对可疑乳腺钙化灶的应用价值
石剑 魏建南 曾圣光 何健龙 谢娜 郑爱秋 杨勇
成簇的可疑微钙化是乳腺癌的早期影像征象,尤其是导管原位癌(ductal carcinoma in situ,DCIS)和癌前病变-非典型导管上皮增生(atypical ductal hyperplasia,ADH)。近1/2临床不可扪及的乳腺癌都与钙化有关[1]。约55%的孤立微钙化是在筛查性乳房X线摄片中发现的[2],而且大多数微钙化在超声检查中不易被发现。目前,对乳腺微钙化主要采用美国放射学会(American College of Radiology,ACR)的乳腺影像报告与数据系统(breast imaging reporting and data System,BIRADS)进行描述与评价[3]。对于BI-RADS 4~5级的可疑恶性钙化均需进一步活检明确病理性质。仅在乳房X线摄片检查中发现的病灶需要立体定位引导进行活检,而真空辅助活检(stereotactic vacuum-assisted biopsy,SVAB)是目前最佳的立体定位活检方法,其特点是检出率高、样本质量高、假阴性率低[4]。由于立体定位设备和活检系统及耗材价格昂贵,目前国内开展SVAB的医院仍较少,大部分仍采用传统导丝定位手术切检或立体定位空芯针穿刺活检(stereotactic core needle biopsy,SCNB)。本研究回顾分析SVAB在女性可疑乳腺钙化灶微创诊疗中的应用价值,为今后开展SVAB以及术后决策提供参考。
资料与方法
一、研究对象
2015年12月至2019年12月,我科共收治了518位临床触诊阴性、超声检查未提示可疑钙化,而乳房X线摄片提示钙化级别为BI-RADS 4A、4B、4C及5级且接受了SVAB手术的女性患者。其中4A级441例,4B级99例,4C级17例,5级1例。中位年龄45岁(22~81岁)。纳入标准:(1)按照ACR 2013年第5版的BI-RADS标准,可疑钙化可进一步细分为4A低度恶性怀疑2%~10%;4B中度恶性怀疑10%~50%(即钙化形态符合模糊无定形、粗糙不均匀、细小多形性钙化);4C更进一步恶性怀疑50%~95%(即细线样或细小分支样钙化);5级高度恶性怀疑≥95%。由2位高年资放射科医生共同阅片进行描述与评价。(2)患者无明显心脑血管及椎体疾病,能够耐受俯卧式定位活检。(3)术前检查无明确手术禁忌症,术前均签署知情同意书。排除标准:(1)有出血倾向、凝血功能障碍或严重的心脑血管等原发性疾病;(2)患者机体受限不能俯卧并贴近床面;(3)钙化灶位于乳房深面紧邻胸大肌或乳房植入物表面。
二、方法
立体定位采用俯卧式定位系统(Multicare Platinum,美国Hologic公司),活检采用针径为9G、刀槽长度为12 mm的真空辅助活检系统(型号ATEC0912-12,Suros ATEC,美国 Hologic公司)。所有SVAB手术均在局麻下进行。取俯卧位,调整乳房位置将目标病灶区域置于活检窗内。图1~5为1例51岁的女性患者,钼靶提示左乳外上簇状无定形及点状钙化,BI-RADS为4A,活检病理为浸润性导管癌(IDC),2级,5 mm;高级别导管原位癌(DCIS)。首先利用0°导航位和±15°立体定向摄片(图1A),确定病灶的X-Y-Z坐标后,进行准确的参数计算。计算结果表明手术可行行局部麻醉(2%的利多卡因5~10 mL),并将活检针刺入乳房。针尖距目标位Z点6 mm处,进行弹射击发(图2)。再次±15°摄片,确定病灶相对于活检针的位置。然后从该位置进行组织提取,必要时进行360°旋转取材(图3)。所有病灶均于术中即刻使用标本摄片系统(Trident,美国Hologic公司)进行样本摄片确认,手术取样需满足至少两条标本且含有≥ 5个钙化点(图4)。完成活检后,活检残腔位置留置肿瘤组织标记定位钛夹,摄片并确认标记夹位置(图5)。术后弹力绷带加压包扎。标本组织条登记后送术后病理检查。单侧多灶病例活检均在完成第一目标活检后退出活检针,调至下一目标Z点参数再次穿刺活检。双侧病例均为完成一侧活检后,弹力绷带加压包扎24 h后再行对侧活检。

图1 可疑钙化灶立体定位
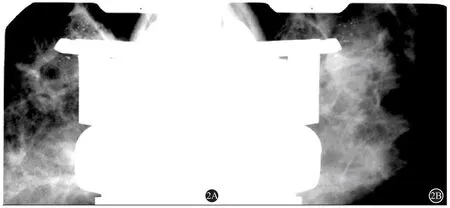
图2 ATEC击发后与钙化空间位置情况

图3 SVAB360°旋切后残余钙化情况

图4 活检标本情况

图5 钙化完全切取术后
三、病理诊断后的处理
病理诊断为乳腺癌,则限期行根治性手术;癌前病变ADH,择期行钢丝定位局部扩大切除手术;除ADH外的良性病变,结束治疗。如二次术后病理发现DCIS升级为浸润性癌(invasive ductal carcinoma,IDC),或ADH升级为DCIS或IDC则视为组织学低估[5]。术后6个月进行第一次超声和钼靶复查,1年后每年一次超声和钼靶检查,若随访过程中出现可疑病灶则再次进行活检。
四、统计方法
两组分类资料率的比较采用卡方检验或Fisher确切概率法,P<0.05为差异有统计学意义,统计分析采用SPSS 26.0软件。
结 果
2015年12月至2019年12月,共524位可疑钙化女性患者纳入本研究。4名患者术前立体定位摄片未能发现外院体检钼靶所提示4a类模糊不均质钙化灶,取消活检,随后6个月随访观察。2名患者的可疑钙化灶位置过深,1例紧邻胸大肌,另1例紧邻乳房假体,均接受了导丝定位手术切检。共518位患者成功完成SVAB手术,中位年龄45岁(22~81岁)。其中双侧病例40人,共完成558例活检(左乳275例,右乳283例),活检病灶618个。病灶主要集中于外上象限238/558(42.7%)、乳房上方76/558(13.6%)、外侧43/558(7.7%)及中央区33/558(6.0%)。单侧单发病灶活检496/558(88.9%),单侧多发病灶活检62/558(11.1%)。立体定位时中位乳房压迫厚度40.5 mm(14.6~68.9 mm),其中<27 mm的小乳房35例。钙化灶范围最大径中位值11.6 mm(1~95 mm),中位手术时间26 min(5~78 min),中位随访时间38个月(15~63个月)。特殊病例情况:1例为左乳4处病灶分布于外上、外下两个象限进行活检;6例有假体置入隆乳史;11例有奥美定注射隆乳史。
并发症情况:术中出血及快速血肿形成7/558(1.3%),予以局部加压和使用旋切活检系统LAVAGE功能键进行1∶200 000肾上腺素盐水术腔灌洗抽吸止血,均顺利完成手术。皮肤破损2/558(0.4%),因钙化均位于乳晕区腺体浅层,负压旋切所致近1 cm皮肤破损。予以5-0普理灵缝线间断缝合,1周后拆线,切口愈合良好。术后皮肤瘀斑12/558(2.2%),术后血肿形成19/558(3.4%),术后3~4周均可吸收。
SVAB术后病理情况:(1)乳腺癌74/558(13.3%),其中DCIS 59例,DCIS伴局灶IDC 7例,IDC 7例,浸润性微乳头状癌1例。接受保乳手术30/74(40.5%),全乳切除术43/74(58.1%),1例76岁老年女性患者诊断DCIS后拒绝接受根治性手术治疗1/74(1.4%)。组织学低估4/58(6.9%),58例DCIS二次术后4例升级为IDC。其中中-高级别DCIS升级IDC(2.5 mm)1例;高级别DCIS升级IDC(0.01 mm,0.7 mm,<1 mm)3例。(2)ADH 45/558(8.1%),均接受局部扩大切除手术。组织学低估1/45(2.2%),1例ADH二次术后升级为小管癌(2 mm)伴多灶ADH。(3)其他良性病理:导管内乳头状瘤17/558(3.0%)、错构瘤2/558(0.4%)、纤维腺瘤74/558(13.3%)、旺炽性增生 10/558(1.8%)、腺病86/558(15.4%)、纤维囊性乳腺病197/558(35.3%)、导管上皮增生42/558(7.5%)、注射材料异物反应11/558(2.0%)。
不同钙化临床特征与病理相关性见表1。BIRADS 4A、4B、4C、5级的阳性预测值(positive predictive value,PPV) 分 别 为46/441(10.4%)、18/99(18.2%)、9/17(52.9%)、1/1(100%),4 个危险程度分级之间的PPV值差异有统计学意义(P=0.000),恶性占比与BI-RADS评估标准相符。

表1 钙化临床特征与病理相关性[SVAB(n=558)]
讨 论
SVAB具有定位准、切口小、创伤小、标本量大等优点,是乳腺微钙化活检的首选方法[6]。然而,因定位设备条件限制,目前国内多数医疗单位仍采用传统导丝定位开放手术切除活检或SCNB。导丝定位切除活检历来是传统诊断乳腺微钙化的金标准,定位支架配套普通钼靶机均可以在基层医院开展。但既往研究发现,63.2%的微钙化开放术后病理结果为良性。而且切取组织标本量大,为病理医生准确找寻微钙化进行取材诊断造成了困扰。开放手术的同时也增加了患者生理和心理的创伤,影响了乳房的外观[7]。SCNB常选用14G的活检针,优点是活检枪及活检针轻便,穿刺点小,约1.6~2.0 mm;缺点是每次击发伴有弹射声响,且需拔除活检枪取材后再次插入乳房才可以进行下一条组织活检,不能连续取材,增加了患者的心理负担。而且对于致密型乳腺活检存在取材不足的缺点。SVAB通常选用11G、10G、9G、8G等4种规格的真空负压活检针,而且可以通过主机设备对活检负压进行调节,大大减少了组织致密对活检手术的影响。Park等[8]对14G、11G和8G的活检针单次活检手术取材的标本量进行了对比,14G活检针可取材约17 mg样本,11G可取材(83~116 mg)样本,8G可取材(250~310 mg)样本。SVAB较SCNB取材量大,对于≤1.5 cm大小范围钙化组织可以完全切除。SVAB与传统导丝定位切除活检手术相比的主要缺点是组织学低估。Safioleas等[9]通过使用11G Mammoto-me活检系统对853例钙化灶行SVAB,二次术后病理显示ADH的低估率为3.22%,DCIS为7.69%。本研究中ADH低估率2.2%,DCIS为6.9%。较低的低估率可归因于我们使用了更粗的9G活检针,可以获得较大的切除组织体积。Shozo等[10]也建议切除更多钙化组织样本来提高SVAB的准确性。
本研究中,SVAB诊断ADH 45/558(8.1%),1例ADH二次术后升级为小管癌(2 mm)伴多灶ADH。是否所有经SVAB诊断为ADH的患者都应行局部扩大切除术一直存在着争议[11-12]。Youn等[13]回顾性分析了27名因可疑微钙化行SVAB后诊断为ADH的病例,有9人二次术后诊断升级为DCIS,低估率为33.3%(9/27);35.3%(6/17)有钙化残留的患者升级为DCIS;30%(3/10)无钙化残留的患者升级为DCIS。因此,他建议所有经SVAB诊断的ADH患者无论是否存在残留的微钙化都应该行再次切除。但该研究的局限性主要在于样本量较小。Esen等[14]通过对198例行SVAB手术的患者进行研究发现,无钙化残留的患者可以通过规律的乳房X线摄片进行随访,而不是进一步的手术切除。在SVAB术后对该组患者进行中位随访27.5个月,影像评估均未见可疑改变。而且诊断ADH病变二次术后升级为DCIS的组织学低估率为10.5%,也远低于Youn的研究结果。Rageth等[15]也回顾性分析了207例钙化活检的病例,56例行空芯针穿刺活检(core needle biopsy,CNB),151例行真空辅助活检(vacuum-assisted biopsy,VAB)。所有病理切片均重新分析ADH相关钙化的存在与否、其他恶性潜能不确定的病变、病变大小和多灶性。结果全组总低估率为39%(CNB为57%,VAB为33%)。在变量分析中,活检方法(CNB vs VAB,P=0.002)和VAB标本中的多灶性(P=0.0176)是造成低估的重要危险因素。所以,诊断ADH后如何做出临床决策,还应参考这些组织学参数。
既往对于多灶可疑钙化和> 5 cm以上大范围钙化如何进行SVAB,鲜有报道。本研究中有62例为≥ 2处可疑钙化的活检,恶性检出率6/62(9.7%)。同一侧SVAB术后不同病灶病理有11/62(17.7%)的差异。Chang等[16]研究发现在形态相似的钙化部位之间有近20%的组织病理学差异,如果只活检一个部位发现病理恶性,对其他钙化部位仍需进行活检。即使其中一个部位活检的病理结果是良性的,其他部位的活检可能仍然是必要的。然而对于15例> 5 cm的大范围钙化活检,我们选取中央最密集区域和前后缘共分三段进行活检,恶性检出率6/15(40.0%),三段病灶病理均未见组织学差异。Raj等[17]通过对32例>5 cm的可疑钙化前后缘进行活检分析,病理符合率100%。因此,他建议对于5 cm以上的节段样钙化,仅需行一个位置活检,避免为患者带来不必要的损伤和经济负担。
SVAB常见的并发症有术中出血及快速血肿形成、皮肤瘀斑、术后血肿等,术后3~4周均可吸收。在我们的研究中,有2例活检因钙化均位于乳晕区腺体浅层,负压旋切致皮肤破损,予以间断缝合,术后1周拆线,切口愈合良好;未见SVAB术后感染病例。Li等[18]采用11G的麦默通活检系统对587例患者进行SVAB,血肿发生率为2.4%,血管迷走神经反射1例,予以休息、进食后缓解。均无严重不良事件发生。
本研究存在以下局限性:(1)这是一项单中心的回顾性研究,因此不能排除来自本中心的偏倚;(2)多灶和大范围钙化的病例样本量仍较小,如何对多灶钙化和大范围钙化进行必要性活检取材仍需要更大样本来验证;(3)没有进一步干预的高风险良性病变如导管内乳头状瘤、旺炽性增生等病例随访时间有限,在这种情况下,我们可能会在更长的随访期间观察到恶性肿瘤的出现。
总之,本研究证实了SVAB是一种安全、微创的评估和治疗可疑乳腺钙化灶的手段,避免了绝大多数患者接受不必要的开放手术治疗,值得进一步推广。

