二乙醇胺强化胶球藻Coccomyxa subellipsoidea C-169固定CO2和积累油脂
邹帅,李玉芹,马怡然,齐振华,贾权威
(湘潭大学化工学院,湖南 湘潭 411105)
微藻具有生长周期短、环境适应性强及光合作用效率高等优势,能通过光合作用将CO2转化成糖类、油脂和蛋白质等有机物,而油脂是炼制生物柴油的理想原料,因而利用微藻高效固定CO2和积累油脂是一种兼具碳生物减排及生产可再生能源双赢的有效手段[1-2]。但目前这一技术工业化应用较为困难,其主要原因是CO2在微藻培养体系中吸收传质效率较低,限制了微藻高效固定CO2和积累油脂[3]。

极地胶球藻Cocccomyxa subellipoideaC-169 是非运动型单细胞绿藻,在适宜条件下可积累58%干重的甘油三酯,全基因组测序已完成,是碳生物减排和生物柴油开发的优良藻株[12]。然而,利用胺类物质强化胶球藻细胞固定CO2和积累油脂鲜有报道。本研究旨在考察二乙醇胺对胶球藻生长、固定CO2和积累油脂的影响,确定二乙醇胺最佳作用浓度范围和胶球藻最佳固定CO2和积累油脂条件,以期为工业化大规模微藻CO2生物减排及可再生能源开发提供新思路。
1 材料和方法
1.1 藻株
胶球藻Cocccomyxa subellipsoideaC-169 为湘潭大学生物食品系藻菌资源开发与利用实验室保藏菌株。
1.2 胶球藻培养
挑取单菌落藻细胞接入改良Basal 培养基[13],在(28±1)℃,光照强度3000lux,光暗比12h/12h 条件下培养7天获得种子液,以15%接种比例在无菌状态下接入图1 所示的1.2L 六通道光生物反应器,每通道含0.8L Basal培养基及不同浓度二乙醇胺(0、20mg/L、40mg/L、60mg/L、80mg/L、100mg/L),在(28±1)℃,光照强度3000lux,光暗比12h/12h 条件下通气搅拌培养7 天。通气气体为经0.22µm 无菌滤膜过滤的纯CO2和空气,通气量为0.5L/min,CO2体积分数为0.03%、2%、5%、7%、10%。以无二乙醇胺培养胶球藻细胞为对照。

图1 胶球藻固定CO2和积累油脂实验简易装置
1.3 仪器与设备
1.4 生物量测定
收集第1.2 节培养7 天的胶球藻液,6000r/min离心20 min,弃上清液,蒸馏水洗涤藻泥3 次,-80℃超低温预冻处理12h后,再真空冻干48h至恒重,称量胶球藻粉得生物量,以式(1)计算生物量产率。

式中,P 为生物量产率,g/(L∙d);X1、X0分别为培养时间t1和t0测定的生物量浓度,g/L。
1.5 CO2固定效率及气液传质系数测定
胶球藻CO2固定效率RCO2采用式(2)计算。

式中,RCO2为胶球藻CO2固定效率,g/(L∙d);CC为胶球藻细胞含碳量;P 为胶球藻生物量产率;MCO2和MC分别为CO2分子和C元素分子量。
将图1所示生物反应器中不含藻细胞培养基以99.99%氮气曝气1.5h,再以不同浓度CO2曝气,培养基温度为(28±1)℃,测量1h 内培养基中溶解CO2浓度变化,时间间隔5min 记录1 次,式(3)计算传质系数KLa。
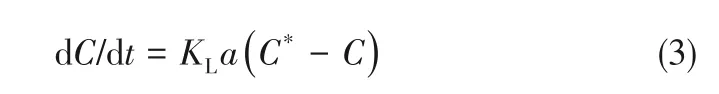
式中,dC/dt 为单位体积培养液中CO2传递速率,mol/(min·L);C*为与CO2分压平衡的液相CO2浓度,mol/L;C 为液相CO2浓度,mol/L;KLa 为体积传质系数,min-1。
1.6 油脂含量测定
准确称取0.02g(W1)冻干藻粉,加入3mL 水/氯仿/甲醇(体积比为0.5∶2∶1)震荡20min 充分混匀,10000r/min 离心10min,收集氯仿层,萃取重复3~5 次,收集氯仿层至已称重(W2)50mL 离心管中,以0.5mL 1mol/L氯化钾和1mL超纯水清洗萃取管,合并所有清洗液与氯仿层,真空干燥至恒重(W3),以式(4)和式(5)计算油脂含量和产率。

1.7 超微结构表征
以6000r/min 离心20min 收集胶球藻液,磷酸盐PBS缓冲溶液(pH=7.0)洗涤藻泥。将藻泥重悬于20% DMSO 溶液,在35℃诱导20min。将15µL尼罗红染色溶液加入1mL悬浮液中诱导10min。采用激光共聚焦对尼罗红染色含脂细胞器成像,绿色荧光激发波长为480nm,发射波长为560~615nm。同步以魏东等[14]方法将藻细胞进行固定、脱水、包埋、聚合、切片后采用透射电镜捕捉成像。
(2)尺寸的标注合理性不高,这主要是指对于换算的标准和绘图标准的尺寸标注不够准确到位。这方面的问题主要体现在标注的信息缺乏准确性,也就是说,在实际换算时,存在标注换算的比例和方法错误的现象,这是直接影响到换算结果的一类严重的问题。另外,信息标注的清晰度不足也是标注合理性不高的一个典型体现,这会给实际建筑施工人员对于图纸的辨别和判断带来一定的障碍。
1.8 脂肪酸组成测定
取10mg 藻粉加入100µL 内标液(1g/L 十九烷酸二氯甲烷溶液),混匀后加入2mL 40g/L的KOHCH3OH 溶液,75℃水浴15min。冷却后加入2mL BF3-CH3OH 溶液(体积比1∶4),然后75℃水浴15min,待冷却后加入1mL饱和NaCl溶液和2mL正己烷,涡旋1min,4000r/min 离心8min,取1mL 上清液过0.22µm 滤膜,以Angilent 6890N GC-MS 测定脂肪酸组成。载气高纯氦气,流速1mL/min,样品分流比2∶1,进样量0.2µL,质谱扫描范围33~400u。程序升温为:初始柱温110℃保持2min,以5℃/min 升高至220℃保持5min。各峰型鉴定采用NTST05a谱库自动检索定性,根据各峰相对于C19∶0内标峰面积,计算脂肪酸含量。
1.9 酶活测定
采用比色定量试剂盒(上海酶联生物科技有限公司)测定胶球藻1,5-二磷酸核酮糖羧化酶/加氧酶(Rubisco)、碳酸酐酶(CA)、磷酸烯醇式丙酮酸羧化酶(PEPC)、乙酰辅酶A 羧化酶(ACCase)活性。
2.0 统计分析
实验数据采用平均值±标准差(n=3)表示,数据分析采用Origin 8和SPSS 18.0软件进行,利用SPSS 18.0软件对各组实验数据的显著性差异分析,显著水平为p<0.05。
2 结果与讨论
2.1 不同CO2浓度对胶球藻固定CO2和积累油脂的影响

如图2 所示,胶球藻生物量随着CO2浓度升高呈现先上升后下降趋势。在CO2体积分数为2%时达到最大值0.59g/L。CO2体积分数增加至5%时,生物量下降,其值显著性低于CO2体积分数2%时的生物量,说明胶球藻细胞在体积分数5%CO2条件下生长受到抑制。持续增加CO2体积分数至7%甚至10%时,这种生长抑制效应更为显著,生物量值与体积分数0.03%、5%和7% CO2条件相比,分别降低了17.5%、22.5%和12.5%,尤其较体积分数2%CO2减少了约58%。不同浓度CO2对胶球藻固碳效率呈现与生物量一致的先上升后下降变化趋势,在体积分数2%CO2条件下固定效率最佳,其值为137.55mg/(L·d),是体积分数0.03%CO2的1.24倍,并显著性高于体积分数5%~7%的高CO2条件下的固定效率。油脂含量在低浓度(体积分数0.03%)CO2和高浓度(体积分数7%、10%)CO2诱导下无显著性变化,相较而言,体积分数2%和5%CO2条件下油脂含量显著性增加,尤其体积分数2%CO2条件下油脂含量高达56%,是体积分数5%和其他CO2条件下的1.19~1.4倍。此外,胶球藻在体积分数2%CO2条件下的油脂产率为47.20mg/(L·d),显著高于0.03%、5%、7%和10%CO2条件下的27.98mg/(L·d)、32.9mg/(L·d)、27mg/(L·d)和23.43mg/(L·d)。综 上 所述,胶球藻生长、固定CO2和积累油脂的最适宜CO2体积分数为2%,这与魏东等[14]报道的2% CO2能显著提高胶球藻细胞油脂积累效率研究结果一致,但本实验生物量和油脂产率低于其报道的4.67g/L 生物量和77.49mg/(L·d)脂肪酸产率,与小球藻、栅藻、盐生杜氏藻和聚球藻藻株的固定CO2和积累油脂效率也有差距[17]。这些差异可能是由于培养体系CO2供给模式以及碳源供给种类不同而引起。然而,在相同单一CO2碳源培养条件下,胶球藻固定CO2和积累油脂效率明显优于报道的布朗葡萄藻(B.braunii)和栅藻(S.quadricauda)等藻株[15,18],证实了胶球藻在固定CO2和积累油脂方面具有较好的潜力。

图2 不同CO2体积分数对胶球藻生物量及固定CO2和积累油脂的影响
2.2 不同二乙醇胺浓度作用对胶球藻固定CO2和积累油脂的影响
尽管胶球藻在固定CO2和积累油脂方面具有一定的潜力,但获得的固定CO2和积累油脂效率距工业化应用尚仍存在差距。培养体系中CO2溶解传质效率是微藻高效固定CO2和积累油脂的决定因素。如前所述,利用胺类物质将培养体系中CO2转化为HCO-3,提高培养体系CO2溶解效率,从而加强微藻固碳积脂颇受关注[6,8-11]。
在2.1节中体积分数2%CO2基础上进一步考察了不同DEA浓度对胶球藻固定CO2及积累油脂的影响。如图3所示,随着DEA浓度增加胶球藻生物量呈现先上升后下降趋势。当DEA 浓度由0 增加至40mg/L 时,胶球藻生物量显著提高,在DEA 为40mg/L 时达到最大值0.97g/L,相较于对照组生物量增加了1.64 倍。当DEA 为60mg/L 时,生物量值与40mg/L DEA 处理组相比无显著差异。而DEA 浓度为80mg/L 和100mg/L 时的胶球藻生物量,较DEA 浓度60mg/L 生物量显著降低(p<0.05),生物量由0.96g/L 降至0.54g/L。这表明胶球藻在适宜浓度DEA作用下,可捕获更多的CO2为胶球藻细胞利用促进生长代谢,而高浓度DEA 对胶球藻生长产生抑制作用,这可能是高浓度DEA 会在藻细胞产生毒性和胺腐蚀效应。这一现象与Cardias 等[11]研究结果一致,添加172.2mg/L DEA喂养Spirulinasp.显著促进生长,而高于172.2mg/L浓度的DEA显著抑制了藻体细胞生长。不仅如此,不同浓度DEA作用下胶球藻对CO2固定效率差异显著,在0~40mg/L浓度范围内CO2固定效率显著上升,DEA 浓度为40mg/L时CO2固定效率达到最大值为225.98mg/(L·d),较无DEA 处理组固定效率提高了64.8%。当DEA浓度提高至60~80mg/L时,CO2固定效率显著下降,由225.98mg/(L·d)降至126.95mg/(L·d)。说明适宜浓度的DEA 在藻培养体系中可促进胶球藻细胞的固定效率。王兆印等[10]和Cardias等[11]将DEA用于藻培养体系发现适合DEA 浓度显著提高了气液传质系数,增大了CO2气液传质速率,从而使藻细胞生物量和CO2固定效率较未添加DEA 细胞提高25.6%和41.2%。本研究中无DEA 处理组测得KLa值为0.054/min,而在40mg/L DEA条件下的KLa值增加至0.073/min,因而DEA 提高了胶球藻培养体系气液传质系数,增强了CO2传质效率,使体系中能被胶球藻利用的无机碳增多,藻细胞固定CO2和积累油脂效率提高。

图3 不同DEA浓度对胶球藻固定CO2及积累油脂的影响
在DEA 作用下,胶球藻油脂含量随着DEA 浓度的升高呈先上升后下降趋势,胶球藻在40mg/L DEA 处理组油脂含量最高为64.33%,较无DEA 处理细胞油脂含量提高了1.37倍,显著促进了藻细胞的油脂合成积累。为进一步明确DEA 对胶球藻细胞积累油脂的促进作用,对不同DEA 浓度作用下的胶球藻细胞进行了共聚焦激光和透射电镜表征。由图4 可知,经40mg/L DEA 处理的胶球藻细胞脂质荧光强度显著强于其他浓度DEA诱导的藻细胞,证实40mg/L DEA处理的胶球藻细胞脂质含量最高,与上述实验结果一致。此外,胶球藻细胞透射结果可以看出,在无DEA 处理条件下的胶球藻细胞油脂滴和淀粉颗粒分别占据了整个细胞的一半体积。随着DEA 浓度的增加,尤其在40mg/L DEA 处理条件下,淀粉颗粒大小和数量显著萎缩,以电子密集点形式存在的脂质体聚合成群,占据细胞体积的一半以上,说明脂质含量显著提高。而在100mg/L高浓度DEA 处理条件下,淀粉颗粒聚集成团,几乎占据了整个细胞体积,仅能看到一些零散脂质点,这与激光共聚焦脂质荧光结果显示了一致性。此外,不同DEA 对胶球藻油脂产率的影响与生物量变化趋势一致,在DEA 浓度为40mg/L 时,油脂产率达到最大值59.9mg/(L·d),较无DEA 处理组油脂产率提高了74.7%。以上结果表明在体积分数2%CO2条件下,添加40mg/L DEA进一步促进了胶球藻细胞生长,固定CO2和积累油脂效率也显著提高。因此,40mg/L DEA 是强化胶球藻固定CO2和积累油脂的最佳浓度。

图4 不同DEA浓度对胶球藻细胞超微结构的影响
2.3 二乙醇胺作用对胶球藻细胞中固定CO2和积累油脂关键酶活性的影响
碳酸酐酶CA 是一种含锌金属酶,具有维持酸碱平衡、CO2及碳酸盐转运等功能,并且是碳浓缩过程中催化CO2水合生成HCO-3的关键限速酶,其活性强弱直接影响细胞内CO2转化HCO-3的效率[19]。研究报道显示,CA 酶在低CO2浓度条件下活性相对较高,可促进CO2转运进入细胞中进而被核酮糖-1,5-二磷酸羧化酶RuBisCO 固定利用,而在较高CO2浓度下(如工业烟道气)活性相对较低,在一定程度上限制了碳浓缩固定[20]。研究者们后续依据CA 酶活特性通过基因工程策略调控CA 酶活来提高微藻固定CO2和积累油脂效率,如Wei 等[21]将微拟球藻细胞中的CA 酶基因进行敲除构建基因工程藻株,在相对高浓度的5%CO2培养体系中固定CO2和积累油脂效率提高了41%;Lin 等[20]将CA 酶基因克隆表达转化普通小球藻株,其转基因藻株在相对低的体积分数1% CO2培养体系中固碳效率、生物量产量和脂质积累均获得大幅度提升。而本研究中在相对较低的体积分数2%CO2条件下,DEA和无DEA处理的胶球藻细胞中CA酶活性均随着培养时间增加呈现先上升后下降趋势[图5(a)]。在DEA 处理胶球藻细胞中,CA 酶活在培养至第7 天时达到最大值150.65U/L,是未添加DEA 处理细胞CA酶活性的1.08倍,证实外源添加DEA 可显著增强CA活性,大量的CO2被催化生成HCO-3,促进了胶球藻生长。

磷酸烯醇式丙酮酸羧化酶PEPC是C4光合作用途径关键酶之一,其主要功能是催化磷酸烯醇式丙酮酸的β-C羧基化并生成草酰乙酸,与乙酰辅酶A羧化酶ACCase 之间存在底物竞争[24]。Allen 等[25]在报道中指出下调胶球藻细胞中PEPC活性,可加强碳流向脂类合成路径的分配比率,有效促进细胞脂质积累。不仅如此,有研究者通过敲除或沉默表达三角褐指藻(Phaeodactylum tricornutum)和莱茵衣藻(C. reinhardtii) 中 的PEPC 基 因,有 效 证 实PEPC 表达下调在藻细胞油脂合成积累过程中起正调控作用[26-28]。由图5(c)可以看出,DEA 加入胶球藻细胞中PEPC 活性降低,在培养至第7 天时酶活值仅为22.01U/L,尽管无DEA 处理组细胞中PEPC活性水平也相对较低,其值为24.01U/L,但整体上高于40mg/L DEA+2%CO2细胞中PEPC活性[图5(c)]。因此,可以推测PEPC 活性降低驱使固定的碳流向油脂合成积累路径,在一定程度上促进了胶球藻胞内油脂的富集。

图5 二乙醇胺对胶球藻碳酸酐酶、核酮糖二磷酸羧化酶、磷酸烯醇式丙酮酸羧化酶、乙酰辅酶A 羧化酶活性影响
乙酰辅酶A羧化酶ACCase属生物素依赖型酶,催化乙酰辅酶A生成丙二酸单酰辅酶A,是脂肪酸合成过程中的限速酶。研究报道显示,在小球藻、聚球藻、等鞭金藻等藻种属中过表达ACCase 酶基因,可有效促进藻细胞内油脂含量的提高[28-29],甚至在转ACCas 基因的小球藻(C. vulgaris)细胞中油脂含量较对照组提高了6倍,以及不饱和脂肪酸神经酸C24∶1含量提高了9倍。不仅如此,ACCase活性的提高可催化生成更多的丙二酰辅酶A来抑制脂肪酸氧化,从而提高脂肪酸含量[24]。而在40mg/L DEA 作用下胶球藻细胞中ACCase 酶活性随着培养时间的增加逐渐增强,培养至第7 天时,ACCase活性达到最大值181.94U/L[图5(d)],是无DEA处理细胞中ACCase 最大酶活的1.06 倍。因此,在DEA作用下,ACCase 酶活提高驱使大量固定的碳流向油脂路径。
2.4 二乙醇胺作用对胶球藻细胞脂肪酸组分的影响
藻细胞中脂肪酸组成和比例直接影响藻基生物柴油的十六烷值、氧化稳定性及低温冷凝等燃料特性。由表1可知,2%CO2和DEA+2%CO2作用胶球藻细胞脂肪酸均以C16和C18为主,但其各脂肪酸比例显著不同。如无DEA作用细胞中棕榈酸C16∶0和硬脂酸(C18∶0)含量显著高于DEA 作用藻细胞;C18∶2 在DEA 细胞中未检测到,而在无DEA 作用细胞中含量为12.39%。整体上,DEA 作用对胶球藻细胞中脂肪酸影响包括:①使C16~C18脂肪酸比例占总脂肪酸的92%,是无DEA作用细胞的1.11倍;②使单不饱和脂肪酸油酸C18∶1 比例高达50%以上,高于无DEA 作用细胞中11.59%含量,并且显著高于Peng 等[30]报道的以2%CO2为碳源的胶球藻细胞中的15.57%比例,甚至远高于Yu 等[31]粗甘油碳源作用胶球藻细胞中3.88%的含量;③为满足EN 14214 和ASTM D-6751 生物柴油燃料标准,脂质中亚麻酸C18∶3 含量需低于12%,而DEA 作用细胞中的C18∶3 比例(1.99%)满足这一标准。因而DEA 作用的胶球藻细胞是优良脂肪酸制造者。此外,研究指出脂质中饱和脂肪酸SFAs 和单不饱和脂肪酸MUFAs 比例较高或以多不饱和脂肪酸PUFAs含量为主,会降低藻基生物燃料氧化稳定性和低温冷凝特性,而脂质中若MUFAs 比例高于SFAs 和PUFAs 两者含量,可赋予藻基生物燃料优越的燃料性能[4]。本研究中DEA处理细胞中MUFAs比例高达56.65%,高于SFAs 和PUFAs 两者含量43.35%,因而能显著提高转酯化生物柴油产品的十六烷值和碘值,是炼制高质量生物柴油的理想原料。
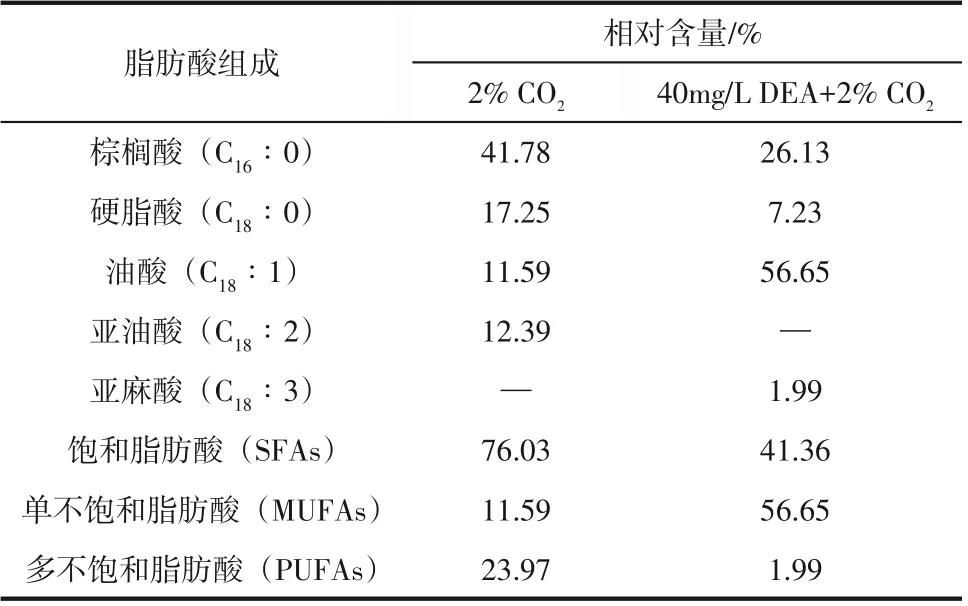
表1 二乙醇胺作用对胶球藻细胞脂肪酸组分的影响
3 结论
二乙醇胺DEA 强化胶球藻(C.subellipsoidea)C-169固定CO2和积累油脂结果提示,40mg/L DEA作用将培养体系CO2与培养基间的气液传质系数提高至0.073/min,使得体系可利用无机碳源比例增加,同时上调胶球藻胞内CO2固定路径调控酶RubisCO 和CA、脂肪酸路径调控酶ACCase 活性以及下调ACCase竞争路径调控酶PEPC活性,从而协同强化了胶球藻固定CO2和积累油脂,使固定CO2和积累油脂效率提高至225.98mg/(L·d)和59.9mg/(L·d),且40mg/L DEA 作用胶球藻中C16~C18脂肪酸比例高达92%,单不饱和脂肪酸占比(56.65%)高于饱和脂肪酸和多不饱和脂肪酸(43.35%),是炼制藻基生物柴油的理想原料,研究结果为利用微藻进行CO2生物减排及可再生能源开发提供新思路和理论依据。

