Ki67增殖抗原表达水平在局部晚期鼻咽癌诱导化疗中的预测作用
刘会,兰美,彭新皓,谭明宇,魏雪玲,游冬玲,郎锦义
646000 四川 泸州,西南医科大学 临床医学院(刘会、魏雪玲、游冬玲、郎锦义);610041 成都,四川省肿瘤医院·研究所,四川省癌症防治中心,电子科技大学医学院 放疗中心(兰美、彭新皓、谭明宇、郎锦义)
鼻咽癌是我国常见恶性肿瘤之一,主要发生在广东等中国南方地区,呈人群易感现象,具有明显的地区聚集性、种族易感性、家族高发倾向和发病率相对平稳的特点。鼻咽癌以鳞癌最常见,约占95.00%以上,病理分为角化型癌、非角化型癌(分化、未分化)[1]。由于其非特异性的临床症状和隐蔽的解剖位置,在诊断时有70.00%~80.00%的患者为局部晚期鼻咽癌(locally advanced nasopharyngeal carcinoma,LA-NPC)[2]。LA-NPC存活率低,严重影响鼻咽癌患者预后水平。
目前,治疗鼻咽癌的主要方法是放疗、化疗等综合治疗。对于LA-NPC患者,临床上多采用同步放化疗(concurrent chemoradiotherapy,CCRT)或诱导化疗联合同步放化疗(induction chemotherapy and concurrent chemoradiotherapy,IC+CCRT)的治疗方案。但目前LA-NPC患者在选择CCRT或IC+CCRT治疗方案时尚存在争议,Zhou等[3-4]指出对于LA-NPC,IC+CCRT比单纯CCRT能获得更好的生存结果;Tan等[5]研究发现IC+CCRT可被认为是LA-NPC的标准治疗方案之一。而苑仁冰等[6]认为单纯CCRT在LA-NPC患者中完全缓解率高,疗效肯定,毒副反应患者可以耐受。Fountzilas等[7-8]指出在LA-NPC中,与单纯CCRT相比,IC+CCRT并不能显著提高缓解率和(或)存活率,且在接受诱导化疗的患者中,局部复发应该引起关注。因此,寻找诱导化疗的最佳获益人群是选择LA-NPC治疗方案的重要前提。
Ki67是在临床被用于评价肿瘤细胞增殖水平的标志物。由于其在恶性细胞中高表达,通常被用来预测癌症的进展[9-13],Ki67表达水平高低与许多肿瘤的分化程度、浸润、转移及预后密切相关。Ki67可作为一个独立的预后指标,其增高与预后不良相关[14]。目前,Ki67可否用于筛选鼻咽癌诱导化疗获益人群尚不清楚。因此,本研究回顾性分析了390例接受IC+CCRT或CCRT的LA-NPC患者,观察其生存状态与其治疗前原发灶Ki67表达水平的关系,探索了Ki67表达水平在LA-NPC诱导化疗中的预测作用。
1 材料与方法
1.1 一般资料
回顾性分析2013年~2019年间四川省肿瘤医院收治的LA-NPC患者,将治疗方案为IC+CCRT或CCRT的患者纳入研究。收集患者的年龄、性别、病理诊断、吸烟史、饮酒史、慢性病史、T分期、N分期、临床分期、化疗方案、放射剂量等资料。纳入患者的鼻咽部原发病灶标本经鼠单抗(MIB1)试剂进行免疫组织化学检测,并经我院2位副高以上病理科医师在显微镜下判读ki67值,最后取平均值。纳入标准:1)经我院病理检查确诊为鼻咽非角化型鳞状细胞癌;2)Ⅲ~Ⅳa期LA-NPC患者;3)接受2~3周期的TP(紫杉醇+顺铂)方案诱导化疗联合顺铂单药的同步放化疗(IC+CCRT),或单纯接受TP方案同步放化疗(CCRT);4)接受适形性调强放射治疗(intensity-modulated radiotherapy,IMRT);5)入院前均未接受任何抗肿瘤治疗。排除标准:1)病理诊断有其他肿瘤者;2)初诊时肿瘤为复发或已远处转移者;3)重症心脑血管病患者;4)治疗过程中放弃治疗自动出院者及治疗疗程不连续者。
1.2 治疗方案
1.2.1 放疗 所有患者均行IMRT放疗。患者取仰卧位,采用头颈肩热塑膜和头枕固定头颈部,将鼻咽定位CT和鼻咽MRI融合后在计划系统上勾画放疗靶区。鼻咽大体肿瘤体积(gross tumor volume of the nasophargnx,GTVnx)为定位CT及MRI影像上可见的鼻咽原发肿瘤及咽后淋巴结;颈部大体肿瘤体积(gross tumor volume of the neck lymph nodes,GTVnd)为影像学检查符合诊断标准的肿大淋巴结;临床靶区体积(clinical target volume,CTV)1为GTVnx外扩5.00~10.00 mm+整个鼻咽粘膜及粘膜下5.00 mm;CTV2为CTV1外扩5.00 mm,包括鼻咽腔、咽旁间隙、鼻腔后部、上颌窦后部、颅底、部分颈椎和斜坡等可能受侵的区域;淋巴结引流区临床靶区体积(clinical target volume of lymph nodes,CTVln)包括GTVnd和所在淋巴引流区及需要预防照射的阴性淋巴引流区。计划靶区体积(planning target volume,PTV)为上述各靶区对应外扩3.00 mm。靶区的剂量为:GTVnx 69.96~76.00 Gy,GTVnd 66.00~70.00 Gy,CTV1 60.00~66.00 Gy,CTV2 54.00~60.00 Gy,CTVln 50.00~54.00 Gy,采用常规分割方式,每天1次,一周5次。根据美国肿瘤放射治疗协作组治疗方案RTOG 0225进行危及器官勾画及剂量限制,危及器官主要勾画脑干、脊髓、视神经、视交叉、颞叶、晶体、腮腺、垂体、耳蜗、颞叶、颞颌关节等。计划评价:处方剂量包括至少95.00%的PTV;PTV以外的任何地方不能出现>110.00%的处方剂量;PTV 接受≥110.00%处方剂量的体积<20.00%;PTV接受<93.00%处方剂量的体积<1.00%。危及器官剂量限制:脑干≤54.00 Gy,脊髓≤45.00 Gy,视神经、视交叉<54.00 Gy,颞叶≤60.00 Gy,眼晶状体<8.00 Gy,垂体<54.00 Gy,颞颌关节<60.00 Gy,50.00%腮腺体积<30.00 Gy(单侧)。计划由副高及以上医师审核通过后进行放射治疗。
1.2.2 化疗 IC+CCRT组:在放疗前均接受2~3周期TP方案诱导化疗。具体方案为:紫杉醇175 mg/m2d1+顺铂75 mg/m2,d1~3,3周方案;诱导化疗后2周或3周开始行同步放化疗,同步化疗方案采用顺铂(70~80 mg/m2, d1~3)单药化疗3周期,3周方案。CCRT组在放疗期间接受3周期TP方案同步化疗:紫杉醇175 mg/m2d1+顺铂75mg/m2, d1~3,3周方案。使用紫杉醇前予以地塞米松预处理;化疗期间予以保胃、止吐、补液、水化等治疗,每周监测血常规,每2周复查生化,必要时行升白细胞、升血小板等对症治疗,当患者出现严重不良反应时则暂停治疗。
1.3 疗效评价及随访
患者通过门诊或住院复查、电话随访等方式进行长期随访。治疗结束后1月复查,前两年每3月复查一次,第3~5年每6月复查一次,以后的除开病情变化2~3年复查一次。随访内容包括病史、腹部B超、胸部CT、鼻咽部及颈部MRI或其他必要检查。研究的观察终点包括肿瘤转移、肿瘤复发及患者死亡,患者总生存期(overall survival,OS)、疾病无远处转移生存期(metastasis-free survival,MFS)、局部无复发生存期(local recurrence-free survival,LRFS)、疾病无进展生存期(progression-free survival,PFS)。
1.4 统计方法
采用MedCalc、Rstudio和SPSS 23.0软件。MedCalc软件中ROC曲线分析得出Ki67截断值;Rstudio软件进行倾向性匹配评分分析挑选出最终纳入本研究的患者;Kaplan-Meier法计算患者OS、MFS、LRFS、PFS,并分析预后相关因素,使用Log-rank检验行单因素生存分析,Cox回归法行多因素生存分析。定义P<0.05为差异具有统计学意义。
2 结 果
2.1 倾向性匹配评分
为避免回顾性分析因为纳入偏倚等各种因素影响,两组间基线水平可能存在统计学差异,采用Rstudio软件对390例患者进行倾向性匹配分析。最终得出390例患者中N分期及慢性病史对两组病例的基线水平产生影响,使两组患者的基线水平不一致(表1)。经倾向性匹配分析,最终纳入患者334例(IC+CCRT组167例,CCRT组167例)的基线水平调整一致(表2)。

表1 IC+CCRT与CCRT两组患者原始基线水平对比表

表2 IC+CCRT与CCRT两组患者倾向性匹配评分后基线水平对比表

VariableCCRTIC+CCRTX2P ≥5083(49.70)77(46.11)T[n(%)]0.9580.398 112(7.19)6(3.59) 242(25.15)51(30.54) 360(35.93)60(35.93) 453(31.73)50(29.94)N[n(%)]0.7350.192 04(2.40)5(3.00) 119(1.38)13(7.78) 2108(64.66)97(58.08) 336(21.56)52(31.14)Clinical phased [n(%)]1.1980.275 Ⅲ87(52.10)107(64.07) Ⅳa80(47.90)60(35.93)Smoking[n(%)]1.4770.224 No101(60.48)89(53.29) Yes66(39.52)78(46.71)Drinking[n(%)]0.2270.634 No119(71.26)114(68.26) Yes48(28.74)53(31.74)Combined with chronic diseases [n(%)]0.0001.000 No148(88.62)149(89.22) Yes19(11.38)18(10.78)
2.2 患者一般情况
共390例患者纳入本研究,其中IC+CCRT组195例,CCRT组195例,中位年龄50岁(23~79岁)。IC+CCRT组中75例(38.50%)接受2周期诱导化疗,120例(61.50%)接受3周期诱导化疗。随访时间截止至2020年10月,中位随访时间32.70个月(8.80~93.17个月),4例患者失访(截止最后一次随访未出现复发或转移)。据AJCC第八版分期,Ⅲ期200例(51.30%),Ⅳa期190例(48.70%)。≥50岁患者186例,<50岁204例;男性278例,女性112例;有吸烟史155例,无吸烟史235例;有饮酒史111例,无饮酒史279例;有慢性病史52例,无慢性病史338例。
经Rstudio软件进行倾向性匹配评分分析后共334例患者纳入最终研究,其中IC+CCRT组167例,CCRT组167例,中位年龄50(23~72)岁。IC+CCRT组中,70例(42.00%)接受2周期诱导化疗,97例(58.00%)接受3周期诱导化疗。随访时间截至2020年10月,中位随访时间32.94个月(8.80~93.17个月),3例失访(截止最后一次随访未出现复发或转移)。Ⅲ期194例(58.10%),Ⅳa期140例(41.90%)。年龄≥50岁160例,<50岁174例;男性247例,女性87例;有吸烟史144例,无吸烟史190例;有饮酒史101例,无饮酒史233例;有慢性病史37例,无慢性病史297例。
2.3 失败模式分析
390位患者的总失败率为22.60%(88例),其中死亡33例(8.50%),局部复发7例(1.80%),区域复发2例(0.50%),远处转移46例(11.80%)。失败病例中位死亡时间为24.60个月(2.37~69.83个月),中位复发时间为45.80个月(11.93~69.07个月),中位远处转移时间为21.57个月(1.40~67.8个月)。最常见的转移部位为骨(21例,45.70%),其他转移部位包括肺(16例,34.80%)、肝脏(7例,15.10%)、腮腺(1例,2.20%)、腋窝淋巴结(1例,2.20%)。
经倾向性分析后最终纳入分析的334位LA-NPC患者总失败率为23.10%(77例),其中死亡29例(8.70%),局部复发5例(1.50%),区域复发2例(0.60%),远处转移41例(12.30%)。失败病例中位死亡时间为18.00个月(2.37~67.97个月),中位复发时间为38.07个月(26.93~69.07个月),中位远处转移时间为21.57个月(1.40~45.80个月)。最常见的转移部位为骨(19例,46.33%),其他转移部位包括肺(15例,36.60%)、肝脏(6例,14.63%)、腮腺(1例,2.44%)。
2.4 Ki67截断值
运用ROC曲线分析分别得出390例患者OS、PFS、LRFS、MFS对应的Cut-off值;最后得出Ki67>50.00%为影响LA-NPC预后的截断值,且有统计学意义(P<0.05)(表3)。

表3 ROC相关参数及截断值
2.5 生存预后因素分析
2.5.1 生存分析 IC+CCRT、CCRT两组的OS分别为93.40%、78.60%(P=0.038),MFS分别为87.50%、77.30%(P=0.027),LRFS分别为90.00%、95.70%(P=0.697),PFS分别为80.80%、77.30%(P=0.065)。单因素分析显示IC+CCRT组的OS、MFS优于CCRT组,差异有统计学意义(P<0.05);CCRT组的LRFS优于IC+CCRT组,显示出抑制肿瘤复发的趋势,但差异无统计学意义(图1)。Cox回归多因素分析提示是否行诱导化疗并非LA-NPC的独立预后因素(P>0.05)(表4)。
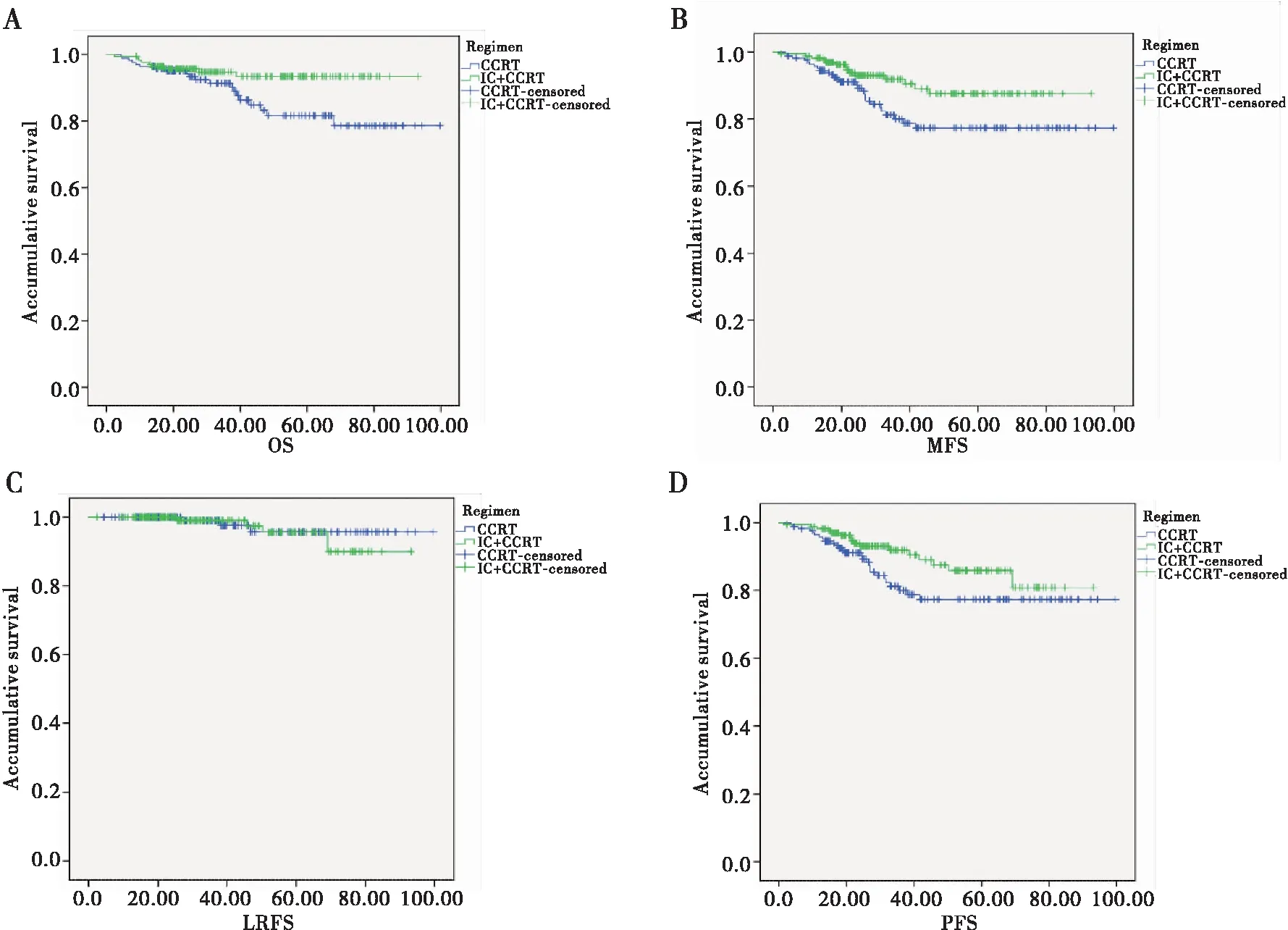
图1 Kaplan-Meier法分析对比接受IC+CCRT、CCRT患者的OS、MFS、LRF、SPFS
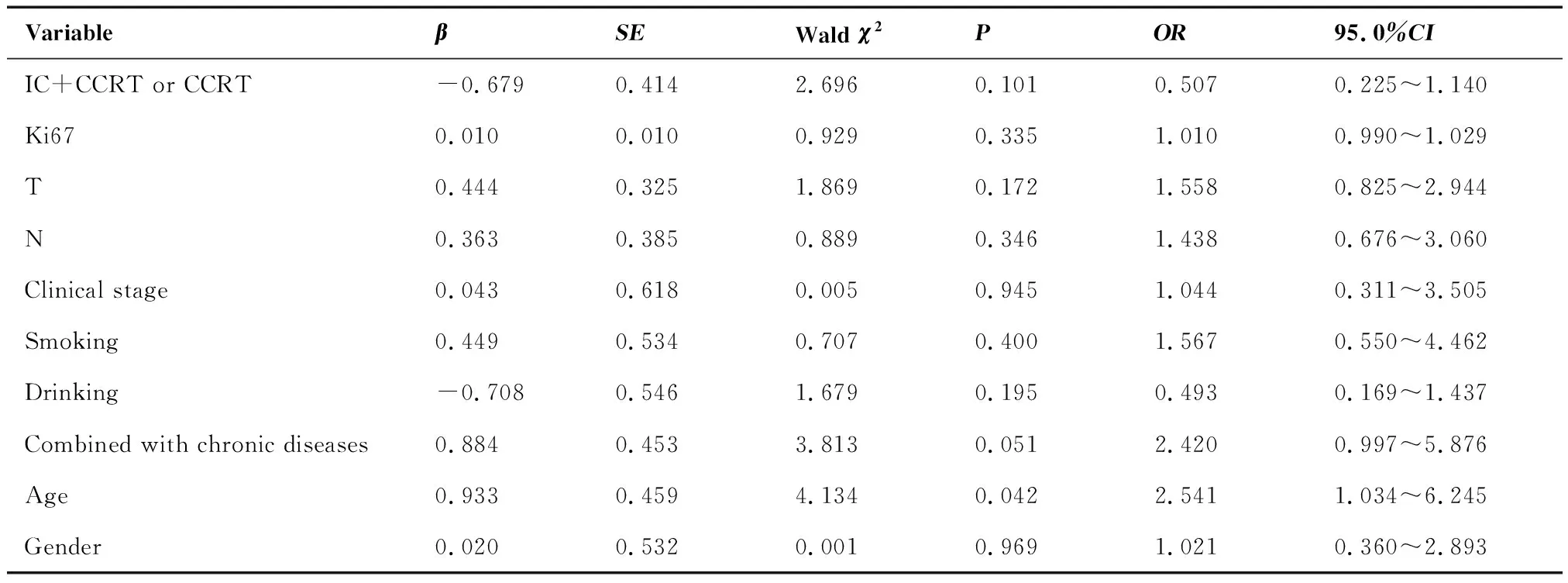
表4 患者总生存率相关预后因素分析
2.5.2 Ki67>50.00%患者的生存分析 Ki67>50.00%时IC+CCRT、CCRT两组病例的OS分别为96.70%、75.50%(P=0.011),MFS分别为91.90%、66.70%(P=0.003),LRFS分别为88.90%、94.10%(P=0.530),PFS分别为81.70%、66.70%(P=0.007)(图2)。单因素分析显示Ki67>50.00%时IC+CCRT组的OS、MFS、PFS明显优于CCRT组(P<0.05);两组的LRFS差异无统计学意义。COX回归多因素分析提示Ki67≥50.00%的LA-NPC患者不同的治疗方案(IC+CCRT或CCRT)是影响OS的独立预后因素(P<0.05)(表5)。

图2 Kaplan-Meier法分析对比接受IC+CCRT、CCRT Ki67>50%患者的OS、MFS、LRF、SPFS
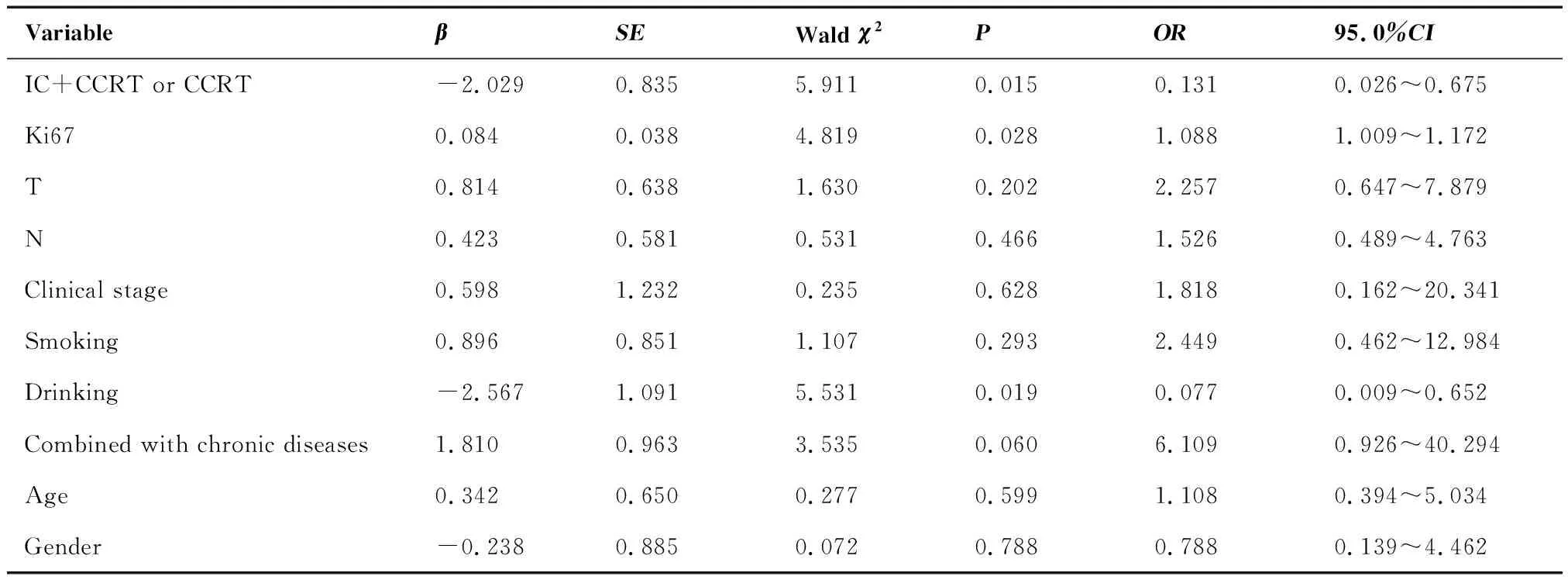
表5 Ki67>50.00%患者总生存率相关预后因素分析
2.5.3 Ki67≤50.00%患者的生存分析 Ki67≤50.00%时IC+CCRT、CCRT两组病例的OS分别为91.10%、80.40%(P=0.631),MFS分别为84.00%、85.20%(P=0.913),LRFS分别为91.60%、96.70%(P=0.312),PFS分别为80.90%、85.20%(P=0.921)。单因素分析显示,当LA-NPC的Ki67≤50.00%时两组的OS、MFS、LRFS、PFS差异无统计学意义(图3)。Cox回归多因素分析提示Ki67≤50.00%的LA-NPC患者选择IC+CCRT或者CCRT治疗方案的OS差异无统计学意义(表6)。

图3 Kaplan-Meier法分析对比接受IC+CCRT、CCRT Ki67<50%(包含50%)患者的OS、MFS、LRF、SPFS

表6 Ki67<50.00%(包含50.00%)患者总生存率相关预后因素分析
3 讨 论
本研究率先采用瘤体中Ki67表达水平评价诱导化疗在LA-NPC中的预测作用,LA-NPC临床上多选用CCRT或IC+CCRT治疗方案,多数研究也表明IC+CCRT、CCRT可以提高近期和远期疗效且毒副作用可耐受[15-16]。NCCN指南建议LA-NPC使用诱导化疗,但诱导化疗获益人群仍存在争议。Ki67标记的是处于增殖周期中的细胞,该标记阳性率越高,表明肿瘤生长越快,组织分化越差,对化疗也越敏感。Ki67可作为一个独立的预后指标,其增高与肿瘤预后不良相关[10]。已有的研究多是局限于诱导化疗TP、GP、TPF等方案对LA-NPC的预后影响及毒副作用的观察,或是Ki67、P16、LDHA蛋白、NM23、MMP-1、MMP-2、EZRIN蛋白、细胞周期素D1、中性粒细胞/淋巴细胞比率等对鼻咽癌预后的影响[17-23],为研究Ki67表达水平在LA-NPC诱导化疗中的预测作用奠定了基础。
本研究通过对LA-NPC患者的回顾性分析发现,Ki67表达>50.00%的LA-NPC在IC+CCRT组的OS优于单独CCRT组,且这组患者在MFS方面也有显著的获益。说明Ki67表达>50.00%的LA-NPC更可能在IC+CCRT的治疗模式中通过降低远处转移而使生存获益。主要的原因可能是,Ki67表达较高的LA-NPC通常对化疗敏感性更高,这使得在采用IC方案的时候,这部分患者的局部病灶也容易得到控制。另一方面,Ki67表达>50.00%的患者也容易发现远处转移,首先采用IC的治疗模式可以优先清除全身微小转移灶,有利于提高MFS。因此对于Ki67表达>50.00%的LA-NPC,采用IC+CCRT的模式可能更有利于患者的长期生存。而在Ki67≤50.00%的患者中,我们的研究发现IC+CCRT和单纯CCRT两组生存差异没有统计学意义,其可能的原因是低Ki67对化疗的敏感性并不高,先采用IC的方案可能并不能有效地控制局部病灶,多因素分析也提示,Ki67表达≤50.00%的患者采用IC+CCRT和CCRT方案的OS差异无统计学意义。
综上,本研究发现,对于Ki67表达>50.00%的LA-NPC,优先采用IC+CCRT的方案,有利于降低远处转移率,提高生存率。而对于Ki67表达≤50.00的患者,IC+CCRT和CCRT并无明显生存上的差异。然而我们的研究属于回顾性分析,统计分析不能完全避免鼻咽癌患者的选择偏倚,有一定的局限性。未来需要进行多中心和大样本的前瞻性研究,来证实Ki67的表达对LA-NPC新辅助化疗疗效的预测作用。本研究推荐瘤体Ki67表达水平在LA-NPC患者对IC+CCRT和单纯CCRT方案的选择中可作为预测指标。
作者声明:本文全部作者对于研究和撰写的论文出现的不端行为承担相应责任;并承诺论文中涉及的原始图片、数据资料等已按照有关规定保存,可接受核查。
学术不端:本文在初审、返修及出版前均通过中国知网(CNKI)科技期刊学术不端文献检测系统的学术不端检测。
同行评议:经同行专家双盲外审,达到刊发要求。
利益冲突:所有作者均声明不存在利益冲突。
文章版权:本文出版前已与全体作者签署了论文授权书等协议。

