外源添加木质素对农田土壤微生物的影响
孙敬文 尹晗 安雪晖 何世钦3 孙月 陈禹竹


摘要 [目的]研究木質素对土壤微生物的影响,为木质素后期的资源化利用提供一定的基础资料。[方法]采集农田土壤进行培养试验,设置空白对照和木质素处理组,培养结束后提取土壤DNA,结合定量PCR和高通量测序等技术,研究木质素对土壤微生物的影响,对微生物的群落组成及多样性进行分析。[结果]定量PCR结果表明,木质素的加入减少了细菌16S rRNA基因丰度,且显著降低了真菌18S rRNA基因丰度。高通量测序结果显示,Alpha多样性分析上,细菌的空白对照多样性指数均高于木质素处理,真菌则相反,但均未达显著水平;PCoA分析表明,木质素的加入对细菌和真菌群落均产生了显著影响,不同处理间的群落结构差异较大。在门水平上对微生物群落组成分析表明,木质素的加入显著提高了细菌中γ-变形菌、拟杆菌、厚壁菌的相对丰度,降低了酸杆菌、放线菌、δ-变形菌的相对丰度;真菌中明显增加了担子菌、被孢霉菌的相对丰度,而降低了子囊菌的相对丰度。[结论]木质素的加入对土壤中细菌、真菌的数量及群落结构均产生了一定影响。总体上,木质素不利于土壤微生物群落的生长繁殖和代谢。由于对木质素的利用能力不同,不同微生物呈现出了不同的效果。
关键词 木质素;土壤微生物;定量PCR;高通量测序
中图分类号 S 154.3 文献标识码 A 文章编号 0517-6611(2021)18-0156-05
doi:10.3969/j.issn.0517-6611.2021.18.038
开放科学(资源服务)标识码(OSID):
Effect of Exogenous Lignin on Farmland Soil Microorganisms
SUN Jing-wen1,YIN Han1,AN Xue-hui2 et al
(1. PowerChina Roadbridge Group Co., Ltd., Beijing 100048; 2. School of Civil Engineering, Tsinghua University, Beijing 100084)
Abstract [Objective] To study the effect of lignin on soil microorganisms, and to provide some basic information for the utilization of lignin as a resource in future. [Method] Collecting the farmland soil for cultivation experiment, control group and lignin treatment group were set up. Soil DNA was extracted after cultivation. Combined with methods such as quantitative PCR and high-throughput sequencing, the effects of lignin on the composition and diversity of soil microorganism and communities were studied. [Result] Quantitative PCR results showed that the addition of lignin reduced the gene expression abundance of bacterial 16S rRNA, and reduced the abundance of fungal 18S rRNA gene expression significantly. The results of high-throughput sequencing showed that in the Alpha diversity analysis, the diversity index of bacteria for the control group was higher than that of lignin treatment group, while that of fungi was the opposite, but they did not reach a significant level. The PCoA analysis showed that the addition of lignin had an effect on bacteria and fungi. The communities all had a significant impact, and the community structure differed greatly among different treatments. The analysis of the microbial community composition at the phylum level showed that the addition of lignin significantly increased the relative abundance of Gammaproteobacteria, Bacteroides, and Firmicutes for the bacteria, and reduced Acidobacteria, Actinobacteria, and Deltaproteobacteria. For the fungi, the relative abundance of Basidiomycota and Mortierellomycota was increased significantly, but the relative abundance of Ascomycota was decreased. [Conclusion] The addition of lignin has a certain impact on the copy number of microorganisms and community structure of bacteria and fungi in the soil. On the whole, lignin is not conducive to the growth and metabolism of soil microbial communities. Due to the different utilization capacity of lignin, some microorganisms show different effects.
Key words Lignin;Soil microorganism;Quantitative PCR;High-throughput sequencing
基金项目 中电建路桥集团有限公司科技项目“海绵型城市广场透水铺装与雨水花园关键技术开发”。
作者简介 孙敬文(1983—),男,山东德州人,工程师,从事岩土工程管理研究。*通信作者,硕士,从事环境微生物研究。
收稿日期 2021-01-08
土壤微生物是土壤生态系统的重要组成部分,在土壤有机质分解、土壤营养转化和循环、植物生长的促进或抑制以及各种土壤物理过程中,发挥重要作用[1]。土壤微生物在生态系统物质循环和能量转化中占有重要地位,当土壤环境发生变化时,微生物能快速作出反应,是土壤环境质量评价不可缺少的重要生物学指标[2]。土壤微生物会与所种植物根系形成一个稳定的动态系统,在这个系统中它们相互作用、相互影响。植物根系为土壤微生物提供养分,土壤微生物反过来也促进植物根系的发育,从而促进了植物的生长[3]。合理利用土壤微生物,充分发挥土壤微生物的优势,对促进植物生长、提高作物产量的作用是不可估量的。
木质素是一种存在于大部分陆地植物木质部中的复杂
高分子化合物,是植物骨架的主要成分,在自然界非常丰富,在数量上仅次于纤维素[4]。木质素的来源非常广泛,由于其是植物的主要成分,我国又是一个农业大國,每年会产生大量的植物纤维性废弃物,包括秸秆、杂草、落叶等,都含有木质素[5]。工业木质素的来源主要是纸浆生产的副产物,分为碱木质素和木质素磺酸盐两大类[6]。近年来,人们开始逐渐开发和利用木质素,已发现木质素可以作为土壤的改良剂和修复剂[7],也可以作为肥料与氮肥配施[8]。另外,其作为共代谢底物时,也可以刺激土壤微生物促进多环芳烃污染物的降解[9]。但目前,人们对木质素的利用才开始,利用率仍较低,在实际修复及应用中也存在一定的局限性[9-10]。因此全面了解木质素的作用机制,以及更合理地利用木质素对农业生产和环境保护都具有重要意义。笔者通过设立培养试验,添加木质素处理组,并利用定量PCR和高通量测序等技术,研究外源添加木质素对土壤微生物基因丰度、群落组成及多样性的影响,评估木质素对土壤微生物的影响,以期为后续木质素的资源化利用提供基础资料。
1 材料与方法
1.1 土壤样品
采集江苏省南京市西南郊农田表层土壤,土样放置于室温下自然风干,过2 mm筛。土壤基本理化性质:pH 6.84,有机质含量12.7 g/kg,总氮1.3 g/kg,全磷0.57 g/kg,全钾19.3 g/kg。
1.2 主要试剂与仪器
碱木质素(Lignin),美国Sigma-Aldrich试剂公司;引物,上海英骏生物技术有限公司;FastDNA SPIN Kit for Soils试剂盒,美国MP Biomedicals公司;Top Green qPCR SuperMix(SYBR Green),北京全式金生物技术有限公司。
荧光定量基因扩增仪,德国Analytik Jena公司;NanoDrop超微量分光光度计,美国Thermo Fisher公司;Illumina MiSeq高通量测序由上海美吉生物医药科技有限公司完成。
1.3 试验设计
利用黑麦草盆栽进行培养试验,设置空白对照组和木质素处理组,每个处理4个重复。每盆加入2 kg土壤,处理组在土壤中加入木质素,充分混匀使其终浓度为8 g/kg。培养90 d后,收集土壤样品,每盆用不锈钢土钻随机取5个点混合,置于-20 ℃保存以供微生物分析。
1.4 土壤DNA提取
取0.5 g土壤,使用FastDNA SPIN Kit for Soils试剂盒,按照试剂盒说明书进行操作。并用NanoDrop仪器测定DNA的浓度和纯度,提取完成后保存于-20 ℃。
1.5 定量PCR
采用定量PCR方法测定样品中细菌16S rRNA基因和真菌18S rRNA基因。土壤样品总DNA稀释至10-1浓度,作为定量模板,定量PCR反应体系(20 μL):Top Green qPCR SuperMix(SYBR Green)10 μL,正、反向引物(10 μmol/L)各0.4 μL,ddH 2O 7.2 μL,模板DNA 2.0 μL。采用细菌16S rRNA基因序列PCR通用引物Eub338F(5′-ACTCCTACGGGAGGCAGCAG-3′)和Eub518R(5′-ATTACCGCGGCTGCTGG-3′)[11],扩增目的片段。定量PCR扩增程序:95 ℃ 3 min;95 ℃ 30 s,56 ℃ 30 s,72 ℃ 30 s,35 个循环;72 ℃ 10 min。采用真菌18S rRNA基因序列PCR通用引物nu-SSU-0817(5′-TTAGCATGGAATAATRRAATAGGA-3′)和nu-SSU-1536(5′-ATTGCAATGCYCTATCCCCA-3′)[12],扩增目的片段。定量PCR扩增程序:94 ℃ 3 min;94 ℃ 30 s,53 ℃ 30 s,72 ℃ 30 s,35 个循环;72 ℃ 10 min。
1.6 高通量测序数据分析
高通量测序得到的原始数据使用QIIME(V1.9.1)和USEARCH(V8.1.1861)流程进行分析,序列经拼接、过滤和质控后,在97%相似性水平划分操作分类单元(operational taxonomic unit,OTU),细菌序列通过与SILVA数据库(https://www.arb-silva.de)比对确定系统学分类,真菌序列通过与Unite数据库(http://unite.ut.ee/)比对确定系统学分类,得到每个样品的OTUs和物种注释的基本分析结果,同时对物种注释在各个分类水平上进行组成结构的统计分析。再对OTUs丰度、多样性指数等进行分析。
1.7 数据分析
试验数据采用SPSS 20、Graphpad Prism 8.0,Excel 2016和R-Studio进行整理、分析及作图。
2 结果与分析
2.1 基因丰度
定量PCR测定结果见图1。2种处理中,细菌16S rRNA的基因拷贝数均在1.6×109 copies/g左右,木质素处理下的细菌16S rDNA基因拷贝数略少于对照,但未达显著水平;对照处理中的真菌18S rRNA基因拷贝数为8.43×106 copies/g,木质素处理下的真菌18S rRNA基因拷贝数为3.78×106 copies/g,木质素处理显著降低了真菌18S rRNA基因拷贝数。
2.2 微生物群落分析
在细菌16S rRNA基因的高通量测序中,2种处理8个样品一共获得20万条序列,经质量控制,单个样品的序列数在11 920~36 307,在97%序列相似性水平获得9 139个OTU。在真菌18S rRNA基因的高通量测序中,2种处理8个样品一共获得45万条序列,经质量控制,单个样品的序列数在42 154~73 266,在97%序列相似性水平获得1 750个OTU。
2.2.1 微生物群落的Alpha多样性分析。
对2种处理的样品在97%相似性阈值水平下的Alpha多样性分析指数进行统计,结果见图2。对2种处理得到的细菌Alpha多样性分析发现,木质素处理下各样品的多样性指数均小于空白对照。而真菌Alpha多样性分析则相反,木质素处理下各样品的多样性指数均高于空白对照。2组样品均未达显著水平。
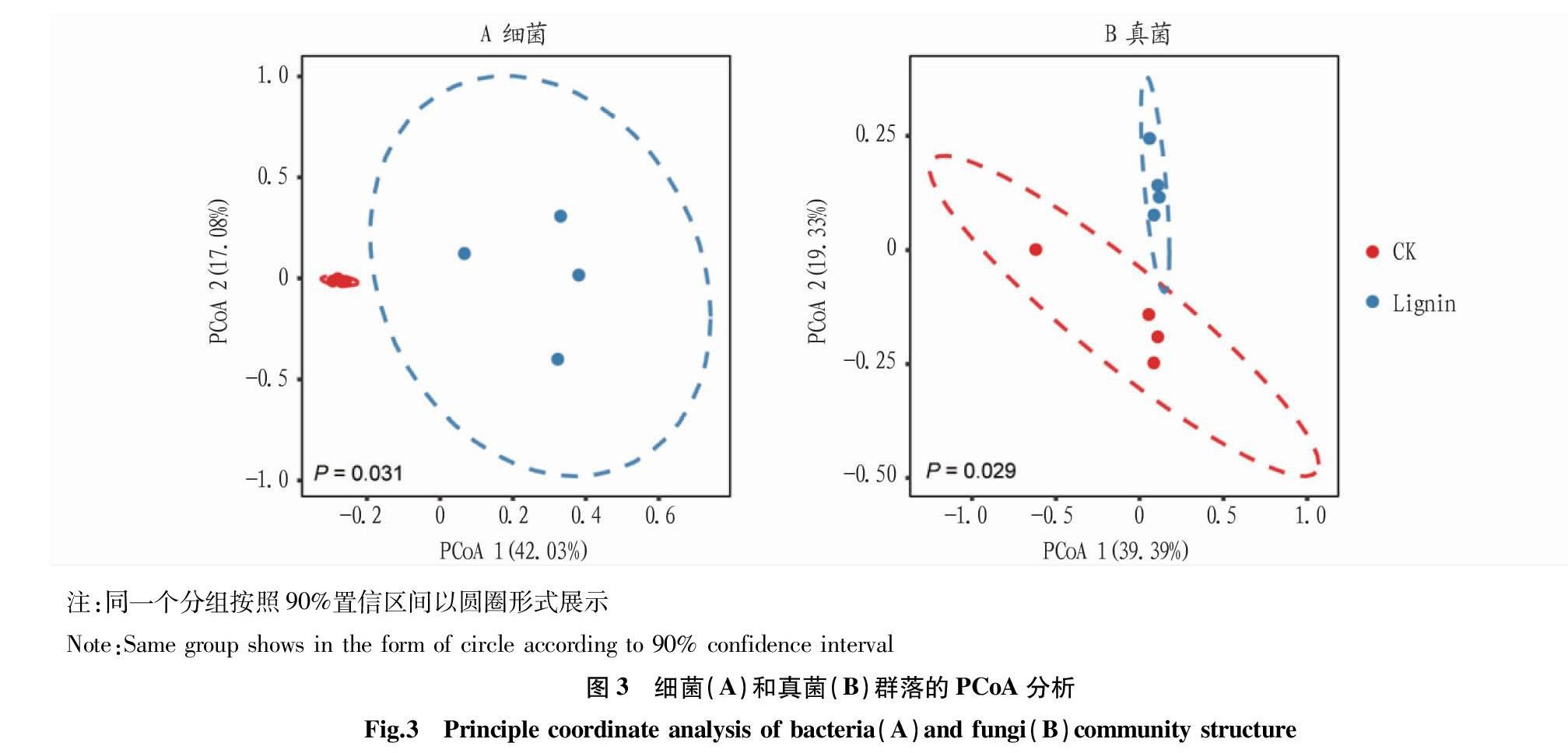
2.2.2 微生物群落的PCoA分析。
在OUT水平上基于Bray-Curtis距离对对照组与木质素处理组进行了PCoA分析。由图3可知,细菌群落中,对照组的样品能够紧密地聚集在一起,且明显与木质素处理的样品分开(P<0.05);真菌群落中对照组与木质素处理组的样品分布较为集中,且2组样品能明显地分开(P<0.05)。木质素的加入使微生物的群落组成发生了变化,说明木质素会对微生物群落产生影响。
2.2.3 微生物在门水平上的相对分布。
对细菌中相对丰度大于1%的门进行分析,结果见图4A。在对照处理中,主要细菌门类包括γ-变形菌(Gammaproteobacteria)、酸杆菌(Acidobacteria)、α-变形菌(Alphaproteobacteria)、放线菌(Actinobacteria),分别占24.28%、21.75%、14.73%、9.61%。加入木质素的处理明显提高了γ-变形菌、拟杆菌(Bacteroidetes)、厚壁菌(Firmicutes)的相对丰度,分别达45.73%、8.77%、3.14%;明顯降低了土壤中酸杆菌、放线菌、δ-变形菌(Deltaproteobacteria)的相对丰度,分别为12.14%、4.06%、2.93%。
对真菌中相对丰度大于2%的门进行分析,结果见图4B。在对照处理中,主要真菌门类包括子囊菌(Ascomycota)、被孢霉菌(Mortierellomycota)、梳霉菌(Kickxellomycota)、担子菌(Basidiomycota),分别占比73.38%、14.09%、4.73%、2.35%。木质素的加入明显增加了担子菌、被孢霉门的相对丰度,达12.37%、20.32%;降低了子囊菌的相对丰度,为55.13%。
2.2.4 LefSe分析。
将木质素处理与对照处理进行LefSe分析,结果见图5。图中的结点从内圈至外圈代表细菌的各分类水平(界、门、纲、目、科、属),不同颜色代表在各自处理中显著富集的菌属。木质素处理与对照处理相比,其显著富集的结点达109个,包含53个变形菌、20个拟杆菌、19个厚壁菌、8个酸杆菌、5个BRC1、2个Armatimonadetes、2个Nitrospirae。其中相对丰度大于1%的科(Family)主要包括Burkholderiaceae、Methylophilaceae、Pseudomonadaceae、Prolixibacteraceae、Lentimicrobiaceae、Koribacteraceae、Enterobacteriaceae等,在木质素处理中分别占比13.84%、4.82%、4.72%、2.07%、1.94%、1.58%、1.55%、1.47%、1.39%、1.01%。
3 结论与讨论
土壤微生物是土壤中的主要成分,它们参与土壤有机质分解、腐殖质合成、养分转化等重要过程。木质素可以用作土壤改良剂、修复剂和肥料等,也被认为是具有修复潜力的污染土壤生物刺激材料。该研究通过盆栽培养试验,对空白对照和木质素处理的土壤微生物进行了研究。
结果表明,木质素的加入对细菌、真菌的数量以及群落结构均产生了一定的影响。木质素降低了细菌的基因丰度,且显著降低了真菌的基因丰度。木质素对细菌和真菌的数量显示出抑制作用,对细菌和真菌的群落结构也产生了很大的影响。张杰[13]利用Biolog Eco板法研究了木质素等5种处理对土壤微生物的影响,结果发现木质素会对土壤微生物性状和生化功能产生抑制作用,不利于土壤微生物的繁殖和代谢。
从微生物群落分析可以看出,木质素对一些微生物产生抑制作用的同时,也促进了部分微生物的快速生长和繁殖。结果发现,木质素明显提高了细菌中γ-变形菌、拟杆菌、厚壁菌的相对丰度和真菌中担子菌、被孢霉菌的相对丰度,这可能与木质素的降解过程有关。已发现细菌γ-变形菌纲假单孢菌属(Pseudomonas),如Pseudomonas putida[14],厚壁菌门芽孢杆菌属(Bacillus),如Bacillus atphaeus[15]、Bacillus ligniniphilus[16]等具有木质素降解能力。通过LefSe的分析,发现木质素处理显著富集了Burkholderiaceae、Methylophilaceae、Pseudomonadaceae、Prolixibacteraceae、Lentimicrobiaceae、Koribacteraceae、Enterobacteriaceae等细菌,其中Burkholderiaceae和Methylophilaceae已被证实属于甲基营养菌[17-19],也可能参与木质素的自身代谢过程,是木质素的潜在降解菌。真菌是迄今为止发现的参与木质素代谢的最活跃微生物,根据真菌对木质素的降解类型可以分为白腐菌(Phanerochaetc chrysosporium)、褐腐菌(Cyathus stecoreus)和软腐菌(Erwinia carotovora)[20],白腐菌[21]和褐腐菌[22]属于担子菌纲,而软腐菌多属于子囊菌纲。木质素的加入可能促进了能利用这类碳源的潜在降解菌的富集,显著提高了这部分微生物的丰度。
另一方面,由于这类降解菌的富集,促进了土壤中木质素的分解,木质素结构复杂含有多种活性官能团,其在分解过程中会产生大量酚酸类等小分子物质[23-24],这类物质常被认为是会对植物自身产生毒害作用的自毒物质[25],这些物质会在土壤中与微生物互作,进而改变土壤生態环境,这类物质的产生可能也是导致部分微生物群落丰度减少的原因。尹淇淋等[26]研究发现,酚酸类物质的自毒作用会影响土壤微生物活性和土壤理化性质,刘晓珍等[27]研究发现菊花连作障碍引起的酚酸物质的积累会对土壤微生物产生影响,使微生物区系发生改变。
此外,笔者所在课题组在前期试验过程中发现,木质素的加入会导致土壤一定程度的板结,这一现象会影响土壤的吸水、吸氧、营养物质吸附和通透能力等,会使土壤中的好气性微生物的活动受到抑制,影响这部分微生物的生长和代谢。
目前,对木质素的研究仍存在一定的局限性,今后研究中可采用在种的水平上对土壤微生物的群落组成进行分析,进一步研究木质素对土壤微生物的作用,为木质素的资源化利用提供更多的科学依据。
参考文献
[1] PIGNATARO A,MOSCATELLI M C,MOCALI S,et al.Assessment of soil microbial functional diversity in a coppiced forest system[J].Applied soil ecology,2012,62:115-123.
[2] 张超兰,徐建民.外源营养物质对表征土壤质量的生物学指标的影响[J].广西农业生物科学,2004,23(1):81-85.
[3] 吴建峰,林先贵.土壤微生物在促进植物生长方面的作用[J].土壤,2003,35(1):18-21.
[4] 刘宁,何红波,解宏图,等.土壤中木质素的研究进展[J].土壤通报,2011,42(4):991-996.
[5] 金永灿.工业木质素的开发利用[J].林业科技开发,2002,16(3):9-10.
[6] 孙桂芳,金继运,石元亮.腐殖酸和改性木质素对土壤磷有效性影响的研究进展[J].土壤通报,2011,42(4):1003-1009.
[7] 朱兆华,王德汉,廖宗文,等.改性造纸黑液木质素——氨氧化木质素(AOL)作为缓释氮肥的肥效研究[J].农业环境保护,2001,20(2):98-100,119.
[8] WU Y C,DING Q M,ZHU Q H,et al.Contributions of ryegrass,lignin and rhamnolipid to polycyclic aromatic hydrocarbon dissipation in an arable soil[J].Soil biology and biochemistry,2018,118:27-34.
[9] 张野,何铁光,何永群,等.农业废弃物资源化利用现状概述[J].农业研究与应用,2014(3):64-67,72.
[10] 梁国治,李广学,孙文娟.木质素在农业中的研究进展[J].应用化工,2006,35(1):1-3,6.
[11] FROSSARD A,GERULL L,MUTZ M,et al.Disconnect of microbial structure and function:Enzyme activities and bacterial communities in nascent stream corridors[J].The ISME Journal,2012,6(3):680-691.
[12] BORNEMAN J,HARTIN R J.PCR primers that amplify fungal rRNA genes from environmental samples[J].Applied and environmental microbiology,2000,66(10):4356-4360.
[13] 张杰.秸秆、木质素及生物炭对土壤有机碳氮和微生物多样性的影响[D].北京:中国农业科学院,2015.
[14] SUN J,WANG Q Z,JIANG Y,et al.Genome editing and transcriptional repression in Pseudomonas putida KT2440 via the type II CRISPR system[J].Microbial cell factories,2018,17(1):1-17.
[15] HUANG X F,SANTHANAM N,BADRI D V,et al.Isolation and characterization of lignin-degrading bacteria from rainforest soils[J].Biotechnology and bioengineering,2013,110(6):1616-1626.
[16] ZHU D C,ZHANG P P,XIE C X,et al.Biodegradation of alkaline lignin by Bacillus ligniniphilus L1[J].Biotechnology for biofuels,2017,10(1):1-14.
[17] KALYUZHNAYA M G,HRISTOVA K R,LIDSTROM M E,et al.Characterization of a novel methanol dehydrogenase in representatives of Burkholderiales:implications for environmental detection of methylotrophy and evidence for convergent evolution[J].Journal of bacteriology,2008,190(11):3817-3823.
[18] 付春霞,付云霞,邱忠平,等.木质素生物降解的研究进展[J].浙江农业学报,2014,26(4):1139-1144.
[19] 晁红军,宋修鹏,孙继华,等.甲基营养菌的研究进展[J].微生物学通报,2009,36(11):1727-1737.
[20] 梁丛颖,林璐.环境微生物介导的木质素代谢及其资源化利用研究进展[J].微生物学通报,2020,47(10):3380-3392.
[21] CAPELARI M,ZADRAZIL F.Lignin degradation and in vitro digestibility of wheat straw treated with Brazilian tropical species of white rot fungi[J].Folia microbiologica,1997,42(5):481-487.
[22] ABBOTT T P,WICKLOW D T.Degradation of lignin by Cyathus species[J].Applied and environmental microbiology,1984,47(3):585-587.
[23] KAMIMURA N,TAKAHASHI K,MORI K,et al.Bacterial catabolism of lignin-derived aromatics:New findings in a recent decade:Update on bacterial lignin catabolism[J].Environmental microbiology reports,2017,9(6):679-705.
[24] BLUM U.Effects of microbial utilization of phenolic acids and their phenolic acid breakdown products on allelopathic interactions[J].Journal of chemical ecology,1998,24(4):685-708.
[25] 王闖,徐公义,葛长城,等.酚酸类物质和植物连作障碍的研究进展[J].北方园艺,2009(3):134-137.
[26] 尹淇淋,谢越.酚酸类物质导致植物连作障碍的研究进展[J].安徽农业科学,2011,39(34):20977-20978,20985.
[27] 刘晓珍,肖逸,戴传超.盐城药用菊花连作障碍形成原因初步研究[J].土壤,2012,44(6):1035-1040.

