木犀草素对兔耳增生性瘢痕抑制作用机制的初步研究
李泰平 肖红

[摘要]目的:初步研究木犀草素对兔耳增生性瘢痕的抑制作用及可能机制。方法:9只新西兰兔随机分为空白组、生理盐水对照组和药物干预组,每组3只,生理盐水对照组和药物干预组建立兔耳增生性瘢痕模型,每只兔左右耳各3個直径约0.7cm瘢痕创面,相距约1cm。生理盐水对照组给予生理盐水,药物干预组给予木犀草素乳膏,瘢痕组织于给药前和给药后40d取材,Masson染色后显微镜下观察各组瘢痕组织的病理变化,ELISA法检测瘢痕组织中转化生长因子-β(TGF-β)、血小板衍化生长因子(PDGF-BB)、结缔组织生长因子(CTGF)的含量,qRT-PCR和Western Blot法检测TGF-β、Ⅰ型胶原蛋白(Collagen Ⅰ)和基质金属蛋白酶-2(MMP-2)的表达水平。结果:Masson染色显示木犀草素干预后瘢痕组织中胶原沉积减少,胶原纤维致密且排列规则。与生理盐水对照组相比,药物干预组瘢痕组织中TGF-β、PDGF-BB、CTGF的表达明显减少,差异有统计学意义(P<0.05)。此外,qRT-PCR和Western Blot结果显示,与生理盐水对照组相比,药物干预组MMP-2表达升高,而Collagen Ⅰ表达水平明显降低,差异有统计学意义(P<0.05)。结论:木犀草素能够抑制兔耳增生性瘢痕的形成,其作用机制可能与抑制TGF-β、PDGF-BB、CTGF的分泌、上调MMP-2、减少Collagen Ⅰ的表达有关。
[关键词]木犀草素;增生性瘢痕;兔耳模型;机制研究
[中图分类号]R619+.6 [文献标志码]A [文章编号]1008-6455(2021)08-0091-04
Preliminary Study on the Inhibitory Mechanism of Luteolin on Hypertrophic Scar in Rabbit Ear
LI Tai-ping,XIAO Hong
(Neuro-Psychiatric Institute,Affiliated Brain Hospital,Nanjing Medical University,Nanjing 210029,Jiangsu,China)
Abstract: Objective To reveal the inhibitory effect of luteolin and its mechanism on hypertrophic scar formation in rabbit ears. Methods 9 New Zealand rabbits were randomly divided into 3 groups: the blank group, the normal saline control group and the drug intervention group, with 3 rabbits in each group. Hypertrophic scar model was established in rabbit ears in the normal saline control group and the drug intervention group. Before and forty days after treatment, the pathological changes of the scar tissues were examined, and the collagen fibers hyperplasia were observed with Masson staining. The expression levels of TGF-β, PDGF-BB, CTGF were quantified by ELISA. In addition, TGF-β, Collagen Ⅰand MMP-2 were separately detected by quantitative real-time PCR (qRT-PCR) assay and Western Blot. Results Masson staining showed that collagen deposition was significantly reduced after luteolin treatment, collagen fibers were also dense and arranged regularly. ELISA results indicated that the expression levels of TGF-β, PDGF-BB and CTGF were obviously reduced in the drug intervention group compared to the the normal saline control group, the differences were statistically significant (P<0.05). In addition, the results of qRT-PCR and Western blot showed that compared with the normal saline control group, the expression of MMP-2 in the drug intervention group increased, while the expression level of Collagen Ⅰ decreased significantly (P<0.05). Conclusion Luteolin could inhibit the formation of hypertrophic scar in rabbit ears, and its mechanism may be related to the inhibition of TGF-β、the secretion of PDGF-BB and CTGF was related to the up regulation of MMP-2 and the decrease of collagen Ⅰ expression in vivo.
Key words: luteolin; hypertrophic scar; rabbit ear model; mechanism research
增生性瘢痕是创伤后愈合过程中,组织过度修复而导致的病理产物,其发生机制至今尚未完全明确。最新研究已表明成纤维细胞(Fibroblast,FB)凋亡的减少和过度增殖在增生性瘢痕形成进程中起到非常重要的作用[1]。目前临床治疗主要采用整形外科手术、加压、瘢痕内激素注射、冷冻、激光和应用硅制剂等疗法,但效果均不太理想[2-3]。因此,抑制和治疗增生性瘢痕的研究很有临床意义。笔者前期研究发现加味小陷胸中药配方颗粒能够抑制兔耳增生性瘢痕的形成[4],该汤剂配方中的主要活性成分之一木犀草素是一种黄酮类中药单体,存在于多种蔬菜和药用植物中,具有多种药理学作用,包括抗肿瘤、抗氧化、抗炎、保护神经系统等[5]。目前关于木犀草素抑制增生性瘢痕的研究还未见报道,本实验初步探讨了外用木犀草素乳膏对兔耳增生性瘢痕防治作用的机制,为其临床应用提供理论和实践依据。
1 材料和方法
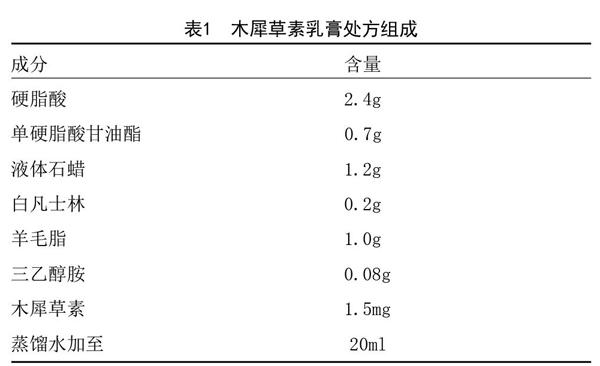
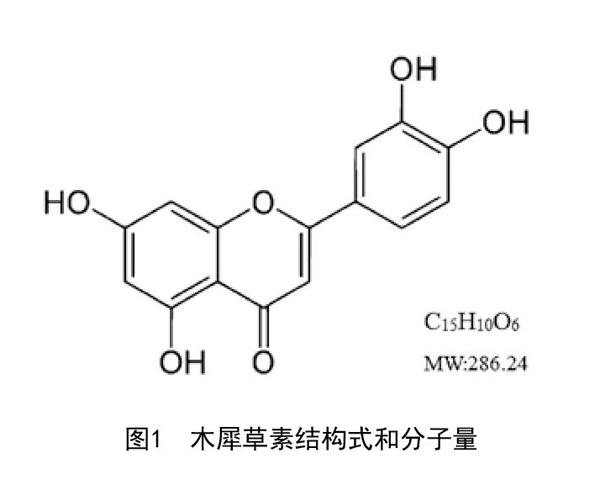
1.1 药品和试剂:木犀草素乳膏(20ml:1.5mg,批号:20160131,处方組成见表1,木犀草素的结构式和分子量见图1)由安徽医科大学汤继辉教授提供,冷藏保存在避光的容器中。兔子转化生长因子β(Transforming growth factor-β,TGF-β)酶联免疫分析试剂盒(批号:0028093)、兔结缔组织生长因子(Connective tissue growth factor,CTGF)酶联免疫分析试剂盒(批号:027940)、兔血小板衍生生长因子BB(Platelet-derived growth factor-BB,PDGF-BB)酶联免疫分析试剂盒(批号:0023006)均购自南京迅贝生物科技有限公司。TGF-β(批号:21898-1)、Collagen I(批号:14695-1)、MMP-2(批号:10373-2)多克隆抗体均购自于美国Proteintech公司。QuantiFast SYBR? Green PCR Kit试剂盒(包含HotStart DNA Polymerase、SYBR Green I、dNTPs、Mg2+以及优化的缓冲体系,批号:204057)均购自德国Qiagen公司。
1.2 主要实验仪器:光学显微镜(日本Olympus公司),超纯水仪(美国Millpore公司),超低温冰箱(日本Sanyo公司),多功能酶标仪(美国Bio-Tek公司),电泳槽(美国Bio-Rad公司),核酸蛋白分析仪(美国Beckman公司),qRT-PCR仪(美国Bio-Rad公司),凝胶成像分析系统(美国Bio-Rad公司),以及手术器械、兔专用固定箱和动物实验操作台。
1.3 实验动物:新西兰大耳朵白兔,清洁级,兔龄3~4个月,雌雄不限,共9只,体重(2.5±0.2)kg,购自南京市江宁区青龙山动物中心,许可证号:SCXK(苏)2012-0008,动物合格证号:NO.201603875。所有兔均混合分笼人工饲养,环境温度为20℃~22℃、相对湿度约为50%,人工混合饲料饲养1周后进行实验。本实验按南京医科大学动物实验伦理要求操作,批准编号:IACUC-1601056。
1.4 实验方法
1.4.1 兔耳腹创面造模:将兔固定于专用固定箱,戊巴比妥耳缘静脉麻醉后,在兔耳腹侧沿长轴避开血管,制作直径为0.7cm圆形创面,完整切除全层皮肤,彻底刮除软骨膜,保留软骨,创面不予任何处理,任其自然愈合(见图2B)。每只兔左右耳腹侧各制备3个创面,各创面间距约为1.0cm。术后自由进食、饮水,1周内注意观察防止结痂造成兔子撕咬感染。若术后发现创面感染,局部及时给予碘伏消毒。待创面结痂后,碘酊消毒后将痂皮揭除,创面自然愈合,所有兔耳患区上皮化完成后兔耳增生性瘢痕模型建立。
1.4.2 分组与给药:配制的木犀草素乳膏浓度为75μg/ml,张丽宏等[6]研究发现木犀草素在浓度20μM时对UVB照射成纤维细胞Ⅰ型胶原表达的逆转作用最强,等量换算浓度约为5.7μg/ml。周宵楠等[7]应用木犀草素体外抗炎结果显示木犀草素的药物安全范围为≤8μg/ml,因此本实验用药浓度设为7.5μg/ml,给药量约0.2ml。
3只兔为空白组(不做任何处理),6只兔创面完全上皮化后随机分为生理盐水对照组和药物干预组(给予木犀草素乳膏7.5μg/ml外涂约0.2ml治疗,每个创面约1.5μg木犀草素的用药量,一天两次,见图2C),每组3只兔、6只耳朵、18个创面。于术后第32天开始给药,共给药40d,分别在给药前和给药后40d取样本组织,观察各组瘢痕组织的外观形态变化,切取各组瘢痕组织,将所取组织从顶部均分为两份,一半作Masson染色,另一半作分子生物学检测。
1.4.3 ELISA实验:按照ELISA试剂盒说明书要求检测兔耳组织中TGF-β、PDGF-BB、CTGF的含量。每50mg瘢痕组织中加入1ml PBS(pH=7.4),匀浆后4℃离心(12 000r/min)10min后收集上清液。取上清液与相应的免疫试剂孵育30min,洗涤孔5次。最后将底物溶液孵育30min,在450nm波长下测定其吸光度。
1.4.4 Western Blot实验:兔耳瘢痕组织生理盐水洗净后粉碎成粉末。应用radioimmunoprecipitation assay(RIPA)裂解缓冲液提取蛋白后,加入phenylmethylsulfonyl fluoride (PMSF),0℃下孵育30min,然后离心(12 000r/min,4℃,20min),收集上层清液。蛋白电泳使用十二烷基硫酸钠-聚丙烯酰胺凝胶进行,用5%脱脂牛奶稀释兔抗体溶液后置摇床摇1h。加入一抗(anti-TGF-β,anti-Collagen Ⅰ,anti-MMP-2,anti-β-actin)4℃孵育过夜。取出PVDF膜Tris Buffered saline Tween (TBST)洗净后加入用5%脱脂牛奶稀释后的二抗溶液,孵育1h,用TBST洗涤3次后使用ECL混合溶液曝光,Molecular Imager Gel DocXR成像。
1.4.5 qRT-PCR实验:应用实时荧光定量PCR检测TGF-β、Collagen Ⅰ和MMP-2表达。按照试剂说明书提取各组细胞总RNA。引物设计原始序列来自Primer Bank (https://pga.mgh.harvard.edu/primerbank/index.html),序列为:TGF-β:正向引物5'-CTCCCGTGGCTTCTAGTGC-3',反向引物5'-GCCTTAGTTTGGACAGGATCTG-3';Collagen Ⅰ:正向引物5'-GCTCCTCTTAGGGGCCACT-3',反向引物5'-CCACGTCTCACCATTGGGG-3';MMP-2:正向引物5'-TGTGTCTTCCCCTTCACTTTTC-3',反向引物5'-CATCATCGTAGTTGGTTGTGGT-3';β-actin:正向引物5'-TGACATCAAGAAGGTGGTGA-3',反向引物5'-TCATACCAGGAAATGAGCT-3',均由武汉谷歌生物科技有限公司提供。采用β-actin作为内参,根据每个样本扩增曲线的Ct值进行相对定量,对照组设为1,n为扩增反应的循环次数,△Ctn=Ct目的基因(n)-Ct内参基因(n),△△CTn=△Ctn-△Ct1,采用2-△△CT方法对数据进行分析[8-9]。
1.5 统计学分析:使用SAS软件(9.0版)进行统计分析。计量资料以x?±s表示,组间差异比较采用t检验。P<0.05为差异具有统计学意义;P<0.01为差异极显著。
2 结果
2.1 兔耳瘢痕组织外观:兔耳创面于术后约30d完全愈合并完成上皮化。给药40d后,生理盐水对照组瘢痕增厚明显,相比邻近皮肤中间突出明显,颜色也呈暗红色;药物干预组瘢痕增厚不明显,质软平滑,颜色与邻近皮肤也较接近。见图3。
2.2 Masson染色结果:通过组织切片Masson染色观察,与生理盐水对照组相比,药物干预组的胶原纤维致密,排列规则。与空白组相比,生理盐水对照组和药物干预组微血管数目均明显减少。见图4。
2.3 ELISA、qRT-PCR和Western Blot检测结果:ELISA结果显示,与空白组比较,生理盐水对照组兔耳瘢痕组织中TGF-β、PDGF-BB、CTGF的含量明显升高,而药物干预组瘢痕组织中上述因子的含量显著降低,见图5。qRT-PCR和Western Blot检测结果显示,与空白组比较,生理盐水对照组中TGF-β、Collagen Ⅰ的mRNA和蛋白表达显著升高,MMP-2的mRNA和蛋白的表达明显降低;与生理盐水对照组相比,药物干预组TGF-β、Collagen Ⅰ的mRNA和蛋白表达显著降低,而MMP-2的mRNA和蛋白表达明显升高。因此,木犀草素能够促进MMP-2的表达,而抑制瘢痕组织中TGF-β、Collagen Ⅰ的表达。见图6~7。
3 讨论
皮肤组织损伤后在愈合过程中由于过度修复造成的增生性瘢痕始终是临床上一大难题。伤口愈合是一个复杂的过程,涉及炎症反应、细胞增殖、基质沉积和组织重塑等,其中TGF-β、PDGF-BB、CTGF等细胞因子在瘢痕形成过程中发挥着非常重要的作用[10]。本研究发现兔耳瘢痕组织中TGF-β、PDGF-BB和CTGF含量明显升高,证实增生性瘢痕的形成与上述三种生长因子密切相关,也与相关研究结论一致[11-13]。伤口愈合时组织软化过程中胶原降解与MMP-2等密切相关,MMP-2活性的增加可导致Ⅰ型胶原蛋白的减少[14-15]。TGF-β还可通过上调MMP-2、TIMP-1和TIMP-2等路径影响纤维化进程,进而进一步分解Ⅰ型胶原[16]。既往研究表明,5,7,3',4'羟基取代的黄酮类化合物包括木犀草素、槲皮素、杨梅素等,可明显降低胶原蛋白的表达,还可通过与激活素受体样激酶5(ALK5)结合,选择性地下调TGF-β/Smads信号通路中Smad2/3的磷酸化水平并降低ALK5催化活性,进而抑制成纤维细胞的增殖[17]。在本研究中,木犀草素是否通过MMPs/Collagen和(或)TGF-β/Smads信号通路发挥抑制瘢痕形成还需实验进一步证实。
总之,木犀草素是一种很有前途的抗瘢痕药,发现能显著抑制兔耳增生性瘢痕组织中TGF-β、PDGF-BB和CTGF的分泌,可上调MMP-2、降低I型胶原的表达,其调控的具体机制还需进一步研究。
[参考文献]
[1]Xiao YQ,Xu DY,Song HY,et al.Cuprous oxide nanoparticles reduces hypertrophic scarring by inducing fibroblast apoptosis[J].Int J Nanomedicine,2019,14:5989-6000.
[2]Zhang H,Wang HY,Wang DL,et al.Effect of pressure therapy for treatment of hypertrophic scar[J].Medicine,2019,98(26):e16263.
[3]Lin SQ,Quan GL,Hou AL,et al.Strategy for hypertrophic scar therapy: Improved delivery of triamcinolone acetonide using mechanically robust tip-concentrated dissolving microneedle array[J].J Control Release,2019,306:69-82.
[4]陳玲,李泰平,连娜琦,等.加味小陷胸中药配方颗粒对兔耳增生性瘢痕的抑制作用及其机制研究[J].中国现代应用药学,2019,36(3):307-311.
[5]孙燕,连娜琦,李泰平.抗病理性瘢痕中药单体的应用研究进展[J].中国美容医学,2017,26(6):133-136.
[6]张丽宏,张宁,刘国良,等.金银花有效成分木犀草素对UVB辐射致皮肤光老化保护作用研究[J].中医药学报,2016,44(3):27-29.
[7]周霄楠,韩超,宋鹏琰,等.木犀草素和槲皮素体外抗炎作用研究[J].动物医学进展,2017,38(10):56-61.
[8]Morer A,Chae W,Henegariu O,et al.Elevated expression of MCP-1, IL-2 and PTPR-N in basal ganglia of Tourette syndrome cases[J].Brain Behav Immun,2010,24(7):1069-1073.
[9]Wohlfahrtova M,Tycova I,Honsova E,et al.Molecular patterns of subclinical and clinical rejection of kidney allograft: quantity matters[J].Kidney Blood Press Res,2015,40(3):244-257.
[10]Lian NQ,Li TP.Growth factor pathways in hypertrophic scars: Molecular pathogenesis and therapeutic implications[J].Biomed Pharmacother,2016,84:42-50.
[11]Jensen J,Gentzkow G,Berman G,et al.Anti-CTGF oligonucleotide reduces severity of postsurgical hypertrophic scars in a randomized, double-blind, within-subject, placebo-controlled study[J].Plast Reconstr Surg,2018,142:192e-201e.
[12]Sun GF,Li HC,Zhan YP,et al.SnoN residue (1-366) attenuates hypertrophic scars through resistance to transforming growth factor-β1-induced degradation[J].Lab Invest,2019,99:1861-1873.
[13]Feng Y,Wu JJ,Sun ZL,et al.Targeted apoptosis of myofibroblasts by elesclomol inhibits hypertrophic scar formation[J].EBioMedicine,2020,54:102715.
[14]Kanno E,Tanno H,Masaki A,et al.Defect of interferon γ leads to impaired wound healing through prolonged neutrophilic inflammatory response and enhanced MMP-2 activation[J].Int J Mol Sci,2019,20(22):5657.
[15]Silva-Bertani DCTD,Vileigas DF,Mota GAF,et al.Decreased collagen type Ⅰ is associated with increased Metalloproteinase-2 activity and protein expression of leptin in the myocardium of obese rats[J].Arq Bras Cardiol,2020,115(1):61-67.
[16]Phaosri M,Jantrapirom S,Takuathung MN,et al.Stem Extract exerts antifibrotic effects on human hepatic stellate cells through the inhibition of the TGF-β1-induced SMAD2/3 signaling pathway[J].Int J Mol Sci,2019,20(24):6314.
[17]Zhang YF,Wang J,Zhou SZ,et al.Flavones hydroxylated at 5, 7, 3' and 4' ameliorate skin fibrosis via inhibiting activin receptor-like kinase 5 kinase activity[J].Cell Death Dis,2019,10(2):124-128.
[收稿日期]2020-11-12
本文引用格式:李泰平,肖紅.木犀草素对兔耳增生性瘢痕抑制作用机制的初步研究[J].中国美容医学,2021,30(8):91-94.

