磁敏感成像在帕金森病和血管性帕金森综合征患者中的应用研究
黄碧霞 ,张一攀 ,郭少勇 ,黄丽玉
1.莆田学院附属医院神经内科,福建莆田 351100;2.莆田市第一医院口腔科,福建莆田 351100
血管性帕金森综合征(VP)和帕金森病(PD)是比较常见的中老年人中枢神经系统疾病, 常有类似的肢体强直、运动徐缓,步态笨拙等运动障碍临床表现[1]。 临床工作中,因临床表现的重叠和缺乏神经影像学特异性,二者的鉴别诊断常常是困难的[2]。 黑质纹状体病变可影响VP 对左旋多巴反应率[3],故对黑质纹状体铁沉积的研究可能对疾病诊断具有一定的鉴别意义。 SWI 是MRI 成像中一种特殊系列,可以通过磁敏感性差别,获取磁敏感性强度及相位的数据, 对非血红素铁的成像更加清晰[4],故可评估脑深部组织中铁的沉积,相位图上呈低信号改变。脑微出血(CMBs)的影像学定义为SWI上的小而圆的低密度病变。 CMBs 被证实是由受损的小脑血管泄漏的慢性微出血产物引起的, 其神经放射学分布与其组织学发病机制有关,可能是导致VP 的一个危险因素。 该研究方便收集于2018 年6 月—2020 年6月期间在莆田学院附属医院门诊和住院的PD 患者(30 例)、VP 患者(28 例)和健康同龄老人(28 各)作为对照组为研究对象,比较SWI 检测PD、VP 患者及正常对照者的锥体外系各核团相位值及相应脑区CMBs 的差异, 探索其在PD 与VP 中的诊断和鉴别诊断价值,现报道如下。
1 资料与方法
1.1 一般资料
采用前瞻性研究设计, 方便选取在该院门诊和收治入院的血管性帕金森综合征患者(VP 组)、帕金森病患者(PD 组),同时收集同期来该院体检的健康同龄老人(NC 组)作为对照组为研究对象,其中PD 组30 例(男 13 例,女 17 例),VP 组 28 例(男 15 例,女 13 例),NC 组 28 名(男 13 名,女 15 名),收集入组患者一般资料, 根据世界运动障碍病学会新版帕金森病综合评价量表 (MDS-UPDRS) 对入组患者进行 HoeHn-Yahr 分级。入选PD 组患者:均符合2015 版运动障碍协会帕金森病(PD)临床诊断标准[5],入选VP 组患者:均符合中华医学会神经病学分会帕金森病及运动障碍学组的血管性帕金森综合征的诊断标准[6], 对照组为无以上条件者。 该研究经医院医学伦理委员会批准通过,所有被试者均签署了书面知情通知书。
1.2 影像学检查
采用GE 3.0T MR 扫描仪进行头颅扫描,8 通道头颈联合线圈为接受线圈,MRI 扫描序列包括T1 加权成像 ( T1WI) 、TT2 加权成像 ( T2WI)、 弥散加权成像(DWI)、液体衰减反转恢复(FLAIR)以及SWI 扫描。 SWI扫描参数:TR:68.2 ms,TE:6.06 ms, 翻转角 20°, 回波数:12,层厚:2.0 mm,矩阵:416×356,宽带:31.25 Hz,激励次数 NEX:1。
1.3 CMBs 评估
CMBs 定义为SWI 上圆形或卵圆形的低信号或信号缺失,排除其他伪像造成,直径为2~5 mm ,不超过10 mm[7]。 由 2 名医学影像科医师阅片,根据 SWI 影像结果判断有无 CMBs, 并依据 MARS 量表记录患者CMBs 个数。
1.4 图像处理与数据测量
扫描所取得的图像输入GE aw4.6 工作站,经Functool 软件图像后处理,得到幅度图及相位图,测量椎体外系各核团,即壳核(PUT)、黑质致密带(SNc)、黑质网状带(SNr)、苍白球(Gp)、尾状核(CN)和红核(RN)相位值,所有病例各核团的相位值均采用盲法测量, 测量由2 名医学影像科医师在不同时间独立完成,取两者测量的平均值。
1.5 统计方法
采用SPSS 22.0 统计学软件进行数据分析,计量资料以()表示,进行正态性检验后,组间比较采用单因素方差分析(ANOVA),P<0.05 为差异有统计学意义。
2 结果
2.1 3 组研究对象一般资料及CMBs 比较
PD 组、VP 组和正常对照组进行比较, 各组间性别和年龄差异无统计学意义(P>0.05)。 VP 组 CMBs 数目(7.11±2.657)个与 PD 组(0.53±0.973)个、对照组(0.25±0.585)个比较明显增多,差异有统计学意义(F=155.407,P<0.01),但 PD 组与对照组 CMBs 数目比较,差异无统计学意义(P>0.05)。 见表 1。
表1 PD 组、VP 组和对照组患者年龄及CMBs 比较()

表1 PD 组、VP 组和对照组患者年龄及CMBs 比较()
注:a 与对照组比较,P<0.01;b 与 PD 组比较,P<0.01
一般资料PD 组(n=30)VP 组(n=28) 对照组(n=28)年龄(岁)CMBs(个)66.20±6.370 0.53±0.973 67.61±4.086(7.11±2.657)a,b 64.68±6.177 0.25±0.585
2.2 3 组研究对象锥体外系各核团相位值比较
与 VP 组、对照组比较,PD 组 PUT、SNc、Gp 相位值(-0.409±0.008),(0.038±0.004),(-0.247±0.006)明显减低,差异有统计学意义(P<0.01),而 SNr、CN、RN 无明显减低,差异无统计学意义(P>0.05)。 VP 组与对照组相比,锥体外系各核团差异无统计学意义(P>0.05)。 见表2。
表2 PD 组、VP 组和对照组锥体外系各核团相位值比较()

表2 PD 组、VP 组和对照组锥体外系各核团相位值比较()
注:a 与对照组比较,P<0.01;b 与 VP 组比较,P<0.01
锥体外系核团PD 组(n=30)VP 组(n=28) 对照组(n=28)PUT SNc SNr Gp CN RN(-0.409±0.008)a,b(0.038±0.004)a,b-0.397±0.017(-0.247±0.006)a,b 0.039±0.003-0.118±0.007-0.184±0.010 0.060±0.034-0.393±0.044-0.130±0.004 0.041±0.002-0.120±0.001-0.178±0.009 0.062±0.004-0.392±0.003-0.126±0.008 0.040±0.003-0.120±0.003
2.3 PD 组和VP 组研究对象在不同Hoehn-Yahr 分级锥体外系各核团相位值比较
对PD 患者及 VP 患者进行 Hoehn-Yahr 分级,各级PD 患者 PUT、SNc、Gp 相位值之间差异有统计学意义(P<0.01),见表 3;而 VP 患者 IV 级时才出现 SNc、SNr、Gp 相位值[分别为(0.055±0.001)、(-0.399±0.004)、(-0.136±0.003)]降低,与 I~II 级、III 级比较差异有统计学意义(P<0.01);CN、RN 相位值在各级 PD、VP 患者之间均差异无统计学意义(P>0.05),见表 4。
表3 PD 组不同Hoehn-Yahr 分级锥体外系各核团相位值比较()
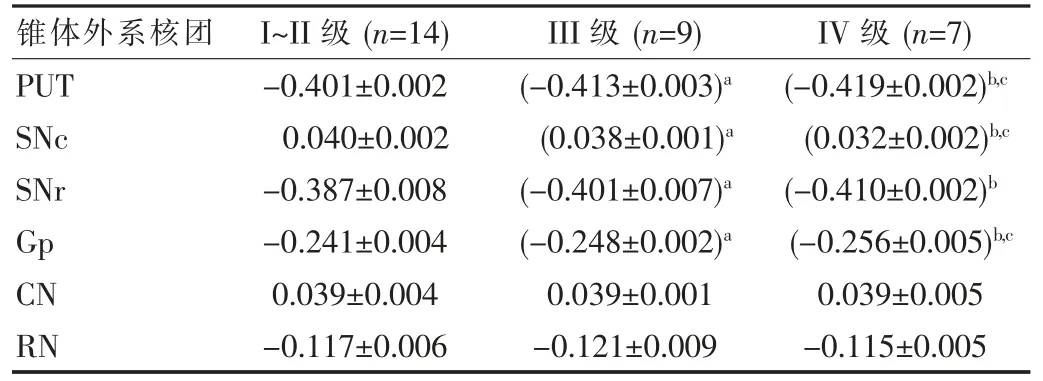
表3 PD 组不同Hoehn-Yahr 分级锥体外系各核团相位值比较()
注:aIII 级与 I~II 级比较,P<0.01;bIV 级与 I~II 级比较,P<0.01;cIV 级与III 级比较,P<0.01
锥体外系核团I~II 级(n=14)III 级 (n=9) IV 级 (n=7)PUT SNc SNr Gp CN RN-0.401±0.002 0.040±0.002-0.387±0.008-0.241±0.004 0.039±0.004-0.117±0.006(-0.413±0.003)a(0.038±0.001)a(-0.401±0.007)a(-0.248±0.002)a 0.039±0.001-0.121±0.009(-0.419±0.002)b,c(0.032±0.002)b,c(-0.410±0.002)b(-0.256±0.005)b,c 0.039±0.005-0.115±0.005
表4 VP 组不同Hoehn-Yahr 分级锥体外系各核团相位值比较()

表4 VP 组不同Hoehn-Yahr 分级锥体外系各核团相位值比较()
注:aIII 级与 I~II 级比较,P<0.01;bIV 级与 I~II 级比较,P<0.01;cIV 级与III 级比较,P<0.01
锥体外系核团I~II 级(n=13)III 级 (n=8) IV 级 (n=7)PUT SNc SNr Gp CN RN-0.175±0.005 0.623±0.002-0.390±0.002-0.128±0.002 0.040±0.019-0.120±0.002(-0.190±0.002)a(0.060±0.001)a-0.390±0.003-0.127±0.002 0.041±0.003-0.120±0.001(-0.194±0.005)b(0.055±0.001)b,c(-0.399±0.004)b,c(-0.136±0.003)b,c 0.041±0.001-0.012±0.002
3 讨论
帕金森综合征是一个症候群,有以下主要特征:静止性震颤、肌强直、运动迟缓、姿势反射消失、屈曲姿势、冻结(运动阻滞),其中最常见的类型是原发性帕金森病 (PD),PD 在我国 65 岁以上人群患病率为1 700/10 万,随着年龄增加而升高。其次为血管性帕金森综合征群(VP),是指脑卒中或其他血管病变导致的帕金森症候群,如多灶性腔隙性脑梗死、皮质下白质脑病、血管炎、血管淀粉样病、动脉硬化性帕金森综合征等病累及纹状体、黑质时,均可产生肢体强直、运动徐缓,步态笨拙等少动-强直综合征, 类似多巴胺性神经变性病,易与PD 混淆。尽管血、脑脊液检查不能够诊断PD、VP,但是一些影像学技术可以帮助鉴别PD 和VP, 如脑部葡萄糖代谢显像PET/CT 检查[8]、多巴胺转运体SPECT检查[9-10]、T1 磁化准备快速梯度回波(MPRAGE)和 T2 Flair 序列测量尾状核和白质高信号病灶体积[11]、磁敏感加权成像技术(SWI) 检查[12],但因 18F-FDG PET/CT 和多巴胺转运体SPECT 因价格昂贵和操作性无法普及原因, 限制了其应用和推广, 而且有专家组不推荐使用FDG 来作为帕金森综合征早期鉴别诊断[13]。基于以上原因,该研究利用SWI 系列的优势,在校正相位图上测量相位值以定量描述脑内核团铁的沉积,以探索其在PD与VP 中的应用价值。
SWI 可以准确地通过反映磁敏感性差异,通过定量分析功能,在其校正的相位图上,可以测量出相位位移值, 该值与组织的磁敏感性呈正比。 而该研究是采用SWI 系列测量PD 患者、VP 患者和正常人脑内椎体外系各核团即 PUT、SNc、SNr、Gp、RN、CN 相位值并进行比较差异。吕德勇等[14]研究发现,PD 患者锥体外系核团相位值即壳核(-0.42±0.14)、黑质致密带(0.06±0.01)、苍白球(-0.25±0.08)与VP 患者对应核团差异有统计学意义(P<0.05);同样,该研究结果显示: PD 组的壳核、黑质致密带、 苍白球相位值分别为 (-0.409±0.008),(0.038±0.004),(-0.247±0.006) 较 VP 组和对照组有明显减低(P<0.01),而 SNr、CN、RN 在 PD 组与 VP 之间差异无统计学意义 (P>0.05),VP 组的相位值与对照组相比,锥体外系各核团比较均差异无统计学意义(P>0.05),从该研究结果可以推断,PD 患者的运动障碍是壳核、黑质致密带、 苍白球的神经元铁沉积后出现变性丢失而分泌多巴胺能减少所致,而VP 患者的相关核团铁沉积则不显著, 考虑与多巴胺能神经元变性缺失关系甚微,也许与脑内环路破坏有关而导致运动障碍。 该研究结果同样与Wang 等[12]的 Meta 分析中尸检和SWI 显示晚期 PD 壳核(PUT)、苍白球(Gp)铁沉积显著的结果有一致性。 还有研究人员对PD 和VP 患者进行Hoehn-Yahr 分级后发现, 随着Hoehn-Yahr 分级的级别增高,锥体外系各核团的相位值降低, 尤其以PUT、SNc、GP为著[15],该研究的结果同样表明有PD 病情严重程度与脑内锥体外系各核团的相位值有密切关系。
CMBs 之前被发现与多种疾病相关,包括高血压、缺血性中风、自发性脑出血、血管性认知障碍、脑淀粉样血管病。 该研究结果显示,VP 组CMBs 个数与PD 组和正常组比较差异有统计学意义(P<0.01),考虑VP 患者出现脑微出血概率更高,可能是因为VP 患者多合并高血压病及脑小血管病有关。 在PD 患者中, 深部或幕下CMBs 比大叶CMBs 更常见,且与高血压、OH 和缺血性卒中病史相关[16]。而该研究结果显示,PD 组与正常对照组之间CMBs 数目对比差异无统计学意义 (P>0.05),且PD 患者未发现明显脑微出血,可能因该研究样本量少,故与Kim 等[17]报道存在一定差别。 鲜有研究探讨CMBs与PD 的疾病症状及亚型的关系,对于CMBs 是否影响PD 患者的临床特征存在争议[18],该研究缺乏对PD 和VP亚型展开研究。 因该研究受样本量及测量技术等原因限制,相关结论仍需进一步研究。
综上所述, 应用SWI 测量锥体外系各个核团相位值和记录CMBs 数目, 定量分析PD 和VP 的脑沉积情况和微出血情况,对PD 和VP 的临床鉴别诊断提供一定的参考价值。

