荻草谷网蚜唾液蛋白基因Sm13498的克隆及功能分析
付 裕, 王 倩, 张 勇, 陈巨莲
(中国农业科学院植物保护研究所, 植物病虫害生物学国家重点实验室, 北京 100193)
荻草谷网蚜Sitobionmiscanthi为我国小麦Triticumaestivum主产区麦蚜优势种(陈其湖和俞水炎, 1988),一直被误定为麦长管蚜Sitobionavenae(张广学, 1999)。在形态特征上,荻草谷网蚜与麦长管蚜的主要区别为:荻草谷网蚜的腹管长为尾片的1.40倍以上,后跗节Ⅱ短于喙节Ⅳ+Ⅴ的1.30倍,触角节Ⅲ圆形次生感觉圈分布于近基部2/3(张广学, 1999)。同时,Jiang等(2019)首次报道了荻草谷网蚜的基因组组装和解析工作,从分子水平上证明我国北方麦区的优势种蚜虫为荻草谷网蚜。
培育和利用抗虫品种是害虫绿色防控的重要措施,但由于蚜虫对小麦适应性强,导致目前生产上缺少优良抗蚜小麦品种资源。蚜虫唾液蛋白在蚜虫-植物互作中起着重要作用(Willetal., 2007)。Jones和Dangl(2006)曾提出了一个病原菌与植物竞争此消彼长的“Z字模型”(Zig-Zag Model)来解释病原菌与寄主植物复杂的动态互作关系。在此理论模型中,植物可通过细胞表面的模式识别受体(pattern recognition receptors, PRRs)感知病原相关分子模式(pathogen-associated molecular pattern, PAMPs),从而引发植物免疫反应(PAMP-triggered immunity, PTI)。为了成功定殖,病原菌可分泌效应蛋白到寄主植物内干扰PTI,导致效应子引发的敏感(effector-triggered susceptibility, ETS)发生,但在长期进化中一些植物可产生抗性基因(resistance gene, R gene),其表达的抗性蛋白可识别效应子,进而引发效应子触发的免疫反应 (effector-triggered immunity, ETI),由此进一步阻止病原菌的侵染和扩展。研究发现此模型也适用于解释蚜虫-植物间的互作关系,蚜虫可通过针状口器分泌唾液蛋白进入植物体内进一步调节植物防御反应(Hogenhout and Bos, 2011; Elzinga and Jander, 2013)。蚜虫唾液中可诱导或抑制植物防御反应的蛋白因子统称为效应子(Jaouannetetal., 2014)。
对于蚜虫唾液蛋白效应子筛选及功能研究主要有两个途径:(1)利用RNAi技术沉默潜在效应子检测对蚜虫的影响;(2)在植物体内过表达潜在效应子检测对植株防御反应及蚜虫的影响。Mutti等(2006, 2008)通过向豌豆蚜Acyrthosiphonpisum体内注射siRNA,以及桃蚜Myzuspersicae取食含dsRNA的烟草植株,验证了唾液蛋白C002对蚜虫的寄主适应性及取食起着重要作用。通过注射dsRNA沉默靶标基因,从豌豆蚜唾液腺基因中鉴定到一些可参与诱导或抑制植物防御的效应子,如ACE(angiotensin-converting enzyme)和Armet等(Wangetal., 2015a, 2015b)。借鉴病原菌效应子筛选及功能基因组学方法,Bos等(2010)成功鉴定了蚜虫效应子。将48个桃蚜候选效应子在本氏烟Nicotianabenthamiana中瞬时过表达,筛选出Mp10参与抑制及诱导植物的防御反应。进一步研究发现Mp10通过参与SA及JA介导的信号通路诱导植物防御反应(Rodriguezetal., 2014)。在拟南芥Arabidopsisthaliana中过表达Mp55可显著增加桃蚜繁殖率,蚜虫对Mp55过表达植株选择性更强,利用RNAi技术将Mp55沉默后,蚜虫繁殖率显著下降,表明Mp55可促进蚜虫侵染,且可能参与抑制植株的防御反应(Elzingaetal., 2014)。在本氏烟中过表达8个马铃薯长管蚜Macrosiphumeuphorbiae潜在效应子,其中Me10及Me23可显著提高桃蚜繁殖率,说明这两个唾液蛋白作为潜在效应子可能参与了抑制植株的防御反应(Atamianetal., 2013)。
目前关于效应子筛选及功能研究主要在豌豆蚜和桃蚜等模式昆虫上,而对于麦蚜尤其是荻草谷网蚜唾液蛋白功能研究的相关报道较少。有研究通过酶活性测定方法在麦二叉蚜Schizaphisgraminum或荻草谷网蚜唾液中鉴定到多种蛋白酶类,并证实了蚜虫唾液中的果胶酶及多酚氧化酶可诱导小麦的防御反应(Liuetal., 2009; Maetal., 2010)。在前期研究中,我们通过二代转录组测序获得了荻草谷网蚜唾液腺全转录组,并结合生物信息学以及组织表达特异性分析发现包括Sm13498(unigene名称: cluster_13498_g1)在内的表达丰度最高的前15个分泌蛋白都在唾液腺特异表达(Zhangetal., 2017)。利用蛋白质组学技术在荻草谷网蚜水溶性唾液中也成功鉴定到Sm13498蛋白(Zhangetal., 2021)。为进一步分析该唾液蛋白在蚜虫-植物互作中的潜在功能,本研究中我们克隆了Sm13498基因,并分析其序列特征及其时空表达特性,进而通过根癌农杆菌Agrobacteriumtumefaciens介导的瞬时表达方法对其功能开展初步分析,为进一步研究麦蚜唾液蛋白功能及蚜虫-小麦互作分子机理提供理论依据。
1 材料与方法
1.1 供试昆虫、质粒和菌株
本实验所用的荻草谷网蚜于2017年4月采自河北省廊坊市中国农业科学院中试基地小麦田,在中国农业科学院植物保护研究所温室中的养虫笼内使用小麦(中麦175)进行人工饲养。饲养温度为20±1℃,相对湿度为65%~70%,光周期为16L∶8D。pSUC2T7M13ORI(pSUC2)载体、阳性对照pSUC2-Avr1b、阴性对照pSUC2-Mg87和酿酒酵母SaccharomycescerevisiaeYTK12由中国农业科学院植物保护研究所王忠跃研究员提供。 pGR107载体、pGR107-BAX、pGR107-INF1及根癌农杆菌GV101和EHA105菌株本实验室保留。
1.2 RNA提取及cDNA的合成
取10头生长期一致且饥饿处理6 h的荻草谷网蚜无翅成蚜置于生态盒(2.5 cm×2.5 cm×2.5 cm)内,在小麦(中麦175)叶片上取食6, 12, 24和48 h后分别收集生态盒内所有成蚜,置于无RNase的1.5 mL离心管中,液氮迅速冷冻后保存于-80℃冰箱内备用。使用TRIzol(Invitrogen, 美国)提取不同取食时间的荻草谷网蚜无翅成蚜的总RNA,通过超微量紫外可见光光度计DS-11(DeNovix, 美国)检测浓度,并经过2.0%的琼脂糖凝胶电泳检测其质量。以1 μg总RNA为模板,按照EasyScript One-Step gDNA Removal and cDNA Synthesis SuperMix(全式金生物技术有限公司, 北京)反转录试剂盒说明书合成cDNA第1链。
1.3 Sm13498基因克隆
基于前期获得的荻草谷网蚜唾液腺全转录组中的Sm13498(unigene名称: cluster_13498_g1)序列(Zhangetal., 2017, 2021),使用Primer Premier 5.0软件(PREMIER Biosoft, 美国)设计扩增Sm13498的ORF的PCR引物(表1)。PCR反应体系(50 μL): 取1.2节中获得的荻草谷网蚜成虫cDNA模板1 μL, 上下游引物(10 mmol/L)各1 μL, 2×TransStart FastPfu PCR SuperMix 25 μL, ddH2O 22 μL。反应条件: 95℃预变性2 min; 95℃变性20 s, 50℃退火20 s, 72℃延伸60 s, 40个循环;72℃延伸10 min。PCR扩增产物通过2.0%琼脂糖凝胶电泳检测并将条带进行胶回收。将回收的PCR产物连接到pEASY-Blunt克隆载体(全式金生物技术有限公司, 北京)中,转入到大肠杆菌EscherichiacoliTrans-1-T1感受态细胞内,用M13引物筛选阳性克隆送到博迈德公司(北京)进行测序。

表1 本研究所用引物Table 1 Primers used in this study
1.4 序列生物信息学分析
利用OFR Finder(https:∥www.ncbi.nlm.nih.gov/orffinder)预测获取Sm13498氨基酸序列;利用Expasy(https:∥web.expasy.org/compute_pi/)分析Sm13498 预测分子量和等电点;利用SignalP4.1 Server (http:∥www.cbs.dtu.dk/services/SignalP/)预测Sm13498信号肽序列;利用TMHMM 2.0 (http:∥www.cbs.dtu.dk/services/TMHMM-2.0/)分析跨膜结构域;利用Pfam(http:∥pfam.xfam.org/)预测功能结构域,利用NLStradamus(http:∥www.Moseslab.csb.utoronto.ca/NLStradamus/)分析核定位信号。NCBI上利用Blast查找其他蚜虫同源蛋白序列;利用Clustal Omega (https:∥www.ebi.ac.uk/Tools/msa/clustalo/)进行序列比对;利用MEGA6软件的邻接法构建荻草谷网蚜Sm13498和其他物种蛋白序列的系统进化树,设置1 000次bootstraps进行检验。
1.5 Sm13498在取食小麦叶片不同时间的荻草谷网蚜无翅成蚜中的相对表达量检测
基于1.3节克隆的Sm13498序列使用Primer Premier 5.0软件设计RT-qPCR引物(表1)。采用试剂盒TB Green Premix Ex Taq(TaKaRa, 大连)在实时荧光定量PCR仪ABI-7500(ABI, 美国)上进行。qPCR反应体系(20 μL): cDNA模板2 μL, 上下游引物(10 mmol/L)各0.5 μL, TB Green Premix 10 μL, ROXⅡ 0.4 μL, ddH2O 6.6 μL。反应条件: 95℃预变性2 min; 95℃变性30 s, 60℃退火30 s, 40个循环。以荻草谷网蚜β-actin(GenBank登录号: NM_001126200)和NADPH(GenBank登录号: NM_001162323)为内参基因(Yangetal., 2014),引物序列见表1。取生态盒内10头处理后的无翅成蚜样品为一个生物学重复,每个处理设置3个生物学重复,每生物学重复样品重复测定3次。
1.6 酵母分泌系统检测信号肽功能
使用Primer Premier 5.0软件设计含有EcoRⅠ和XhoⅠ酶切位点Sm13498信号肽PCR引物(表1)。以1.2节中获得的荻草谷网蚜成虫cDNA为模板进行PCR反应,反应体系(50 μL): cDNA模板1 μL, 上下游引物(10 mmol/L)各1 μL, 2×TransStart FastPfu PCR SuperMix 25 μL, ddH2O 22 μL。反应条件: 95℃预变性2 min; 95℃变性20 s, 60℃退火20 s, 72℃延伸60 s, 40个循环; 72℃延伸10 min。将PCR产物连接到pEASY-Blunt克隆载体中,转入到大肠杆菌Trans-1-T1感受态细胞内,用M13引物筛选阳性克隆送到博迈德公司进行测序。用质粒小提试剂盒(Axygen, 美国)提取测序正确的重组质粒,用限制性内切酶EcoRⅠ和XhoⅠ将重组质粒和pSUC2同时进行双酶切。利用凝胶回收试剂盒(Axygen, 美国)回收目的片段。将目的片段通过T4 DNA连接酶于16℃过夜连接,连接产物转化到大肠杆菌DH5α感受态细胞中,筛选出阳性重组质粒pSUC2-Sm13498。
采用酵母转化试剂盒Frozen-EZ Yeast Transformation IITMKit(Zymo Research, 美国)将酵母菌株YTK12制备成酵母感受态细胞,将重组质粒pSUC2-Sm13498、阳性对照pSUC2-Avr1b和阴性对照pSUC2-Mg87转化到YTK12中,在具有 pSUC2重组菌株筛选作用的CMD-W培养基(6.7 g YNB, 0.75 g Yeast Synthetic Drop-out Medium Supplement, 20 g蔗糖, 20 g琼脂, 1 000 mL去离子水)培养2~3 d。挑取验证正确的酵母菌株在CMD-W液体培养基30℃ 250 r/min进行扩大培养48 h。在为所有菌株提供营养物质的YPDA(YPDA 50 g, 琼脂20 g, 1 000 mL去离子水)、CMD-W和具有信号肽功能鉴定作用的YPRAA(酵母提取物10 g,蛋白胨20 g,棉籽糖20 g,琼脂20 g,1 000 mL去离子水)的培养基平板中央滴加20 μL OD600=0.6的含有pSUC2-Sm13498, pSUC2-Avr1b和pSUC2-Mg87质粒的YTK12菌株,倒放置培养箱中,30℃培养2~4 d。取1 mL菌液放于含2 mL 5%蔗糖(过滤灭菌)溶液的15 mL离心管中,震荡混匀。加入1% 2,3,5-氯化三苯基四氮唑(2,3,5-triphenyltetrazolium chloride, TTC)(索莱宝科技有限公司, 北京)溶液(现用现配或避光保存),使其终浓度为0.1%,避光水浴35℃ 30 min,边孵育边观察,室温放置5 min。通过菌落的生长情况和溶液颜色变化来验证Sm13498信号肽的分泌活性。
1.7 农杆菌转化本氏烟瞬时表达Sm13498
使用Primer Premier 5.0软件设计含有SalⅠ和SmaⅠ酶切位点的扩增Sm13498全长序列和去除N端信号肽序列的片段Sm13498-sp的PCR引物(表1),进行PCR,反应体系(50 μL): 取1.2节中获得的荻草谷网蚜成虫cDNA模板1 μL,上下游引物(10 mmol/L)各1 μL, 2×TransStart FastPfu PCR SuperMix 25 μL, ddH2O 22 μL。通过双酶切再连接到pGR107载体中,转化到根癌农杆菌GV3101菌株。将根癌农杆菌的重组菌株用含卡那霉素(50 μg/mL)和利福平(50 μg/mL)的LB液体培养基28℃培养过夜后,4 000 g离心收获菌体,在浸润缓冲液[10 mmol/L 2-(N-吗啉)乙磺酸、20 mmol/L乙酰丁香酮、10 mmol/L MgCl2]中重悬至OD600=0.3。室温黑暗保存3 h,用1 mL不带针的注射器将悬浮液浸润到本氏烟(4周龄)叶片中。在本氏烟上分别注射包含pGR107-GFP(本实验室所构建并保存), pGR107-Sm13498和pGR107-Sm13498-sp根癌农杆菌24 h,然后在对相应位置上分别注射含Bcl-2相关X蛋白(Bcl-2 associated X protein, BAX)的pGR107-BAX和含晚疫霉Phytophthorainfestans中可诱导植物超敏反应的激发子INF1(Kamounetal., 1993)的pGR107-INF1,5 d后观察叶片表型,并将叶片置于脱色液(乙醇∶乙酸=6∶1, v/v)中至完全脱色后拍照。
1.8 Sm13498蛋白的烟草亚细胞定位
使用Primer Premier 5.0软件设计含有Eco31Ⅰ酶切位点去除N端信号肽的Sm13498 PCR引物(表1),进行PCR,反应体系(50 μL): 取1.2节中获得的荻草谷网蚜成虫cDNA模板1 μL, 上下游引物(10 mmol/L)各1 μL, 2×TransStart FastPfu PCR SuperMix 25 μL, ddH2O 22 μL。反应程序: 95℃预变性2 min; 95℃变性20 s, 65℃退火20 s, 72℃延伸60 s, 40个循环; 72℃延伸10 min。通过克隆连接到C端融合TagGFP的pBWA(V)HS-GLosgfp(作为对照组,本实验室保存)载体中,构建pBWA(V)HS-GLosgfp-Sm13498,转化到根癌农杆菌EHA105菌株。28℃培养过夜后,4 000 g离心收获菌体,在与1.7节相同的浸润缓冲液中重悬至OD600=0.3。室温保存4~6 h,用1 mL不带针的注射器将悬浮液浸润到本氏烟(4周龄)叶片中。4 d后,用蔡司LSM 880激光共聚焦显微镜(Zeiss, Jena, 德国)收集浸润的叶片并观察。GFP和叶绿素的自荧光分别在561和488 nm处被激发,在586-647和680-700 nm处采集。实验重复进行3次。
1.9 数据分析
采用2-ΔΔCt法计算Sm13498基因在取食不同时间的蚜虫体内的相对表达量变化(Livak and Schmittgen, 2001),以0 h时的基因表达量作为对照,基因表达量以平均值±标准误(SE)表示。所有数据采用SPSS20(IBM)软件中Duncan氏新复极差法进行多重比较,显著性差异水平设置为P<0.05。
2 结果
2.1 Sm13498基因克隆及序列特征
扩增获得荻草谷网蚜Sm13498开放阅读框(ORF)(GenBank登录号: MW346655),序列全长783 bp,编码260个氨基酸,预测分子量为28.01 kD,第1-22位氨基酸为N端信号肽序列,ORF中含有1个半胱氨酸,无功能结构域,无跨膜结构域和核定位信号。
序列比对结果表明(图1),Sm13498与豌豆蚜功能未注释蛋白LOC100159087 precursor(GenBank登录号: NP_001313548.1)氨基酸序列一致性为71.7%,与桃蚜未注释蛋白LOC111028600(GenBank登录号: XP_022163007.1)氨基酸序列一致性为60.9%。通过MEME分析,Sm13498、豌豆蚜LOC100159087 precursor(GenBank登录号: NP_001313548.1)和桃蚜LOC111028600(GenBank登录号: XP_022163007.1)这3个蛋白共预测得到5个motif(选择较为准确得分较高的前2个motif在图1中进行标注展示),其中E值最高为9.0e-039的motif1定位在第77-126位氨基酸的位置,E值为4.7e-030的motif2定位在第162-219位氨基酸的位置。 系统发育树表明,荻草谷网蚜Sm13498与豌豆蚜的未注释功能蛋白LOC100159087 precursor(GenBank登录号: NP_001313548.1)亲缘关系最近,与麦双尾蚜Diuraphisnoxia的未注释功能蛋白LOC107172580(GenBank登录号: XP_015378361.1)亲缘关系最远,氨基酸序列一致性为45.74%。荻草谷网蚜Sm13498与豌豆蚜LOC100159087 precursor以及桃蚜LOC111028600在同一分支上(图2)。

图1 荻草谷网蚜Sm13498与其他昆虫唾液蛋白的氨基酸序列比对Fig. 1 Amino acid sequence alignment of Sm13498 of Sitobion miscanthi with salivary proteins of other insects蛋白来源物种及GenBank登录号Origin species of proteins and their GenBank accession numbers: Sm13498: 荻草谷网蚜 Sitobion miscanthi, MW346655; LOC100159087 precursor: 豌豆蚜Acyrthosiphon pisum, NP_001313548.1; LOC111028600: 桃蚜Myzus persicae, XP_022163007.1.
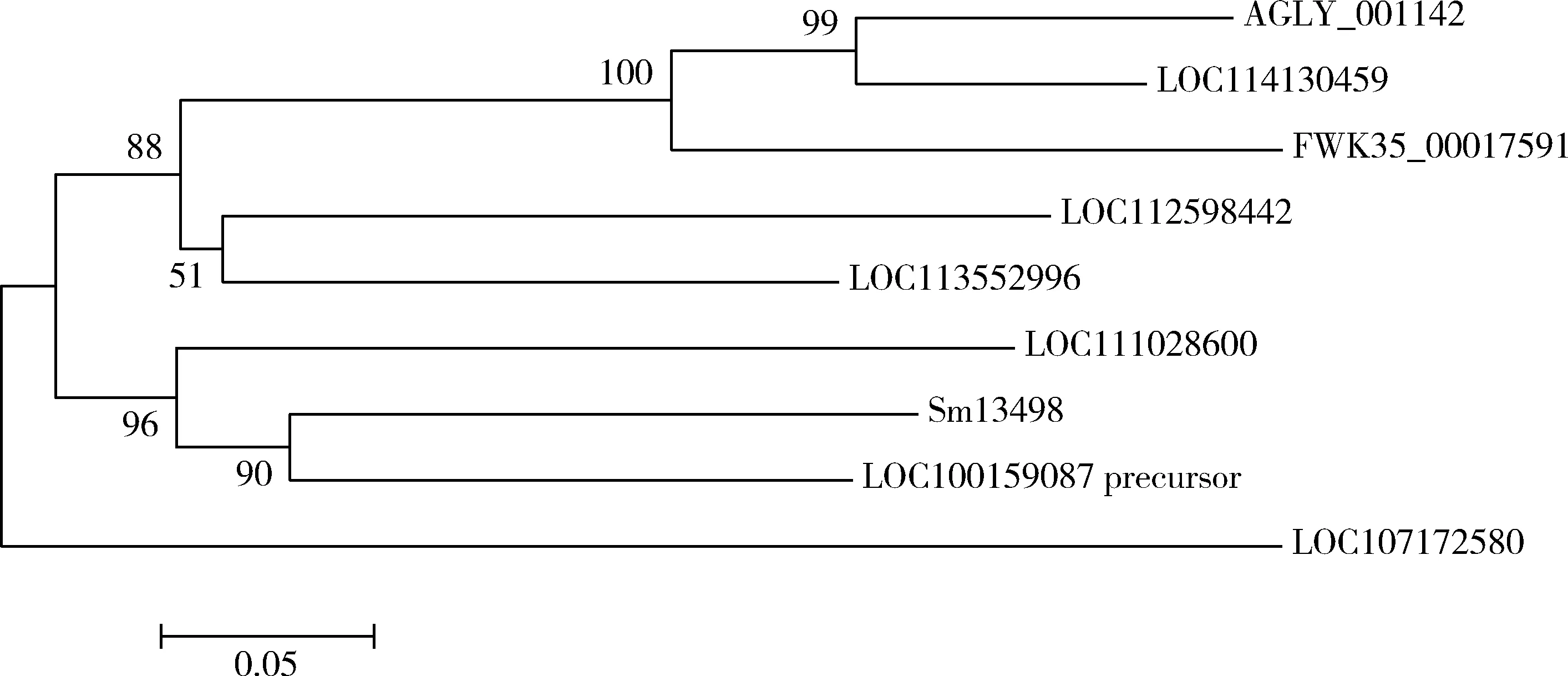
图2 基于氨基酸序列的荻草谷网蚜Sm13498和其他昆虫唾液蛋白系统发育树Fig. 2 Phylogenetic tree of Sm13498 of Sitobion miscanthi and salivary proteins of other insects based on amino acid sequences使用MEGA 6软件的邻接法构建系统发育树,设置1 000次bootstraps进行检验。The phylogenetic tree was constructed using the neighbor-joining method of MEGA 6 with 1 000 bootstrap replicates. 蛋白来源物种及GenBank登录号Origin species of proteins and their GenBank accession numbers: Sm13498: 荻草谷网蚜 Sitobion miscanthi, MW346655; LOC100159087 precursor: 豌豆蚜Acyrthosiphon pisum, NP_001313548.1; LOC111028600: 桃蚜Myzus persicae, XP_022163007.1; AGLY_001142: 大豆蚜Aphis glycines, KAE9545599.1; LOC114130459: 棉蚜 Aphis gossypii, XP_027851238.1; FWK35_00017591: 苜蓿蚜Aphis craccivora, KAF0755754.1; LOC112598442: 高粱蚜 Melanaphis sacchari, XP_025200691.1; LOC113552996: 玉米缢管蚜Rhopalosiphum maidis, XP_026811885.1; LOC107172580: 麦双尾蚜 Diuraphis noxia, XP_015378361.1.
2.2 Sm13498在取食小麦叶片不同时间的荻草谷网蚜无翅成蚜中的相对表达量
结果(图3)表明,荻草谷网蚜无翅成蚜在取食小麦叶片的不同时间内,Sm13498均有表达,取食6, 12, 24和48 h表达量分别是对照组的1.39, 1.68, 1.35和1.34倍,其中在取食12 h时表达量达到最高,且显著高于在其他取食时间的表达量(F4,10=2.416,P<0.05)。

图3 Sm13498基因在取食小麦叶片不同时间的荻草谷网蚜无翅成蚜中的相对表达量Fig. 3 Relative expression levels of Sm13498 inapterous adults of Sitobion miscanthi feedingon Triticum aestivum leaves for different time图中数据为平均值±标准误;以0 h时的基因表达量作为对照,柱上不同字母表示不同取食时间基因表达量差异显著(P<0.05, Duncan氏新复极差法)。Data in the figure are mean±SE. The gene expression level at 0 h was used as the control. Different letters above bars indicate significant difference in the gene expression level among different feeding time points (P<0.05, Duncan’s new multiple range test).
2.3 Sm13498信号肽功能
在YPDA培养基中,含pSUC2-Sm13498, pSUC2-Avr1b和pSUC2-Mg87重组酵母菌株YTK12以及野生型YTK12均可以正常生长;在缺少色氨酸的CMD-W培养基中,由于野生型YTK12缺少pSUC2质粒无法生长;携带pSUC2-Sm13498和pSUC2-Avr1b的YTK12酵母菌株,能在以棉籽糖为唯一碳源的YPRAA培养基上生长,说明阳性对照Avr1b与 Sm13498信号肽都具有活性,可以与SUC2融合后能够使蔗糖酶正常分泌到胞外,从而将棉籽糖分解为酵母可直接利用的单糖。pSUC2-Mg87信号肽不具备分泌活性,与野生型YTK12菌株一样不能将合成蔗糖酶分泌到细胞外,因此不能在YPRAA培养基上正常生长(图4)。
携带pSUC2-Sm13498和pSUC2-Avr1b的YTK12酵母菌株可以分泌蔗糖酶能把蔗糖水解成单糖,单糖则与无色的2,3,5-氯化三苯基四氮唑(TTC)反应产生暗红色且不溶于水的氯化三苯基四氮唑(triphenylformazan, TTF)。野生型YTK12和pSUC2-Mg87不能分泌蔗糖酶,无法与TTC发生显色反应(图4)。
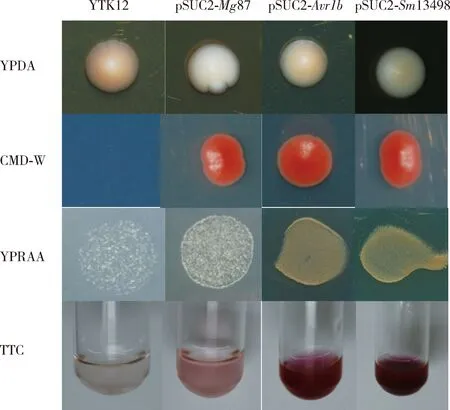
图4 酵母表达系统中荻草谷网蚜Sm13498信号肽活性鉴定Fig. 4 Identification of the signal peptide activity of Sm13498 of Sitobion miscanthi in yeast expression system在YPDA培养基中,pSUC2-Sm13498, pSUC2-Avr1b和pSUC2-Mg87重组酵母菌株YTK12以及野生型YTK12可以正常生长;在CMD-W培养基中,由于缺少pSUC2质粒,野生型YTK12无法生长;携带pSUC2-Sm13498和pSUC2-Avr1b的YTK12能在以棉籽糖为唯一碳源的YPRAA培养基上生长,无色的2,3,5-氯化三苯基四氮唑(TTC)被还原为暗红色且不溶于水的氯化三苯基四氮唑(TTF);pSUC2-Mg87信号肽不具备分泌活性,含pSUC2-Mg87的菌株与野生型YTK12一样不能在YPRAA培养基上正常生长。The YTK12 strains containing pSUC2-Sm13498, pSUC2-Avr1b and pSUC2-Mg87 and the wild-type YTK12 could grow normally on YPDA medium. The wild-type YTK12 could not grow on CMD-W medium due to the lack of pSUC2 plasmid. YTK12 carrying pSUC2-Sm13498 and pSUC2-Avr1b could grow on YPRAA medium with raffinose as the only carbon source, and catalyze the conversion of colorless 2,3,5-triphenyltetrazolium chloride (TTC) to the insoluble dark-red-colored triphenylformazan (TTF). The signal peptide of pSUC2-Mg87 had no secreting activity and the strain containing pSUC2-Mg87 could not grow normally on YPRAA medium as the wild-type YTK12.
2.4 农杆菌介导Sm13498在本氏烟中抑制细胞坏死的功能及亚细胞定位
在单独注射pGR107-GFP和MgCl2的位点叶片没有出现组织坏死;在分别单独注射pGR107-Sm13498和pGR107-Sm13498-sp的位点也无组织坏死,说明唾液蛋白Sm13498本身不会引起细胞死亡。分别注射pGR107-BAX和pGR107-INF1能够引起叶片的坏死反应,pGR107-GFP不能抑制BAX和INF1引起的坏死,但分别注射pGR107-Sm13498和pGR107-Sm13498-sp24 h后,再次pGR107-BAX和pGR107-INF1不会引起叶片的坏死反应(图5)。结果表明Sm13498有效抑制BAX和INF1引发程序性细胞死亡。
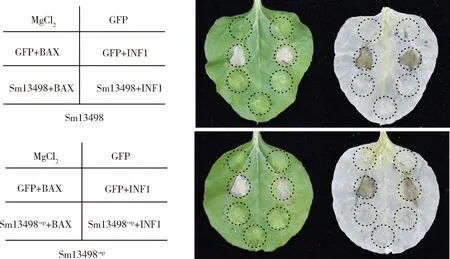
图5 根癌农杆菌介导荻草谷网蚜Sm13498在本氏烟中瞬时表达Fig. 5 Transient expression of Sm13498 of Sitobion miscanthi in Nicotiana benthamiana mediated by Agrobacterium tumefaciens左图示意右图中各圆圈对应的处理。The left figure shows the corresponding treatments for circles in the right figure. Sm13498-sp: 去除N端信号肽Removal of N-terminal signal peptide; BAX: Bcl-2相关X蛋白Bcl-2-associated X protein; INF1: 晚疫霉Phytophthora infestans中可诱导植物超敏反应的激发子Host-specific elicitor of Phytophthora infestans to induce the plant hypersensitivity. GFP+BAX/INF1: 注射pGR107-GFP 24 h后再注射pGR107-BAX/INF1 (Injection of pGR107-BAX/INF1 after 24 h of injection of pGR107-GFP); Sm13498+BAX/INF1: 注射pGR107-Sm13498 24 h后再注射pGR107-BAX/INF1 (Injection of pGR107-BAX/INF1 after 24 h of injection of pGR107-Sm13498); Sm13498-sp+BAX/INF1: 注射pGR107-Sm13498-sp 24 h后再注射pGR107-BAX/INF1 (Injection of pGR107-BAX/INF1 after 24 h of injection of pGR107-Sm13498-sp). 注射MgCl2和pGR107-GFP为对照组。Injections of MgCl2and pGR107-GFP were set as the control groups, respectively. 右侧照片为左侧叶片脱色处理后的照片。The right photo is the photo of the left leaf post decolorization treatment.
通过共聚焦显微镜观察(图6)显示,pBWA(V)HS-GLosgfp对照组在本氏烟叶片的细胞的细胞质和细胞核均显示出荧光; Sm13498-GFP融合蛋白组的荧光只出现在细胞的质膜上,初步表明Sm13498定位在本氏烟叶片细胞膜。

图6 根癌农杆菌介导荻草谷网蚜Sm13498在本氏烟叶片中的亚细胞定位Fig. 6 Subcellular localization of Sm13498 of Sitobion miscanthi in Nicotiana benthamiana leaves mediatedby Agrobacterium tumefaciensFluorescence: 荧光观察Observation of fluorescence; Chloroplast: 叶绿体观察Observation of chloroplast; Bright field: 明场Bright field; Merged: 前3张图片融合Fusion of the former three pictures. 标尺Scale bars=20 μm.
3 讨论
在前期研究中,我们通过转录组及蛋白质组学技术成功鉴定到一个表达丰度高且在荻草谷网蚜唾液腺特异表达的唾液蛋白,并将其命名为Sm13498(Zhangetal., 2017, 2021)。为进一步探究Sm13498在蚜虫-寄主互作中的潜在功能,本研究首先通过基因克隆验证转录组数据中Sm13498序列的完整性与真实性,扩增得到该基因ORF全长序列,其编码260个氨基酸,N端具有分泌蛋白特有的信号肽序列,氨基酸序列中含有1个半胱氨酸,无功能结构域,无跨膜结构域和核定位信号,符合效应蛋白基本的序列特征。系统进化树结果表明,Sm13498与豌豆蚜未注释功能蛋白LOC100159087 precursor(GenBank登录号: NP_001313548.1)氨基酸序列相似性较高,且亲缘关系最近(图2)。
在病原菌侵染寄主过程中,其相关分泌蛋白的基因表达量是否显著升高,成为筛选潜在效应子的重要指标之一(Yangetal., 2020)。本研究以此病原菌筛选效应子的模式为参考,以取食0 h的荻草谷网蚜为对照,通过RT-qPCR检测发现Sm13498在荻草谷网蚜各个取食时间均有所表达,在取食12 h时表达量达到峰值且显著高于在其他取食时间的表达量(图3)。有研究表明,蚜虫取食12 h后可诱导小麦叶片内大量防御相关基因表达(赵丽艳, 2006),因此Sm13498蛋白可能参与调节寄主植物的早期防御反应。Sm13498基因在蚜虫取食过程中的高表达及其在唾液腺组织特异表达模式,表明该唾液蛋白可能在荻草谷网蚜取食及其与寄主互作中发挥重要作用。
信号肽一般位于分泌蛋白的N端,并与蛋白质的分泌特性有关(韦雪芳等, 2006)。效应子只有被病原菌或者昆虫分泌到植物组织或细胞内,才能与寄主植物内的互作蛋白结合,从而调节植物防御反应或其他生理过程,因此具有分泌活性的N端信号肽也为效应蛋白的结构特征之一。Sm13498序列N端1-22氨基酸为预测信号肽,为进一步验证其具有分泌活性,本研究利用酵母分泌系统对Sm13498的信号肽序列进行功能鉴定。结果显示,含有Sm13498信号肽序列的酵母菌株可以在只含有棉籽糖的YPRAA培养基上生长,并使TTC显色,证实了其信号肽序列能够使缺陷型酵母重新分泌蔗糖酶(图4)。这表明Sm13498的信号肽具有分泌活性,从而推断Sm13498蛋白可能被分泌到细胞外来执行生物学功能。Chaudhary等(2015)通过人工饲料饲喂马铃薯的蚜虫以收集唾液蛋白,并通过蛋白质组技术鉴定到Sm13498同源蛋白。Zhang等(2020)利用类似方法在荻草谷网蚜唾液蛋白中鉴定到Sm13498蛋白,进一步说明Sm13498可被蚜虫分泌到体外。但是,有研究表明,用于收集蚜虫唾液蛋白的人工饲料成分、蚜虫数量等因素会直接影响唾液蛋白组分(Milesetal., 1999; Bosetal., 2010),因此后续仍需通过Western blot或者免疫共定位等技术直接证实Sm13498可被荻草谷网蚜分泌到小麦组织内。
亚细胞定位可以提供效应子或唾液蛋白在细胞上的具体存在部位,为后续蛋白作用位点及功能研究提供重要信息。马铃薯长管蚜唾液蛋白Me10(Chaudharyetal., 2019)以及禾谷缢管蚜Rhopalosiphumpadi唾液蛋白Rp1与Rp58(Escudero-Martinezetal., 2020)均定位在本氏烟叶片的细胞质和细胞核上,而桃蚜唾液蛋白MpC002定位于烟草细胞膜中(Bosetal., 2010)。本研究通过类似方法确定了荻草谷网蚜唾液蛋白Sm13498定位在本氏烟叶片表皮细胞的细胞膜上(图6),说明其作用位点或者靶标蛋白可能存在于寄主细胞膜上。相比于对照组GFP,Sm13498- GFP融合蛋白在荧光信号较弱,推测可能Sm13498在烟草细胞中转化率较低。不同蚜虫唾液蛋白在细胞中的定位不同,这也表明蚜虫唾液蛋白在寄主植株中作用位点或作用方式的多样性。
农杆菌介导的瞬时表达方法可实现对病原菌、蚜虫及其他昆虫的效应蛋白的高通量鉴定及功能分析(Wangetal., 2011)。在烟草中瞬时过表达小鼠Bcl-2 家族的促凋亡因子(Boumelaetal., 2009)及马铃薯晚疫霉激发子INF1(Kamounetal., 1993),可触发程序性细胞死亡,出现类似于植物防御相关的过敏性坏死反应(hypersensitive response, HR),而且能够激发寄主植物相关抗病蛋白的表达(Lacomme and Santa Cruz, 1999)。因此,在烟草叶片中过表达病原菌分泌蛋白或昆虫唾液蛋白,并观察对BAX或INF1诱导细胞死亡的抑制作用,可推断该蛋白是否具有抑制植物防御反应的功能活性。在本研究中,Sm13498以及去除N端信号肽的Sm13498片段均可以抑制由BAX和INF1诱导的烟草细胞死亡(图5),初步说明唾液蛋白Sm13498可抑制寄主植物的防御反应,但Sm13498的具体功能仍需要进行后续实验来进一步验证。
- 昆虫学报的其它文章
- 天宫二号航天蚕后代小茧突变体sc的发现与基因定位
- Analysis of the transcriptomes of Galeruca daurica(Coleoptera: Chrysomelidae) adults at different summer diapause stages
- Influence of foliar fertilizers on the development and reproduction of the citrus red mite, Panonychus citri (Acari: Tetranychidae), and the growth of citrus seedlings
- 敲减神经肽F基因(npf)对亚洲玉米螟取食、生长发育和繁殖的影响
- 黑水虻抗菌肽HI-3对人结肠癌HCT-8细胞谷氨酰胺和谷氨酸代谢通路的影响
- 草地贪夜蛾成虫复眼明暗适应及黄光照射下明适应状态转化率

