天宫二号航天蚕后代小茧突变体sc的发现与基因定位
沈广胜, 沈兴家,*, 张 龙, 赵巧玲,*, 高梦杰, 唐顺明,黄静怡, 陈艳花, 蒋 涛, 朱 娟, 王梅仙
(1. 江苏科技大学生物技术学院, 江苏省蚕桑生物学与生物技术重点实验室, 江苏镇江 212018; 2. 中国农业科学院蚕业研究所,农业农村部蚕桑遗传改良重点实验室, 江苏镇江 212018; 3. 中国农业大学草业科学与技术学院, 北京 100193)
太空诱变育种是指将生物体种质材料搭载在返回式卫星、高空气球和飞船等飞行器中,利用太空环境的特殊综合因素(高真空、微重力、地球磁场和高能带电粒子辐射等),提高遗传物质发生改变的概率,使其后代发生表观性状的变异,经地面选育进而培育新品种的方法(李谨等, 2015)。经过航天诱变,许多物种的后代中产生了可以稳定遗传的变异,这些变异有利有弊,生产上运用有利变异选育了许多优良品种。1992年,中国科学院遗传与发育生物学研究所使用水稻干种子搭载卫星选育出了优良品种“赣早籼47号”(李金国等, 2001)。1996年,中国农业科学院油料作物研究所将“豫芝4号”搭载我国发射的第17颗返回式卫星,选育出了高产、抗病并且适应性广的优质品种“航芝1号”(张秀荣等, 2003)。王曦茁等(2014)通过航天诱变筛选出了对松褐天牛Monochamusalternatus具有高毒力的球孢白僵菌Beauveriabassiana菌株。大动物航天育种在我国基本处于空白状态,研究内容集中在太空环境对动物生理和性状的影响上(钱荷英和徐安英, 2006)。
家蚕Bombyxmori是具有经济价值的鳞翅目(Lepidoptera)模式昆虫之一,关于家蚕的空间搭载实验早在20世纪90年代就已开始。1990年10月,史之祯等进行了家蚕解除滞育卵的空间搭载实验,首次证实了家蚕胚胎能够在太空中正常发育并且孵化(史之祯等, 1995)。1992年底,中国农业科学院蚕业研究所利用俄罗斯发射的返回式卫星再次证实家蚕能够在太空中完成吐丝结茧、化蛹化蛾、受精交配、产卵孵化等重要生命行为,并且在回收材料中发现了鳌虾蛹、过剩斑纹和3眠蚕等变异体,经过继代培养,这些变异可以稳定遗传给后代(庄大桓等, 1995)。广东省农业科学院利用我国第20颗返回式卫星搭载家蚕卵,经过系统选育,得到了生命力强, 茧丝质优良, 繁育系数高的“航诱7号”(吴福泉等, 2008)。然而,对这些家蚕变异体的研究仍然停留在表观性状的观测和突变体的筛选上,对于这些突变发生的内在机理尚不清楚。
2016年10月17日跟随“神舟十一号”飞船进入天宫二号空间实验室的6条“秋丰×白玉”杂交后代家蚕幼虫,11月18日随分离的“神舟十一号”飞船返回地球,由中国农业大学张龙教授团队接收,获得一颗存活雌蛹,该雌蛹羽化后与地面家蚕“白玉”品系雄蛾(江苏科技大学提供)交配制种,记为F1。2017年春季一部分F1在农业农村部蚕桑遗传改良重点实验室常规新鲜桑叶饲养,将F1同胞交配后得到26蛾F2蚕种;7月饲养F2,部分蛾区发现特小形蚕茧,连续7代同胞交配分离出小茧突变体品系sc,同时,正常雌雄个体交配纯合,建立飞天蚕(space silkworm)正常茧品系TG。采用SSR分子标记技术将该突变体的突变基因定位在家蚕第3连锁群上,定位区间内包含33个候选基因,通过该研究期望揭示家蚕小茧突变体突变的分子机制,同时为家蚕大茧形品种的培育提供理论指导。
1 材料与方法
1.1 供试蚕品系
实验用的飞天蚕正常茧蚕品系TG和飞天蚕小茧突变系sc,由江苏科技大学与中国农业大学张龙教授组合作,从天宫二号空间实验室返回的“秋丰×白玉”雌蚕(♀)与地面“白玉”雄蚕(♂)杂交后再经过连续7代同胞交配纯合而来。用于杂交和测交的品系“白玉”和大茧形品系0223V1,均由中国农业科学院蚕业研究所(江苏科技大学)培育和提供。
1.2 sc和TG的表型分析
分别饲养3个蛾区的TG和sc,为排除环境误差,所有材料均在自然光照、25℃、相对湿度控制在80%左右条件下喂食新鲜桑叶。每个蛾区随机挑选25头个体,测量它们在5龄第7天幼虫时的体重、体长和体宽以及蛹期的全茧重、茧层重和茧层率(茧层重/全茧重),分别取平均值。数据分析采用GraphPad Prism 7 软件进行处理,结果以平均值±标准差(SD)表示,TG和sc之间的差异采用t检验进行多重比较。
1.3 sc的遗传分析
利用0223V1♂与sc♀杂交得到F1,观察F1的表型。F1同胞交配得到F2,统计F2群体中大茧形与小茧形的家蚕个体数量。根据雌性家蚕减数分裂染色体不交换的特点,用0223V1♂和sc♀作为亲本,组配F1代及BC1回交群体,即(sc♀×0223V1♂)♀×sc♂和sc♀×(sc♀×0223V1♂)♂,分别记为BC1F和BC1M。BC1F群体用作连锁分析(Miaoetal., 2005),BC1M群体中的小茧突变体用作定位分析(Miaoetal., 2005),同时统计BC1回交群体中大茧形和小茧形个体的数量,计算分离比。分离比=F2或者BC1群体中的大茧形个体数目/F2或者BC1群体中的小茧形个体数目。
1.4 多态性SSR标记的筛选
以sc♀(亲本P1),0223V1♂(亲本P2)及其后代F1为材料,使用动物基因组快速提取试剂盒[生工生物工程(上海)股份有限公司],提取基因组DNA,-20℃冻存备用。根据已构建的家蚕SSR标记连锁图(Miaoetal., 2005),在每个连锁群上随机挑选10个SSR引物,筛选与家蚕基因sc连锁的SSR标记(表1),以亲本P1、P2以及F1基因组为模板进行PCR扩增,如果某一SSR标记在P1和P2之间分别只有一条差异扩增带,而在F1代个体中有两条扩增带,且其中一条扩增带与P1相同,另一条扩增带与P2相同,则此标记为多态性SSR分子标记。
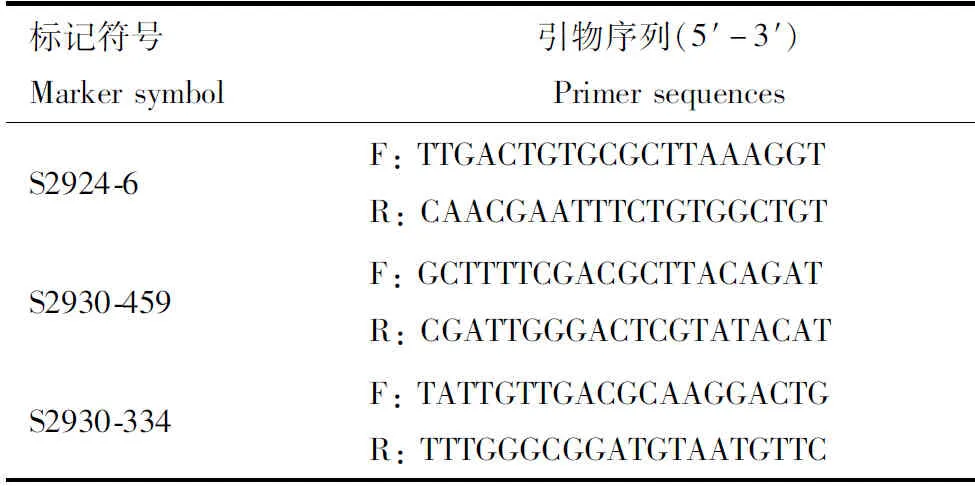
表1 筛选到的与sc基因连锁的SSR标记Table 1 Selected SSR markers linked to the sc gene
PCR扩增反应体系(10 μL): 2×Flash Hot Start MasterMix (Dye) 5 μL (北京康为世纪生物科技有限公司), ddH2O 3.5 μL, 上下游引物(10 μmol/L)各0.5 μL, DNA模板0.5 μL。PCR扩增反应程序: 94℃预变性5 min; 94℃ 30 s, 55℃ 30 s, 72℃ 10 s, 30个循环; 72℃延伸7 min。PCR产物经4%琼脂糖凝胶电泳检测。
1.5 家蚕sc基因的连锁分析
以1.4节筛选出的多态性SSR分子标记为引物,对BC1F进行基因型分析,由于家蚕雌性染色体完全连锁,BC1F群体中分离出大茧形和小茧形的个体,如果其中所有小茧形个体的PCR扩增条带与P1相同,所有大茧形个体的PCR扩增条带与F1相同,那么就认为该SSR分子标记与茧形基因连锁,即茧形相关基因分布在该SSR标记所在的连锁群上。而用其他连锁群的多态性分子标记对BC1F群体的正常茧和小茧个体的PCR扩增条带则无此规律。
1.6 家蚕sc基因的精细定位
基于1.5节筛选出的家蚕基因组连锁群,使用SSRHunter1.3寻找新的多态性SSR标记,根据图位克隆的原理,将BC1M群体中出现与F1条带一致的小茧形个体视为交换个体,并将分析结果记录到Excel中,进行目的基因与多态性SSR标记间的遗传距离检测,将突变基因定位到两个分子标记之间,并将定位区间内的基因序列在NCBI数据库中进行比对,以得到基因的预测功能。使用作图软件MapDraw v2.1绘制遗传连锁图谱。
2 结果
2.1 sc和TG的表型
我们观察了sc和TG在上蔟前的幼虫形态(图1),其显著特征是突变体幼虫体长较短,胸部狭窄。在5龄第7天幼虫时,TG的体长为5.213±0.011 cm,体宽为1.191±0.032 cm,体重为3.493±0.235 g。sc的体长为4.347±0.023 cm,是TG体长的83%(P≤0.0001);体宽为0.718±0.026 cm,是TG体宽的60%(P≤0.0001);体重为1.729±0.116 g,是TG体重的50%(P≤0.001)。 蚕茧调查情况显示,TG的全茧重为1.423±0.033 g,茧层重为0.29±0.002 g。sc的全茧重为0.784±0.083 g,是TG全茧重的55%(P≤0.001);sc的茧层重为0.161±0.021 g,是TG茧层重的55%(P≤0.001)。TG和sc的茧层率相似,TG的茧层率为20.37%±0.351%,sc的茧层率为20.43%±0.603%(图2)。以上结果说明sc具有短而瘦的体形特征,并且最终结小茧。

图1 飞天蚕小茧突变体sc(左)和正常茧品系TG(右)的5龄第7天幼虫表型Fig. 1 Phenotypes of the day-7 5th instar larvae of the small cocoon mutant sc (left) andthe normal cocoon strain TG (right) of space silkworm (Bombyx mori)
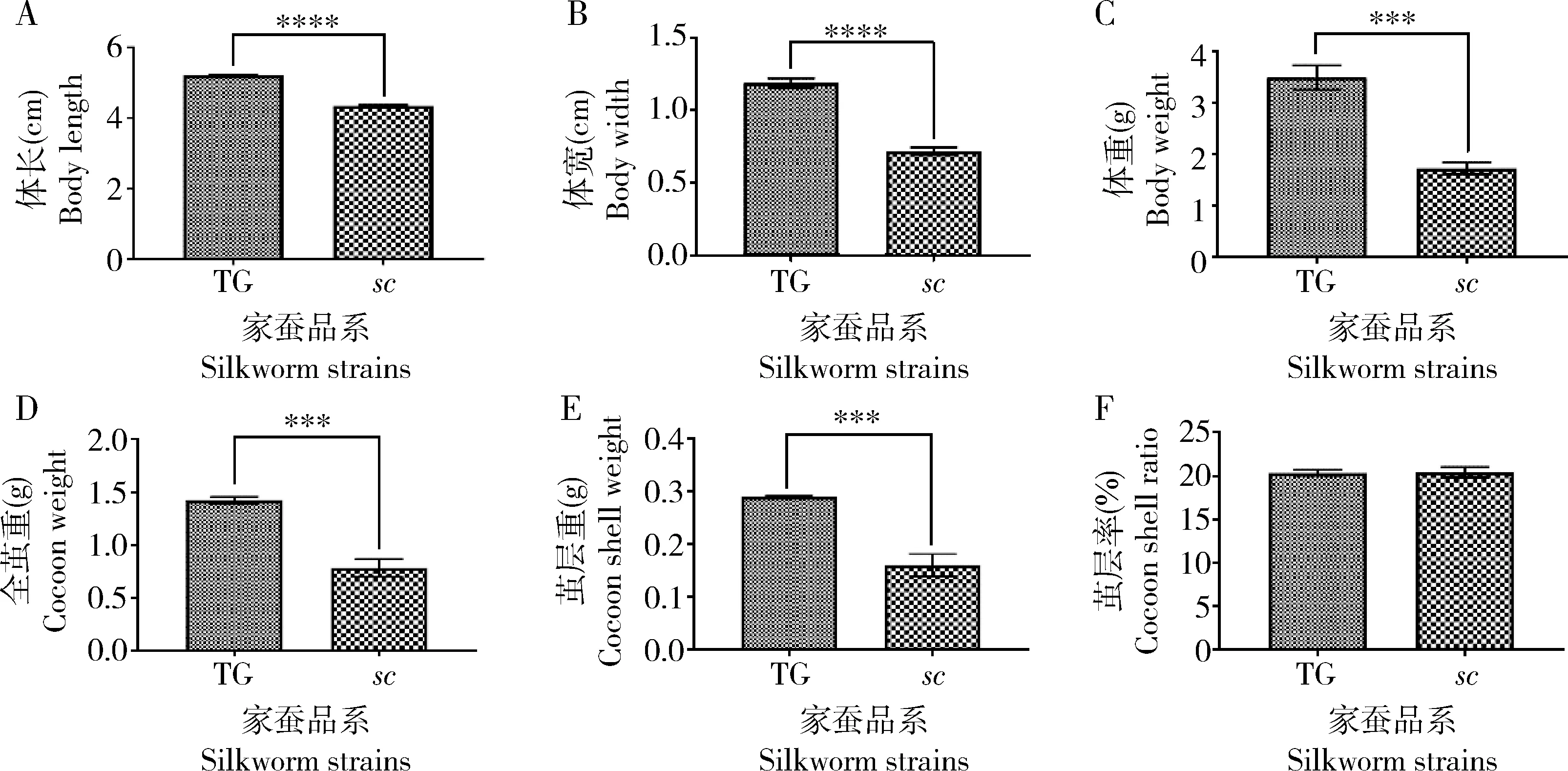
图2 飞天蚕正常茧品系TG和小茧突变体sc的5龄第7天幼虫(A, B, C)及蛹(D, E, F)表型测量结果Fig. 2 Phenotypic measurement results of the day-7 5th instar larvae (A, B, C) and pupae (D, E, F) of the normalcocoon strain TG and the small cocoon mutant sc of space silkworm (Bombyx mori)A: 体长Body length; B: 体宽Body width; C: 体重Body weight; D: 全茧重Cocoon weight (CW); E: 茧层重Cocoon shell weight (CSW); F: 茧层率Cocoon shell ratio (CSR). 图中数据为平均值±标准差(n=3)。Data in the figure are mean±SD (n=3). ***P≤0.001; ****P≤0.0001(t检验t-test).
2.2 sc的遗传分析
大茧形亲本0223V1♂与突变体sc♀杂交F1代个体均表现为大茧形。F1代自交得到的F2代出现性状分离,有大茧形和小茧形两种表型,其分离比为3∶1;以sc作为回交亲本,用F1代与其进行回交,后代出现了大茧形和小茧形两种表型,分离比为1∶1(表2),表明该小茧表型为隐性性状。根据孟德尔遗传定律,小茧性状由一对隐性基因控制,且在常染色体上,命名为sc。
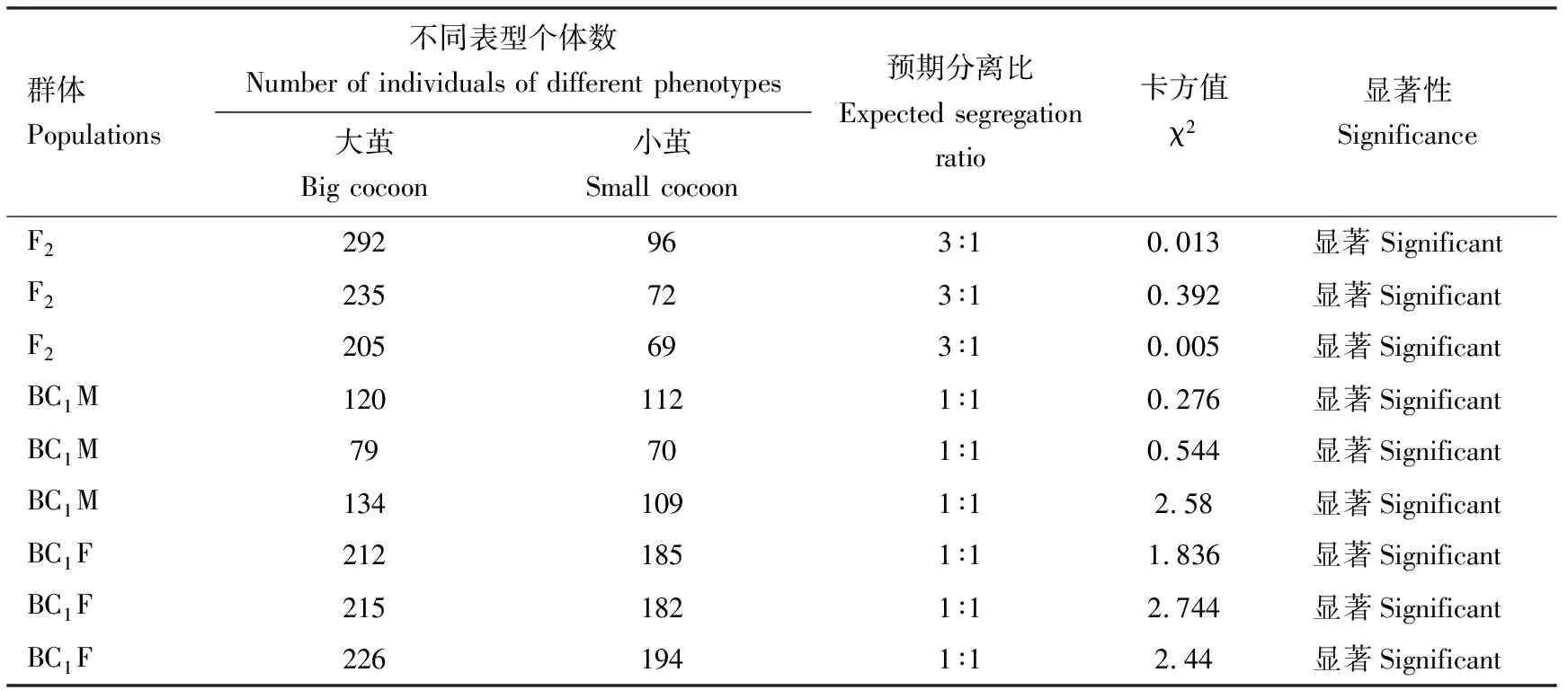
表2 飞天蚕小茧突变体sc和正常大茧形品系0223V1杂交各世代的性状分离Table 2 Character segregation among various hybrid generations of the small cocoon mutant sc of spacesilkworm (Bombyx mori) and the normal large cocoon strain 0223V1 of the silkworm
2.3 家蚕sc基因的连锁分析
根据SSR标记连锁图在家蚕基因组连锁群中设计SSR引物,以sc♀(亲本P1), 0223V1♂(亲本P2)及其后代F1的基因组为模板进行PCR扩增。通过对PCR产物带型的分析,找出在亲本及F1中具有多态性的标记,结果在第3连锁群上找到了3个SSR多态性标记(S2924-6, S2930-459和S2930-334)(表1)。然后使用这3个标记对BC1F的正常茧个体和小茧个体进行PCR产物带型分析。由于这3个标记的电泳图谱类似,故而选择S2930-334的扩增产物电泳图谱(图3)进行说明。从图3中可以看出,BC1F个体中10个大茧形个体的带型与F1的带型一致,同时10个小茧形个体中的带型与sc的带型一致,表明sc的突变基因与第3连锁群上的标记S2930-334连锁,即突变基因sc位于第3连锁群上。
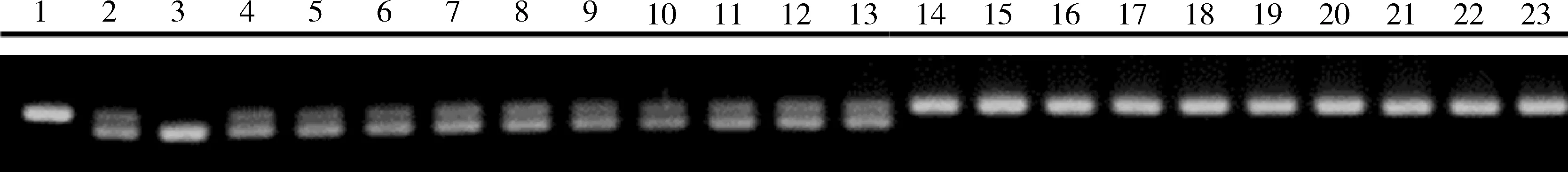
图3 家蚕基因组第3连锁群的多态性SSR标记S2930-334在BC1F群体中的PCR产物电泳图谱Fig. 3 Electrophoresis map of the PCR products of polymorphic SSR marker S2930-334of linkage group-3 of the Bombyx mori genome in BC1F population1: sc♀; 2: F1(sc♀×0223V1♂); 3: 0223V1♂; 4-13: BC1F群体中的大茧个体Individuals showing big cocoons in BC1F population; 14-23: BC1F群体中的小茧个体Individuals showing small cocoons in BC1F population.
2.4 家蚕sc基因的精细定位
在家蚕基因组第3连锁群上设计SSR引物,筛选出新的多态性分子标记,最终选出9个SSR分子标记(表3)。通过这9个SSR分子标记对BC1M群体中的624个小茧形个体进行检测,并统计每个标记的交换个体数目,以此计算遗传交换率,绘制出关于sc基因的连锁图(图4)。突变基因sc位于S2930-459和S2930-288之间,遗传距离为5.1 cM,距离突变基因最近的两个标记S2930-363和S2930-289之间的物理距离为684 kb。根据Silkworm Genome Informatics Database网站(http:∥sgid.popgenetics.net/)提供的基因注释信息,定位区间内共包含33个候选基因(KWMTBOMOD1363-1395)。
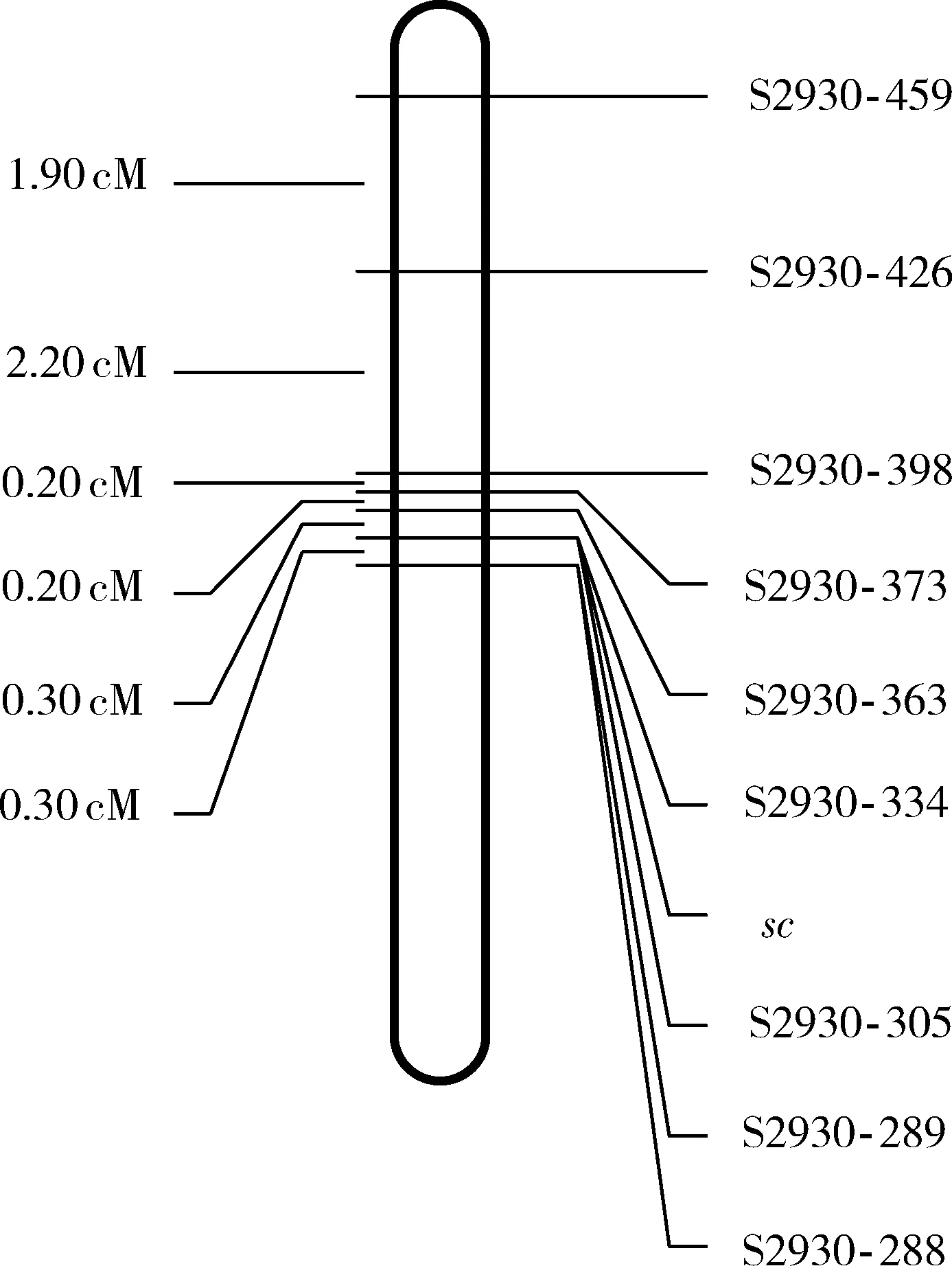
图4 飞天蚕小茧突变体基因sc与多态性SSR标记之间的遗传连锁图Fig. 4 Genetic linkage map between the sc gene ofspace silkworm (Bombyx mori) andpolymorphic SSR markers

表3 家蚕基因组连锁群精细定位SSR分子标记引物Table 3 Fine mapping primers of SSR markers of the linkage groups of Bombyx mori
2.5 家蚕sc突变体的候选基因及其预测功能
通过在NCBI数据库中的比对,得到了定位区间内候选基因及其预测功能(表4),其中,KWMTBOMOD1363到KWMTBOMOD1384位于标记S2930-363和S2930-334之间,KWMTBOMOD1385到KWMTBOMOD1393位于标记S2930-334和S2930-305之间,KWMTBOMOD1394和KWMTBOMOD1395位于标记S2930-305和S2930-289之间。 根据NCBI数据库中的基因注释,KWMTBOMOD1364, KWMTBOMOD1366, KWMTBOMOD1377, KWMTBOMOD1378, KWMTBOMOD1388, KWMTBOMOD1390和KWMTBOMOD1391功能未知;而KWMTBOMOD1365, KWMTBOMOD1367, KWMTBOMOD1368, KWMTBOMOD1372, KWMTBOMOD1374, KWMTBOMOD1375, KWMTBOMOD1381, KWMTBOMOD1387, KWMTBOMOD1392和KWMTBOMOD1393功能与家蚕的生长发育无直接关联。

表4 家蚕sc突变体的33个候选基因及其预测功能Table 4 The predicted functions of the 33 candidate genes in sc mutant of Bombyx mori
另一些基因的功能可能与家蚕的生长发育有关,如KWMTBOMOD1363在中胚层细胞分配到特定组织的生理活动中发挥重要作用,包括体中胚层、心脏、内脏中胚层、脂肪体和中胚层神经胶质(Wongetal., 2008);KWMTBOMOD1369和KWMTBOMOD1370的功能与几丁质相关,可能参与家蚕眠期新表皮的形成(Tangetal., 2010);KWMTBOMOD1371和KWMTBOMOD1373与家蚕体内视黄醇的合成代谢有关,视黄醇有促进生长发育,增加抵抗力的作用(Sharifetal., 2020);KWMTBOMOD1376主要功能与家蚕的先天免疫有关(Lietal., 2021);KWMTBOMOD1382与细胞中营养物质、无机离子和药物的吸收和运输有关(Sunetal., 2017);在哺乳动物中,KWMTBOMOD1383和KWMTBOMOD1384的同源基因与组织器官发育以及肿瘤等疾病发生发展密切相关(崔雅璐等, 2018);KWMTBOMOD1385在有丝分裂原活化蛋白激酶(mitogen-activated protein kinase, MAPK)级联反应中发挥重要作用(Nakagamietal., 2004)。在哺乳动物中,KWMTBOMOD1389, KWMTBOMOD1394和KWMTBOMOD1395的同源基因与癌症的发生和发展有关(Yanagawaetal., 2011);KWMTBOMOD1379, KWMTBOMOD1380和KWMTBOMOD1386与家蚕体内的能量代谢和神经发育有关,推测这3个基因是家蚕sc突变体的候选基因。
续表4 Table 4 continued
3 讨论
本研究将目的基因sc初步定位在SSR标记S2930-363和S2930-289之间(图4),定位区间内包含33个候选基因(表4)。目前,精细定位遇到一些困难,S2930-334和S2930-305在BC1M群体内未出现交换个体。原因之一可能是定位区间内存在多个调控基因,影响了精确定位的结果,吴美娜等(2020)在淡红卵突变体rep的定位研究中发现rep除了受控于目的基因rep-1外,还受到该连锁群上红卵突变体突变基因MFS基因的影响,因此,推测突变体sc的性状可能由定位区间内的多个基因协调控制。其次,郭军等在空间诱变条件下意大利蜜蜂Apismelliferaligustica和卡尼鄂拉蜂Apismelliferacarnica后代的波动性不对称研究中,发现连续自交和空间诱变会导致蜜蜂后代的波动性不对称增加(Sheridan and Pomiankowski, 1997; 郭军和罗其花, 2009),而突变体sc在饲养过程中的确出现了发育不齐的情况,这给选育sc纯合系带来了困难。今后将继续培养sc纯合系,并组配更大的作图群体,进行进一步的精细定位。
目前,已发现的矮小蚕突变体有:矮小蚕Df(幼虫发育迟缓,有隐性致死作用,连锁群不明)、辻田小蚕Df-t(γ射线照射而得,纯合体胚胎期致死,突变基因定位在20号连锁群11.0 cM座位)、K矮小蚕dw-k(幼虫体型小,发育迟缓,突变基因定位在11号连锁群0.0 cM座位)、致死矮小蚕dw(1龄幼虫第3天起发育缓慢,不能就眠,呈油蚕状,幼虫期纯合致死,连锁群不明)、矮小不眠蚕nm-d(幼虫1龄不能就眠,在第10日死亡,突变基因定位在9号连锁群,但其座位不明)等(吕鸿声, 1991)。代方银等(2009)发现了一种新的体形突变体——短体蚕Sq,并将其定位在家蚕第14连锁群。sc的突变基因不同于已发现的矮小蚕突变基因。根据前人的研究发现一些参与生长调控基因的信息,通过比较分析初步筛选出3个候选基因KWMTBOMOD1379, KWMTBOMOD1380和KWMTBOMOD1386。KWMTBOMOD1379和KWMTBOMOD1380在NCBI数据库中的注释信息为家蚕线粒体中的丙酮酸脱氢酶复合体(pyruvate dehydrogenase complex, PDC)中的乙酰转移酶成分,PDC催化丙酮酸转化为乙酰辅酶A,参与三羧酸循环,决定着生物体内营养成分的分配(Naitoetal., 1998),该基因的缺陷会导致代谢障碍,组织受损(崔玉娟和刘晓晴, 2007),果蝇致死突变体之一即为PDC功能缺失的突变体(Spradlingetal., 1999)。KWMTBOMOD1386在NCBI数据库中标注为家蚕神经肽前体蛋白K5[B.moriputative neuropeptide precursor protein(K5), BmK5],它存在于家蚕大脑和额神经节特定细胞的细胞质中,可能参与了几种神经肽的合成(Mitsumasuetal., 2009)。Deng等(2014)利用RNAi技术降低家蚕神经肽F受体(neuropeptide F receptor, NPFR)表达量之后,发现家蚕食桑量减少,体重显著下降。王平阳等发现紫色类鹑斑突变体的突变基因为BmOrk,该神经肽的突变同时导致了突变体发育不齐,食桑量少等性状(Wangetal., 2019)。后续将克隆这些候选基因,并设计RNAi实验以验证基因功能,来阐明小茧突变的分子机制。
本研究中,sc作为一种新的矮小蚕突变体,具有体形短而瘦的显著表型特征,并且性状可以稳定遗传。生物体的体型控制是一个复杂的过程,科研工作者在黑腹果蝇Drosophilamelanogaster、烟草天蛾Manducasexta和家蚕等昆虫的研究中,发现激素和营养信号通路中的许多基因参与了体型大小的调控(Mirth and Riddiford, 2007; Nijhout, 2015)。张忠杰等利用基因编辑技术敲除家蚕保幼激素关键代谢酶基因BmJHE后,家蚕幼虫发育时间延迟,使得家蚕体型变大(Zhangetal., 2017)。我们用保幼激素处理5龄幼虫,未能拯救突变体回复,初步排除JH合成通路基因突变的可能性。今后将对TG和sc进行转录组测序,分析导致sc性状形成的各种通路中的基因差异。
- 昆虫学报的其它文章
- Analysis of the transcriptomes of Galeruca daurica(Coleoptera: Chrysomelidae) adults at different summer diapause stages
- Influence of foliar fertilizers on the development and reproduction of the citrus red mite, Panonychus citri (Acari: Tetranychidae), and the growth of citrus seedlings
- 敲减神经肽F基因(npf)对亚洲玉米螟取食、生长发育和繁殖的影响
- 黑水虻抗菌肽HI-3对人结肠癌HCT-8细胞谷氨酰胺和谷氨酸代谢通路的影响
- 荻草谷网蚜唾液蛋白基因Sm13498的克隆及功能分析
- 草地贪夜蛾成虫复眼明暗适应及黄光照射下明适应状态转化率

