敲减神经肽F基因(npf)对亚洲玉米螟取食、生长发育和繁殖的影响
石 坚, 王 原, 梁 佳, 杜 娟, 赵章武
(中国农业大学植物保护学院昆虫系, 农业农村部作物有害生物监测与绿色防控重点实验室, 北京 100193)
神经肽F(neuropeptide F, NPF)属于高等动物神经肽Y(neuropeptide Y, NPY)家族,是无脊椎动物特有的神经肽,因其序列C末端的一个酪氨酸(Y)被苯丙氨酸(F)取代,故命名为NPF (Mauleetal., 1991; Rajparaetal., 1992; de Jong-Brinketal., 2001)。NPF最初在莫尼兹绦虫Moniezaexpansa上发现(Mauleetal., 1991),此后通过特异性血清,在马铃薯甲虫Leplinotarsadecemlineata(Spittaelsetal., 1996)与沙漠蝗Schistoceracagregaria(Veenstra and Lambrou, 1995)等无脊椎动物中发现由8~10个氨基酸组成的NPF短肽(short neuropeptide F, sNPF)。1999年在黑腹果蝇Drosophilamelanogaster中鉴定到了NPF长肽(Brownetal., 1999)。
昆虫NPF主要在脑与肠道中表达(Brownetal., 1999; Wuetal., 2003, 2005a, 2005b; Krashesetal., 2009; Yueetal., 2016, 2017),因此也称之为脑-肠肽(brain-gut peptide)。通过原位杂交与免疫荧光技术,NPF首先定位在黑腹果蝇的脑和中肠中(Brownetal., 1999; Marianes and Spradling, 2013; Veenstraetal., 2014)。随着NPF-Gal4果蝇转基因系统的构建,脑中NPF的定位更加精确。在黑腹果蝇3龄幼虫脑中发现有6个表达NPF的神经元,其中两对在前脑背部与中部,另一对在食道下神经节(Wuetal., 2003, 2005a, 2005b)。羽化后的果蝇成虫其NPF在脑中的表达表现出雌雄的性二型性特征,其中雄成虫脑中含有26个表达NPF的神经元,而雌成虫中在背侧神经元(lateral dorsal neurons, LNds)多出3对生物钟相关的神经元,参与果蝇睡眠和节律的调节 (Leeetal., 2006)。此后在其他昆虫脑中陆续发现NPF的表达,如吸血蝽Rhodniusprolixus(Gonzalez and Orchard, 2008)、棉铃虫Helicoverpaarmigera(Huangetal., 2011)和东亚飞蝗Locustamigratoriamanilensis(Houetal., 2017)等。
在昆虫中,NPF对幼虫的取食具有重要的调控作用。在黑腹果蝇中,幼虫随着NPF及其受体NPFR1的升高而增加其取食量,当幼虫进入徘徊期之前会停止取食而化蛹,此时幼虫体内的NPF表达量显著下降(Wuetal., 2003)。此外,过表达NPF或其受体NPFR1,黑腹果蝇幼虫取食更多的有害食物 (Wuetal., 2005b),说明NPF不仅调控幼虫的取食量,而且还调控着幼虫对食物选择的敏感性。Van Wielendaele等(2013)研究了NPF对沙漠蝗的取食调控作用,发现NPF表达量的增加伴随着沙漠蝗体重和取食量的增加,而降低NPF后出现相反的情况。鳞翅目的棉铃虫、烟青虫Helicoverpaassulta以及亚洲玉米螟Ostriniafurnacalis在NPF取食研究中也得到了相似的结论(Liuetal., 2013; Yueetal., 2016; Yueetal., 2017; Yue and Zhao, 2017; Cuietal., 2020)。
近年来,由NPF的取食调控延伸出的发育和寿命调控得到广泛的关注。在发育调控方面,Kannangara等(2020)报道了黑腹果蝇中摄食和发育协调的机制。NPF受体通过反向调控胰岛素信号通路和正向调控前胸腺中蜕皮激素的分泌来影响发育过程,包括发育时间、生长速率和体型大小。由于NPF并不在幼虫的前胸腺中表达,表明NPF释放可能激活前胸腺细胞中的NPFR (Kannangaraetal., 2020)。因此,在营养应激下产生的NPF既可以通过脑内的NPFR神经元调节摄食行为,也可以通过前胸腺中的NPFR调节发育,从而协调摄食行为和发育。
亚洲玉米螟是一种鳞翅目螟蛾科的害虫,主要分布在包括中国在内的东亚及东南亚等地区。作为一种发生面积广、危害严重的害虫,亚洲玉米螟在我国每年会造成春玉米减产10%,夏玉米减产20%~30%左右,严重的年份甚至可造成30%以上的损失。在热带农业国家,如菲律宾,亚洲玉米螟已经成为最具破坏性的玉米害虫。此外,玉米螟寄主植物广泛,除为害玉米外,田间寄主植物有8科20种,包括酸模叶蓼Polygonumlapathifolium、谷子和薏苡Setariaitalica等(袁志华等, 2015)。
RNA干扰(RNA interference, RNAi)是一种通过同源双链RNA(dsRNA)特异性敲低目的基因表达量的技术,在基因功能领域它是一种有效的研究手段(Hannon, 2002; Geley and Müller, 2004)。这种基因沉默的方式是一种内源转录后的基因沉默(post-transcriptional gene silencing, PTGS)机制, dsRNA转化为小干扰RNA(siRNA),最终使得mRNA快速降解,这种降解发生在细胞质中,可导致正常基因功能的沉默(Hammond, 2005)。在过去的几十年间,已经有许多文章报道了该技术在害虫防治领域的有效应用,包括喷洒、饲喂和注射(Baumetal., 2007; Wangetal., 2011; Zhangetal., 2013)。昆虫dsRNA的饲喂方法首次在秀丽隐杆线虫Caenorhabditiselegans中使用以来 (Fireetal., 1998),已成功地应用于昆虫发育、繁殖、行为和免疫等多种生理过程的基因功能鉴定。例如,通过饲喂双链RNA,可以引起苹果浅褐卷叶蛾触角中某些基因的表达量降低 (Turneretal., 2010)。在本研究中,为了增加其有效和实用性,我们利用了一种RNaseⅢ缺陷型的大肠杆菌EscherichiacoliBL21(DE3)菌株,其内部由于插入了Tn10转座子,导致rnc基因无法表达RNase Ⅲ,从而使得dsRNA可以大量表达(Maetal., 2020)。
我们在亚洲玉米螟中发现,NPF调控幼虫取食行为(Yueetal., 2017)。然而,下调NPF的幼虫是否能正常生长发育、正常化蛹以及正常交配和生殖?为了进一步阐明这些问题,本研究通过连续饲喂dsNPF和dsGFP,探究了NPF对亚洲玉米螟生长发育和繁殖的影响和调控作用,为NPF在田间害虫的防治应用提供了重要依据。
1 材料与方法
1.1 供试昆虫
实验所用亚洲玉米螟采自中国农业大学上庄实验站,由中国农业大学昆虫生理生化与分子生物学实验室饲养。幼虫以人工饲料饲喂于塑料养虫盒(20 cm×14 cm×8 cm)中,亚洲玉米螟化蛹后从饲料中拣出,转入养虫笼中以5%蜂蜜水喂养,养虫笼顶部罩一层蜡纸供成虫产卵,每天将有卵的蜡纸替换下来放到养虫盒中待其孵化。饲养条件为:温度28℃,相对湿度60%左右,光周期16L∶8D。
亚洲玉米螟人工饲料配方如下:玉米粉150.0 g,大豆粉150.0 g,葡萄糖75.0 g,抗坏血酸4.0 g,琼脂22.0 g,酵母粉90.0 g,山梨酸5.0 g,水1 400 mL。具体配制方法如下:玉米粉150 g,大豆粉150 g,酵母粉90 g, 充分混匀后在烘箱中120℃烘烤1 h; 食用葡萄糖75 g,抗坏血酸4 g,加1 000 mL水溶解后倒入烘烤好的混合物中,充分搅拌,静止发酵1 h;称取40 g玉米粉加适量水煮沸,称取22 g琼脂加适量水(共700 mL)搅拌均匀,倒入沸腾的水中继续小火煮沸,煮沸后5 min停火晾凉至60℃左右;称取山梨酸5.0 g加入混合物中并充分搅拌,快速倒入灭菌的医用白瓷盘中,冷却后置于4℃冷藏备用。
1.2 dsRNA表达载体的构建与dsRNA的合成
本实验参考Ma等(2020)基于工程菌高效合成dsRNA的方法,分别构建dsNPF和dsGFP表达载体。其中,dsNPF表达载体的构建是通过设计的dsNPF双链序列扩增出393 bp和349 bp两个片段,然后分别用XbaⅠ-HindⅢ(TaKaRa)和XhoⅠ-HindⅢ酶切消化,形成颈环结构。而dsGFP表达载体的构建是通过设计的dsGFP双链序列扩增出447 bp和403 bp两个片段,然后分别用XbaⅠ-HindⅢ(TaKaRa)和XhoⅠ-HindⅢ酶切消化,形成颈环结构。将形成的颈环结构片段克隆到pET-28a的XbaⅠ-XhoⅠ位点,生成pET28-NPF和pET28-GFP。以上载体构建引物由生工生物股份有限公司合成,序列详见表1。

表1 本研究所用引物Table 1 Primers used in this study
将pET28-NPF和pET28-GFP分别转化至BL21(DE3) RNaseⅢ菌株(Maetal., 2020),细胞于37℃孵育过夜。挑取单个克隆,在Kan抗性培养基中37℃培养过夜。将100 μL培养液稀释至15 mL含有Kan的LB培养基中,37℃震荡。当OD值到达0.4时,加入终浓度为1 mmol/L IPTG, 29℃在摇床中220 r/min诱导过夜。用乙醇固定法提取含有大量双链目的基因的总RNA。
1.3 饲喂dsGFP和dsNPF进行RNAi
待人工饲料冷却至少10 min后,分别将dsGFP和dsNPF与人工饲料混合,使其终浓度分别为0.01%(10 mg dsRNA混合100 g饲料)和0.02%(20 mg dsRNA混合100 g饲料),分别饲喂刚孵化的亚洲玉米螟1龄(低龄)及刚蜕皮的3龄(中龄)和5龄(高龄)幼虫,其中1龄开始处理的虫数为150头,3龄和5龄开始处理的虫数为80头;每处理包含3个生物学重复。每天更换含有dsGFP和dsNPF的人工饲料,以确保双链的有效干扰。
1.4 RNAi后亚洲玉米螟幼虫npf基因表达量的检测
以含dsGFP和dsNPF的人工饲料饲喂10头5龄初幼虫24 h后,利用Trizol法(宝生物工程, 大连)提取亚洲玉米螟幼虫中肠总RNA,并用超微量紫外分光光度计NanoDrop8000(Thermo, 美国)检测RNA浓度和纯度。以提取的总RNA为模板,按照PrimeScriptTMRT Reagent Kit with gDNA Eraser (Perfect Real Time)反转录试剂盒说明书(TaKaRa, 大连)合成单链cDNA。
利用Primer Premier 5设计npf基因的荧光定量引物(表1)。引物的合成由生工生物股份有限公司合成。根据SuperReal PreMix Plus (SYBR Green) 试剂盒(天根生化,北京)进行qPCR检测。每处理含3个生物学重复,每生物学重复含有3次技术重复。反应体系(20 μL): 2×Taq MasterMix 10 μL, 50×ROX 2 μL, RNase-Free dH2O 5.8 μL, 上下游引物(10 μmol/L)各0.6 μL, cDNA 1 μL。反应条件: 95℃ 15 min; 95℃ 10 s, 60℃ 30 s, 40个循环。
1.5 RNAi后亚洲玉米螟生长发育和繁殖指标观测
从饲喂dsGFP和dsNPF的人工饲料后持续观察直至虫体死亡,每日测量并记录幼虫体长、体重、原始人工饲料重、剩余饲料重、无幼虫饲料重(对照,排除水分蒸发对结果的影响)、粪便重、存活数、死亡数和幼虫龄期。取食量的计算方法为:称量新鲜的含dsRNA饲料的重量(mL)及表面积一致的不含dsRNA饲料的重量(n1,空白对照,用于检测水分蒸发量),饲喂24 h后,将虫子和粪便挑出,再次称量取食后的含dsRNA重量(m2)及空白对照饲料重量(n2),此24 h的取食量=m1-m2-(n1-n2)。化蛹率计算方法为:蛹数/5龄幼虫数×100%;羽化率计算方法为:成虫数/蛹数×100%。幼虫各龄期和蛹发育历期统计和计算方法为:50%个体进入到下一龄期或下一虫态所需天数;成虫寿命是指羽化进成虫至死亡的时间;单雌产卵量是指单头雌虫产卵的总量。
体重、体长和取食量的检测为5龄检测指标的平均值;除存活率、化蛹率和羽化率外,其余指标均为个体数据。以上实验均含3个生物学重复。
1.6 数据分析
利用GraphPad Prism, version 5.01(GraphPad Software, San Diego, CA)软件进行数据分析,所有结果均以平均值±标准误来表示,采用独立样本t检验进行差异显著性分析。
2 结果
2.1 dsGFP和dsNPF的鉴定及干扰效率验证
将850 bp的GFP基因片段和742 bp的npf基因片段分别以正义和反义方向克隆到pET28a载体上,其中分别含有一个86 bp和一个79 bp的环状结构。将构建的重组质粒转化到BL21(DE3) RNaseⅢ中生成目标dsRNA,利用1%的琼脂糖凝胶进行大小鉴定,其中dsNPF为322 bp,dsGFP为412 bp (图1: A)。
将获得的dsRNA与玉米螟人工饲料混合,饲喂5龄初幼虫24 h后,解剖亚洲玉米螟幼虫中肠,检测npf的表达量。结果显示,dsNPF干扰后,npf在亚洲玉米螟幼虫中肠中的表达量显著下降了40.9%(P<0.001)(图1: B),证明dsRNA是有效的。
2.2 NPF对亚洲玉米螟幼虫的影响
2.2.1对幼虫取食量的影响:我们用0.01%和0.02%的dsNPF和dsGFP(对照)分别饲喂刚孵化的1龄幼虫、刚蜕皮的3龄幼虫和刚蜕皮的5龄幼虫,然后测定5龄幼虫的平均取食量。从1, 3和5龄幼虫开始饲喂0.01% dsNPF时,与饲喂0.01% dsGFP的对照相比,处理组5龄幼虫取食量分别显著下降了13.84%(P<0.05), 33.33%(P<0.001)和36.40%(P<0.01) (图2: A);同样情况下从1, 3和5龄幼虫开始饲喂0.02% dsNPF时,与饲喂0.02% dsGFP的对照相比,5龄幼虫取食量分别显著下降了34.33%(P<0.01), 38.20%(P<0.01)和42.52%(P<0.01)(图2: B)。这些结果说明,0.01% dsNPF对亚洲玉米螟幼虫取食的影响是非常有效的;dsNPF处理不同幼虫期对其取食量的影响是相似的。
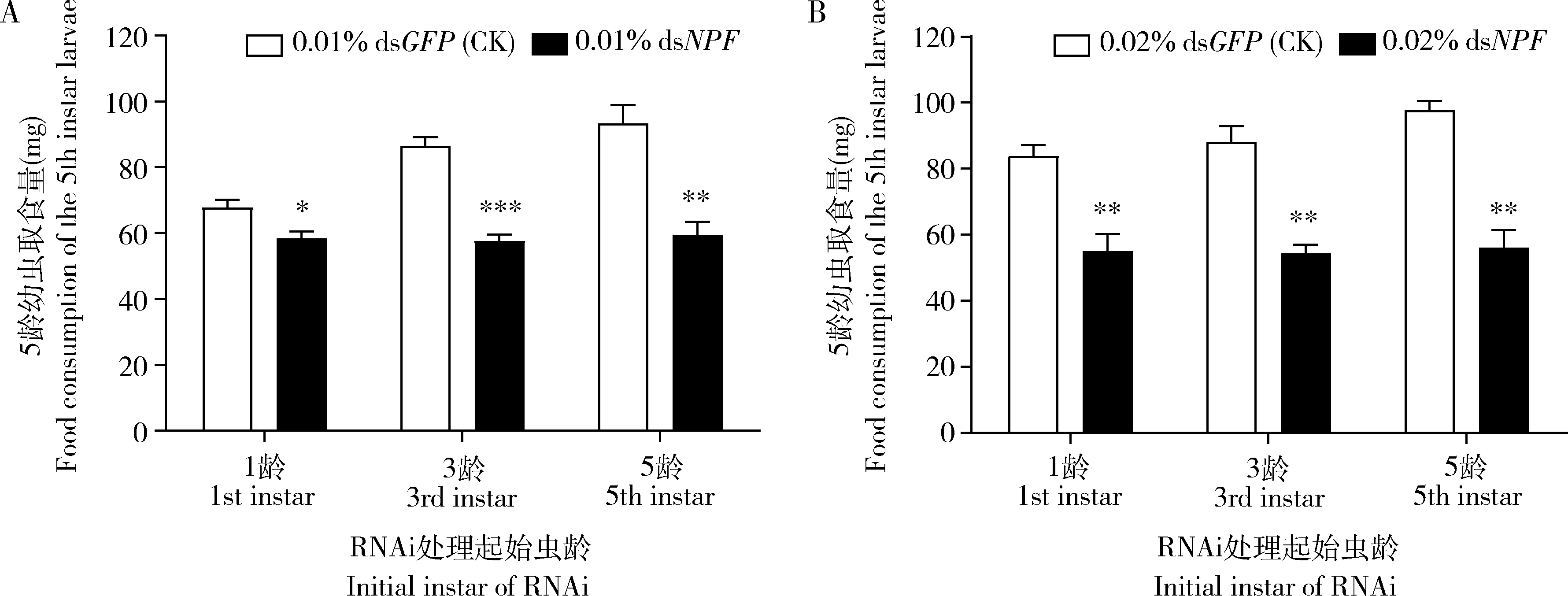
图2 0.01%(A)和0.02%(B) dsNPF处理对亚洲玉米螟5龄幼虫取食量的影响Fig. 2 Impacts of 0.01% (A) and 0.02% (B) dsNPF on the food consumption of the 5th instar larvae of Ostrinia frunacalis图中数据为平均值±标准误。Data in the figure are mean±SE. nsP>0.05; *P<0.05; **P<0.01; ***P<0.001(独立样本t检验Independent samples t-test). 下图同The same for the following figures.
2.2.2对幼虫体重的影响:用0.01% dsNPF饲喂亚洲玉米螟1龄直至5龄幼虫时,与饲喂0.01% dsGFP的对照相比,处理幼虫的体重显著下降了25.84%(45.95±2.88 mgvs61.96±1.82 mg,P<0.01);从3龄开始饲喂到达5龄时,0.01% dsNPF处理组幼虫体重显著下降了23.16%(44.20±2.10 mgvs57.52±1.76 mg,P<0.01);从5龄初开始饲喂到达5龄末时,0.01% dsNPF处理组幼虫体重显著下降36.85%(40.82±0.84 mgvs64.64±1.31 mg,P<0.001) (图3: A)。
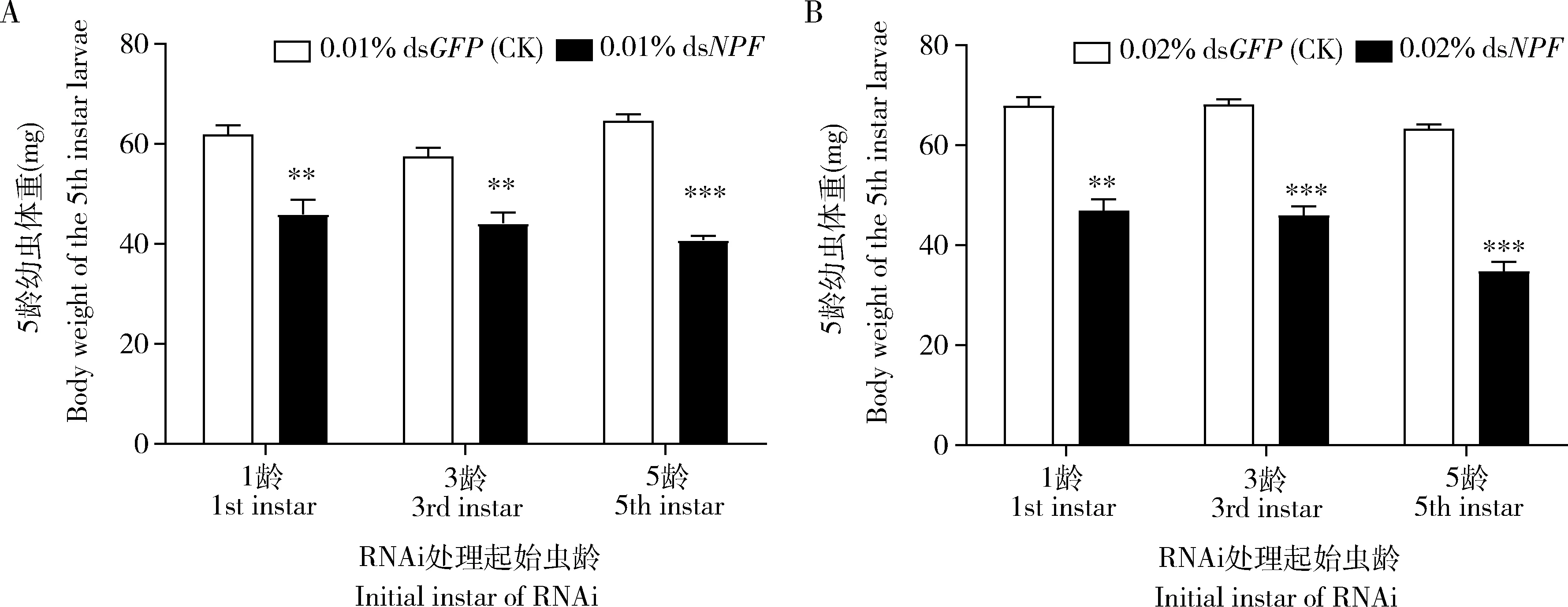
图3 0.01% (A)和0.02%(B) dsNPF处理对亚洲玉米螟5龄幼虫体重的影响Fig. 3 Impacts of 0.01% (A) and 0.02% (B) dsNPF on the body weight of the 5th instar larvae of Ostrinia frunacalis
用0.02% dsNPF饲喂1龄幼虫直至5龄时,与饲喂0.02% dsGFP的对照相比,处理幼虫的体重显著下降了30.88%(46.98±2.24 mgvs67.97±1.76 mg,P<0.01);从3龄开始饲喂到达5龄时,0.02% dsNPF处理组幼虫体重显著下降了32.61%(45.97±1.87 mgvs68.21±1.02 mg,P<0.001);0.02% dsNPF从5龄初开始处理到5龄末,处理组幼虫体重显著下降了45.04%(34.82±1.86 mgvs63.35±0.91 mg,P<0.001)(图3: B)。
上述结果说明,两种浓度dsNPF处理的不同幼虫期均引起体重的显著下降。此外,因为5龄幼虫是暴食期,在暴食期下调NPF严重干扰或影响了幼虫的生长发育。
2.2.3对幼虫体长的影响:用0.01% dsNPF饲喂亚洲玉米螟1龄直至5龄幼虫时,与饲喂0.01% dsGFP的对照相比,处理幼虫的体长显著下降了26.26%(16.54±0.43 mmvs22.43±0.30 mm,P<0.001);从3龄开始饲喂到达5龄时,0.01% dsNPF处理的幼虫体长显著下降了19.12%(17.81±0.40 mmvs22.02±0.28 mm,P<0.001);从5龄初开始饲喂到达5龄末时,0.01% dsNPF处理的幼虫体长显著下降19.70%(17.41±0.38vs21.68±0.33 mm,P<0.01)(图4: A)。
0.02% dsNPF饲喂1龄幼虫直至5龄时,与饲喂0.02% dsGFP的对照相比,处理幼虫的体长显著下降了30.20%(15.28±0.72 mmvs21.89±0.80 mm,P<0.01);从3龄开始饲喂到达5龄时,0.02% dsNPF处理的幼虫体长显著下降了31.18%(14.81±0.26 mmvs21.52±0.78 mm,P<0.01);0.02% dsNPF从5龄初开始处理到5龄末,其幼虫体长显著下降28.16% (15.59±0.52 mmvs21.70±0.37 mm,P<0.001)(图4: B)。
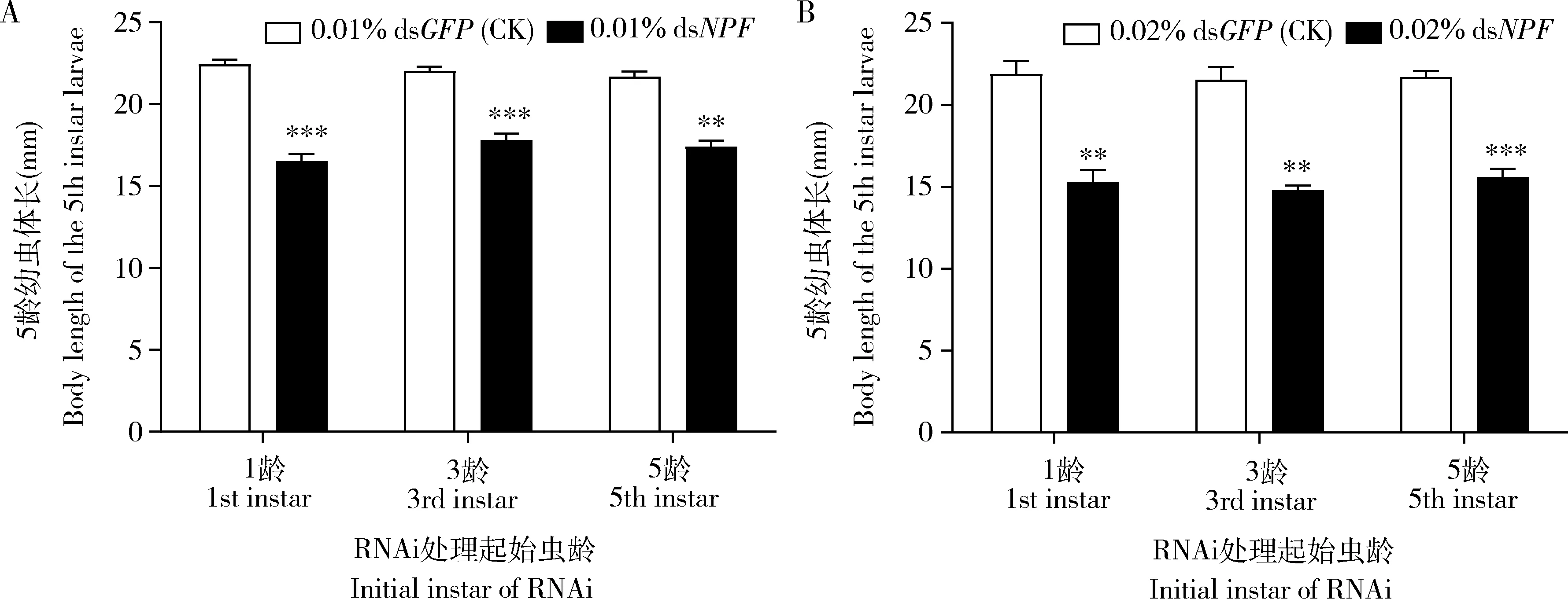
图4 0.01%(A)和0.02%(B) dsNPF处理对亚洲玉米螟5龄幼虫体长的影响Fig. 4 Impacts of 0.01% (A) and 0.02% (B) dsNPF on the body length of the 5th instar larvae of Ostrinia frunacalis
上述结果说明,无论是从1龄、3龄还是5龄幼虫开始饲喂,dsNPF处理组5龄幼虫体长均显著低于对照个体,而高浓度dsNPF较低浓度有更大的影响。
2.2.4对幼虫存活率的影响:用0.01% dsNPF分别饲喂亚洲玉米螟1龄和3龄幼虫直到5龄幼虫,与饲喂0.01% dsGFP的对照相比,处理幼虫的存活率分别显著下降了50.91%(P<0.001)和26.23%(P<0.01) (图5: A)。同样情况下饲喂0.02% dsNPF后,与饲喂0.02% dsGFP的对照相比,处理幼虫的存活率分别显著下降了88.57%(P<0.001)和27.44%(P<0.05) (图5: B)。
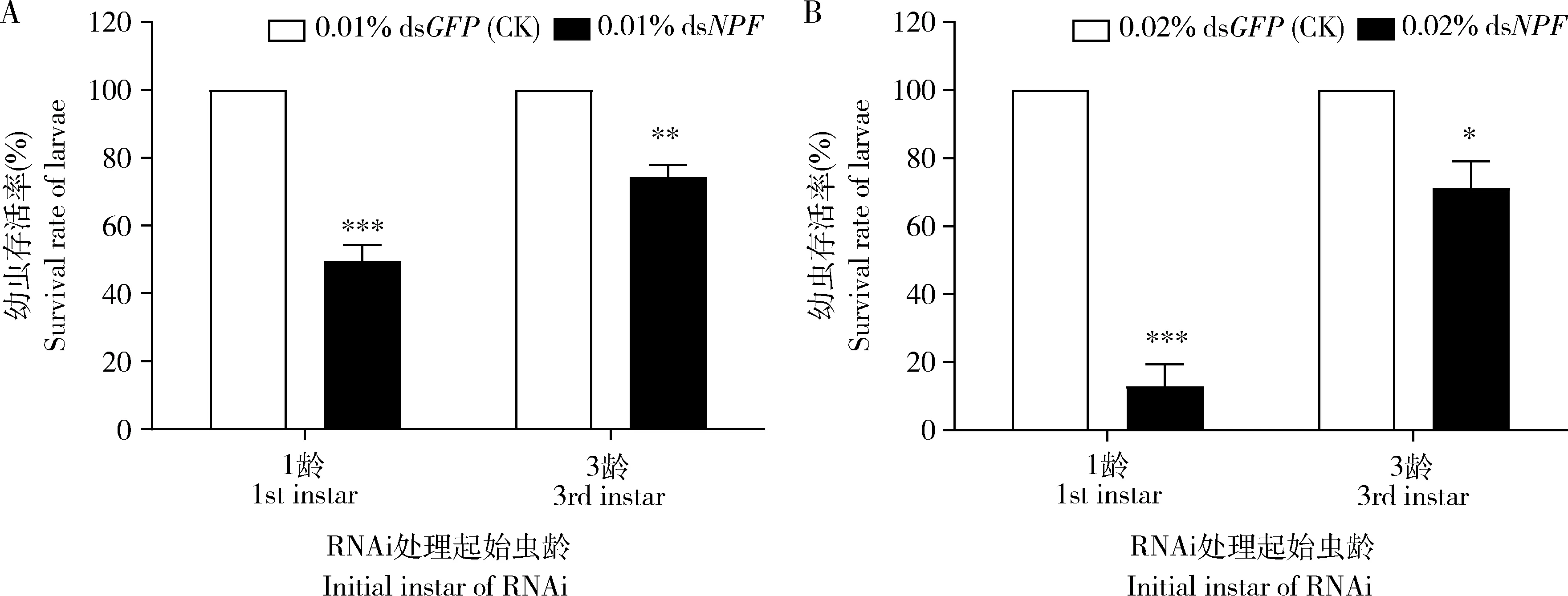
图5 0.01% (A)和0.02% (B) dsNPF处理对亚洲玉米螟幼虫存活率的影响Fig. 5 Impacts of 0.01% (A) and 0.02% (B) dsNPF on the survival rate of Ostrinia frunacalis larvae
上述结果说明:(1)0.01%的低浓度足以对其存活率产生巨大影响; (2)开始饲喂dsNPF的幼虫期越早,其存活率也越低;(3)从1龄开始饲喂dsNPF的个体,其存活率的大幅下降主要集中在3龄前,且随着dsNPF浓度的增加急剧下降;(4)从3龄开始饲喂dsNPF的个体,其存活率的下降相对较缓,说明dsNPF对3龄前幼虫的存活率影响较大。
2.2.5对幼虫发育历期的影响: 用0.01% dsNPF从1龄初开始处理,1-5龄的发育历期与饲喂0.01% dsGFP的对照相比平均延迟了7.00 d(22.00±0.00 dvs15.00±0.58 d,P<0.001),发育延缓的时期主要发生在3龄到5龄幼虫阶段;0.01% dsNPF从3龄初开始处理,3-5龄的发育历期与对照相比平均延迟了5.00 d(14.00±0.58 dvs9.33±0.33 d,P<0.01),而发育延缓的时期主要发生在4-5龄阶段;0.01% dsNPF从5龄初开始处理,5龄的发育历期与对照相比平均延迟了2.00 d(5.67±0.33 dvs3.33±0.33 d,P<0.01)(表2)。
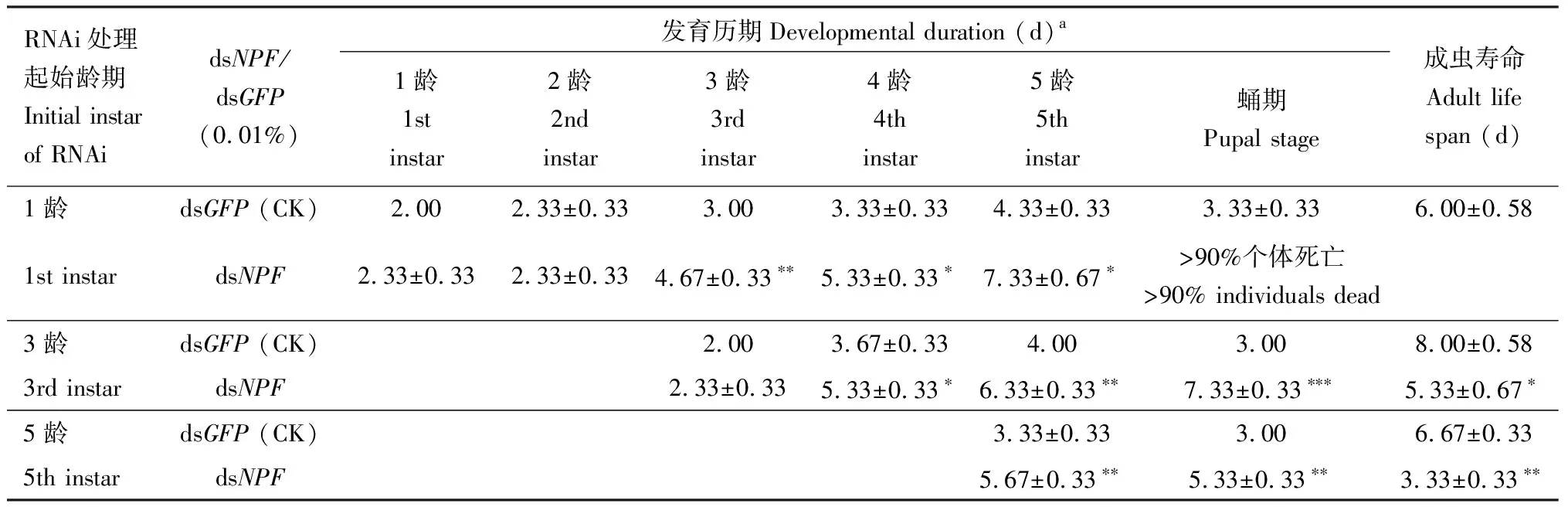
表2 0.01% dsNPF和dsGFP分别处理亚洲玉米螟1, 3和5龄初幼虫后不同幼虫龄期、蛹发育历期和成虫寿命Table 2 Developmental duration of different larval instars and pupae and adult life span after the early 1st, 3rd and5th instar larvae of Ostrinia furnacalis were fed with 0.01% dsNPF and dsGFP, respectively
0.02% dsNPF从1龄初开始处理,1-3龄的发育历期与饲喂0.02% dsGFP的对照相比平均延迟了6.00 d (13.00±0.58 dvs7.33±0.33 d,P<0.01),到4龄时已经有90%以上的个体死亡,不再具有可比性;0.02% dsNPF从3龄初开始处理,3-5龄的发育历期与饲喂0.02% dsGFP的对照相比平均延迟了8.00 d(17.67±0.67 dvs9.00±0.00 d,P<0.001),发育延缓的时期主要发生在4-5龄阶段;0.02% dsNPF从5龄初开始处理,其5龄的发育历期与对照相比平均延迟了4.00 d (7.33±0.33 dvs3.67±0.33 d,P<0.01) (表3)。
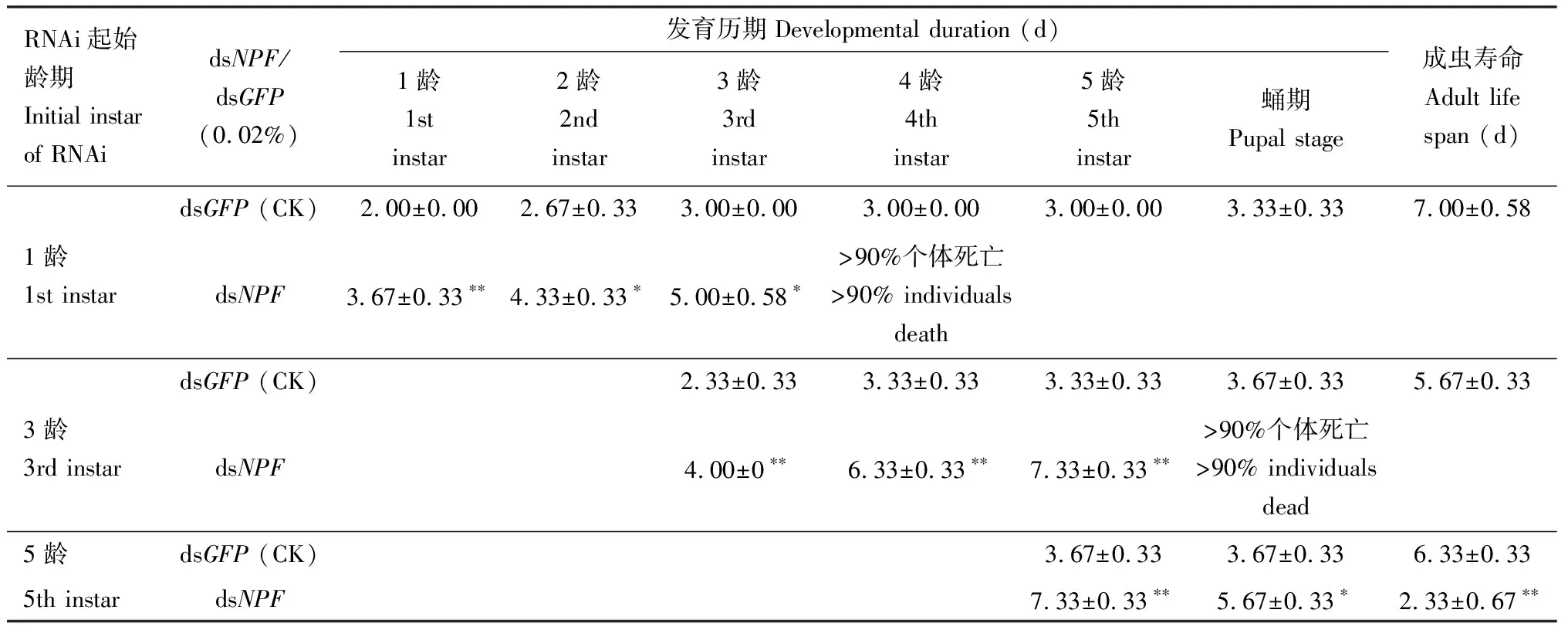
表3 0.02% dsNPF和dsGFP分别处理亚洲玉米螟1, 3和5龄初幼虫后不同幼虫龄期、蛹发育历期和成虫寿命Table 3 Developmental duration of different larval instars and pupae and adult life span after the early 1st, 3rd and5th instar larvae of Ostrinia furnacalis were fed with 0.02% dsNPF and dsGFP, respectively
综合上述结果,NPF对幼虫的发育具有重要的调节作用,npf的RNAi干扰严重影响了幼虫发育的时间,主要表现在:1)相同RNAi浓度下,处理的幼虫龄期越早,幼虫死亡率越高,发育历期越长;2)不同RNAi浓度下,处理浓度越高对发育历期的影响越大,死亡率也越高。
2.2.6对幼虫化蛹率的影响:用0.01% dsNPF分别饲喂亚洲玉米螟1, 3和5龄幼虫,与饲喂0.01% dsGFP的对照组相比,处理组幼虫化蛹率分别下降了27.03%, 18.92%和14.59%(图6: A)。相同条件下用0.02%dsNPF分别饲喂1, 3和5龄幼虫,其中饲喂1龄的幼虫到5龄时死亡率已>90%,从3和5龄开始饲喂的幼虫,与饲喂0.02% dsGFP的对照组相比,处理组幼虫的化蛹率分别下降了39.20%和25.55%(图6: B)。这些结果说明NPF对亚洲玉米螟幼虫的化蛹有显著影响,浓度越高影响越大。
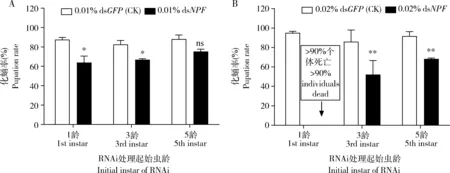
图6 0.01% (A)和0.02%(B) dsNPF处理对亚洲玉米螟化蛹率的影响Fig. 6 Impacts of 0.01% (A) and 0.02% (B) dsNPF on the pupation rate of Ostrinia frunacalis
2.3 NPF对亚洲玉米螟蛹的影响
2.3.1对蛹发育历期的影响:dsRNA从亚洲玉米螟1龄幼虫开始处理时,50%以上个体从蛹到成虫所需时间,饲喂0.01% dsGFP的对照组为3.33±0.33 d,而饲喂0.01% dsNPF的处理组超过90%的个体死亡,不再具有可比性;从3龄幼虫开始饲喂dsRNA时,50%以上个体从蛹期发育到成虫所需时间,对照组为3.00 d,而dsNPF处理组为7.33±0.33 d,延迟了4.33 d(P<0.001);从5龄幼虫开始饲喂dsRNA时,50%的个体从蛹期发育到成虫所需时间,处理组与对照组相比延迟了2.33 d(5.33±0.33 dvs3.00 d,P<0.01)(表2)。
0.02% dsNPF从3龄开始饲喂幼虫,50%以上个体从蛹期发育到成虫所需时间,饲喂0.02% dsGFP的对照组为3.67±0.33 d,0.02% dsNPF处理组超过90%的个体死亡,不再具有可比性。从5龄幼虫开始饲喂dsRNA时,50%以上个体从蛹期发育到成虫所需时间,饲喂0.02% dsNPF的处理组与饲喂0.02% dsGFP的对照组相比延迟了2 d(5.67±0.33 dvs3.67±0.33 d,P<0.05)(表3)。这些结果说明,NPF对蛹的发育有极其显著的影响。
2.3.2对蛹羽化率的影响: 用0.01% dsNPF分别饲喂亚洲玉米螟1, 3和5龄幼虫,其中饲喂的1龄幼虫至5龄死亡率已>90%。与饲喂0.01% dsGFP的对照组相比,从3龄和5龄幼虫开始饲喂0.01% dsNPF的处理组成虫个体的羽化率分别下降了46.61%和15.95%(P<0.01)(图7: A)。相同条件下0.02% dsNPF分别饲喂1, 3和5龄幼虫,其中饲喂的1龄和3龄幼虫至4龄和蛹期死亡率已>90%,不具有可比性。从5龄幼虫开始饲喂0.01% dsNPF的处理组与饲喂0.01% dsGFP的对照组相比,羽化率下降了2.62%(图7: B)。这些结果说明NPF对亚洲玉米螟羽化率有极其显著的影响,处理幼虫期的时间越早影响越大。
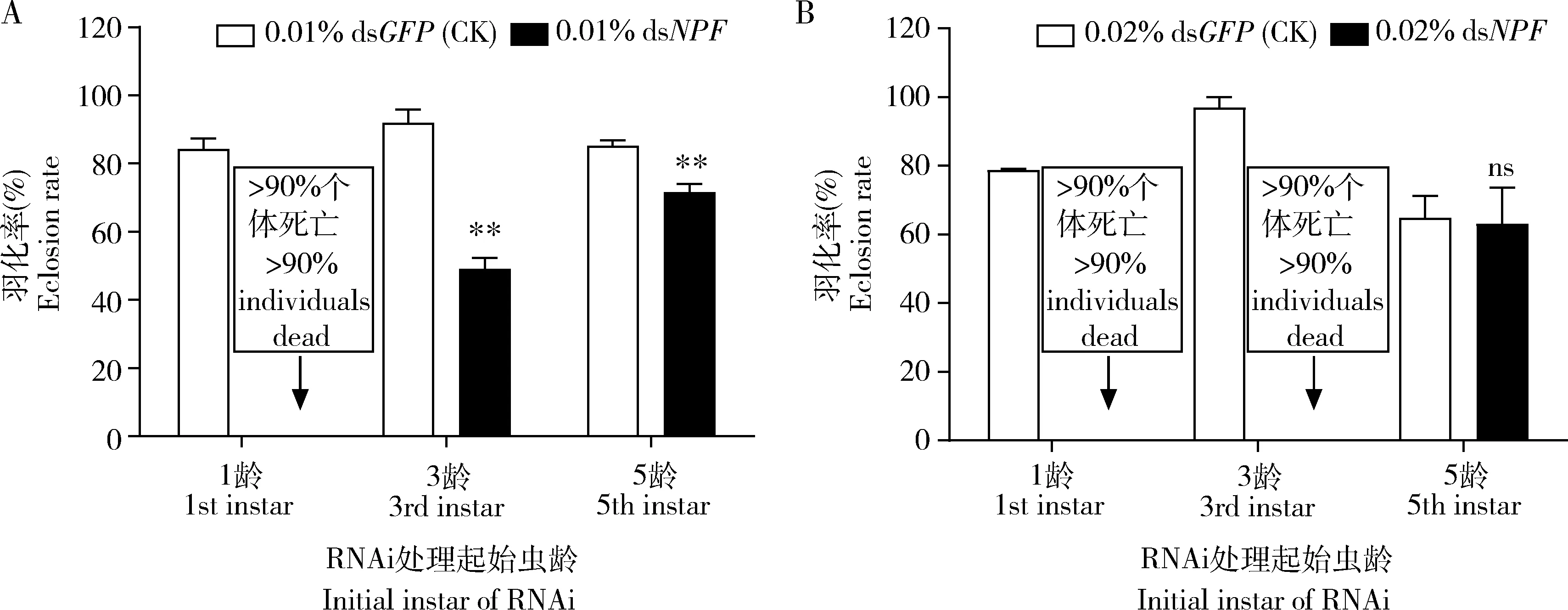
图7 0.01% (A)和0.02%(B) dsNPF处理对亚洲玉米螟蛹羽化率的影响Fig. 7 Impacts of 0.01% (A) and 0.02% (B) dsNPF on the eclosion rate of Ostrinia frunacalis pupae
2.4 NPF对亚洲玉米螟成虫的影响
2.4.1对成虫寿命的影响:用0.01% dsNPF饲喂亚洲玉米螟1龄幼虫,在蛹期死亡率超过了90%,不再具有可比性;用0.01% dsNPF饲喂3龄幼虫,与饲喂0.01% dsGFP的对照相比成虫约提前3 d死亡(8.00±0.58 dvs5.33±0.67 d,P<0.05);用0.01%dsNPF饲喂5龄幼虫,与0.01% dsGFP的对照相比成虫提前3 d死亡(6.67±0.33 dvs3.33±0.33 d,P<0.01)(表2)。用0.02% dsNPF饲喂1龄和3龄幼虫,它们分别在4龄幼虫和蛹期个体死亡率高于90%,不再具有可比性;从5龄幼虫开始饲喂0.02% dsNPF,与饲喂0.02%的对照相比成虫提前4 d死亡(6.33±0.33 dvs2.33±0.67 d,P<0.01)(表3)。综上所述,下调NPF对成虫的寿命有显著影响。
2.4.2对成虫产卵的影响:用0.01% dsNPF饲喂1龄初幼虫,羽化到到成虫时雌虫平均个体数仅有6头,与饲喂0.01% dsGFP的对照相比, 成虫单雌产卵量下降了92.70%(50.68±12.13vs3.70±2.42,P<0.05);用0.01% dsNPF饲喂3龄初幼虫,与饲喂0.01% dsGFP的对照相比,成虫单雌产卵量下降了90.15%(44.69±7.37vs4.40±0.65,P<0.01),而用0.01% dsNPF饲喂5龄初幼虫,与饲喂0.01% dsGFP的对照相比,成虫单雌产卵量下降了44.12%(41.48±9.33vs23.18±5.91,P>0.05)(图8: A)。
用0.02% dsNPF饲喂1龄初幼虫,羽化到成虫时雌虫平均个体数仅有1头,不再具有可比性; 用0.02% dsNPF饲喂3龄初幼虫,雌虫平均个体数仅有8头,与饲喂0.01% dsGFP的对照相比, 成虫单雌产卵量下降了23.55%(36.60±6.10vs27.98±7.80,P>0.05);用0.02%dsNPF饲喂5龄幼虫,与饲喂0.02% dsGFP的对照相比,成虫单雌产卵量下降了2.31%(63.11±4.56vs61.65±8.85,P>0.05)(图8: B)。这些结果表明,dsNPF干扰对1龄和3龄开始处理的幼虫其单雌产卵量有显著的抑制作用。
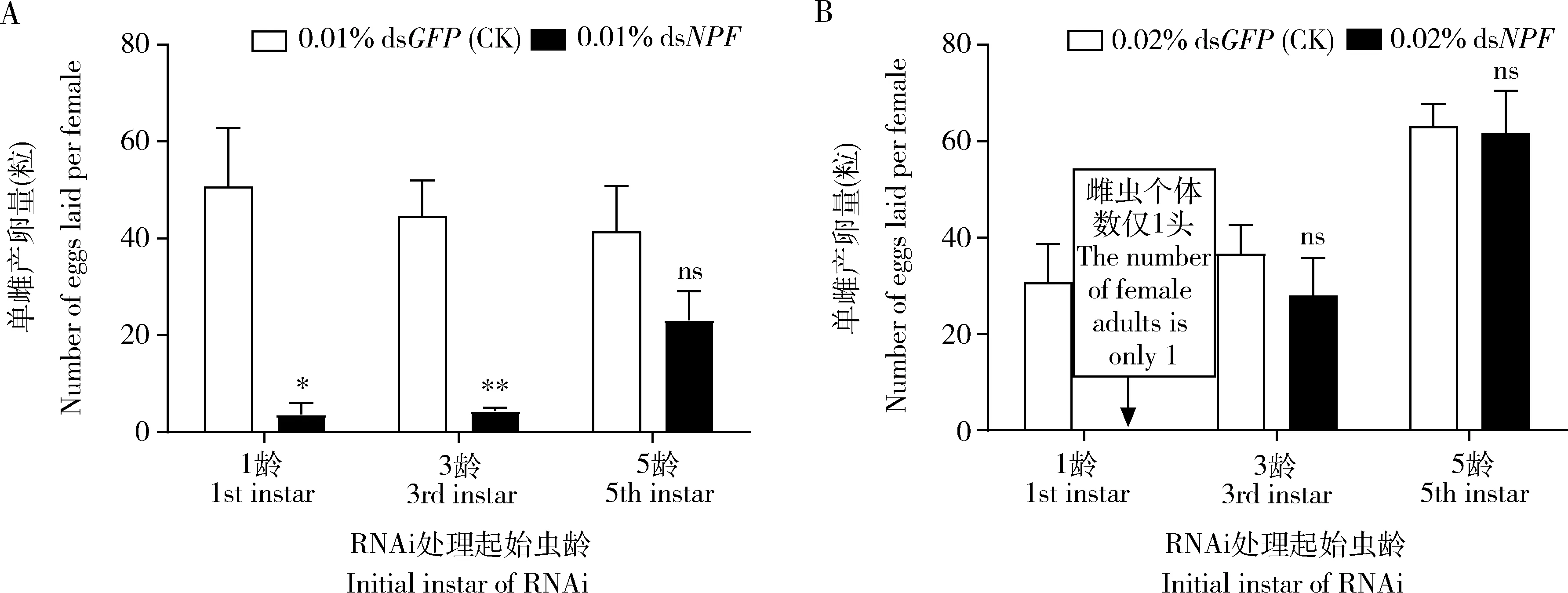
图8 0.01%(A)和0.02%(B) dsNPF对亚洲玉米螟成虫单雌产卵量的影响Fig. 8 Effect of 0.01% (A) and 0.02% (B) dsNPF on the number of eggs laid per female by Ostrinia frunacalis adults
3 讨论
NPF是一种多功能的神经肽,涉及取食、交配与产卵(Wielendaeleetal., 2013),睡眠与生物钟节律(Heetal., 2013a, 2013b),学习行为(Krashesetal., 2009),酒精敏感度(Wenetal., 2005),攻击行为(Dierick and Greenspan, 2007),保幼激素的合成(Wangetal., 2012)和聚集/分散状态(Houetal., 2017)等调控。其中重要的功能之一是对幼虫取食的调控,充分了解NPF对亚洲玉米螟幼虫取食调控和生长发育的影响,将为玉米螟的新型防治策略提供理论依据。
在本研究中,我们采用了一种新的基于工程菌大量生产dsRNA的方法替代传统的试剂盒合成dsRNA,可以更经济地获得大量的dsRNA(图1),同时通过每天更换含有一定浓度dsRNA的饲料,保证个体在幼虫取食阶段均在dsRNA的有效干扰之下,使得研究NPF对亚洲玉米螟整个生活史的影响成为可能。
近年来,在果蝇的研究中发现,NPF协调摄食行为和发育过程,即NPF通过脑内的NPFR神经元调节摄食行为,同时通过前胸腺中的NPFR调节发育,从而协调摄食行为和发育。当敲低前胸腺中的NPFR表达时,仅果蝇幼虫的个体大小发生差异,并未有取食量的降低(Kannangaraetal., 2020),说明NPF调控的生长发育和取食行为是相互独立的。本研究中,我们发现敲减npf基因表达对亚洲玉米螟幼虫的取食、存活率、体重、体长,以及化蛹率和羽化率均产生很显著的影响(图2~8),其中对取食量的影响(图2)是十分重要的,取食量的降低直接导致生长发育的延缓(表2~3),和死亡率的显著提高(图5)。
从本研究中可以看出,不同浓度的dsRNA、不同的处理阶段均会对RNAi的效率产生影响,且处理的幼虫期越早其效果越佳(图2~8)。此外,0.01% dsNPF对亚洲玉米螟的生长发育就具有重要的影响,反映出NPF的重要性。已有文章报道,不同的条件会决定RNAi的效率,例如更高剂量的dsRNA可以通过激活RNAi机器(RNAi machinery)增强RNAi反应(Garbuttetal., 2013);由于体型较小、发育更不完全,因此低龄幼虫的RNAi效果会更佳(Araujoetal., 2006)。
CRISPR/Cas9最早于2012年被报道(Jineketal., 2012)。CRISPR表示有规律的成簇间隔短回文重复,Cas表示CRISPR相关核酸酶。该系统是细菌和真菌对病毒和质粒的适应性免疫过程中存在的一种RNA可编程的基因组编辑方法。该系统利用CRISPR RNAs (crRNAs)引导入侵核酸沉默。本研究的结果表明,从1龄开始饲喂dsNFP的幼虫,其5龄幼虫的平均死亡率高达92.5%(图5)。因此,通过传统方式构建亚洲玉米螟NPF的缺失突变体是不可行的,但是,近年来有文献陆续报道了条件性CRISPR-Cas9技术,例如通过四环素(tetracycline)或四环素衍生物比如多西环素(doxycycline)调控的Tet-on和Tet-off系统与CRISPR-Cas9系统的结合(Zhangetal., 2019);在植物中,还有通过热激(Nandyetal., 2019)和光照(Polstein and Gersbach, 2015)诱导的CRISPR-Cas9技术等。以上技术均为我们后续深入研究NPF的功能及调控机制提供了有效的手段。
- 昆虫学报的其它文章
- 天宫二号航天蚕后代小茧突变体sc的发现与基因定位
- Analysis of the transcriptomes of Galeruca daurica(Coleoptera: Chrysomelidae) adults at different summer diapause stages
- Influence of foliar fertilizers on the development and reproduction of the citrus red mite, Panonychus citri (Acari: Tetranychidae), and the growth of citrus seedlings
- 黑水虻抗菌肽HI-3对人结肠癌HCT-8细胞谷氨酰胺和谷氨酸代谢通路的影响
- 荻草谷网蚜唾液蛋白基因Sm13498的克隆及功能分析
- 草地贪夜蛾成虫复眼明暗适应及黄光照射下明适应状态转化率

