黑水虻抗菌肽HI-3对人结肠癌HCT-8细胞谷氨酰胺和谷氨酸代谢通路的影响
高嘉敏, 许晓燕, 胡紫媛, 陈映丹, 孙虹霞, 杨愈丰, 夏 嫱
(遵义医科大学珠海校区, 广东珠海 519041)
黑水虻Hermetiaillucens隶属于双翅目(Diptera)水虻科(Stratiomyidae),是世界广泛关注的重要资源昆虫,幼虫生存能力强,主要用于禽畜粪便、废弃农作物及餐厨垃圾等有机废物的无害化处理(邓文辉等, 2019; Itesetal., 2020)。由于黑水虻幼虫的特殊生存环境,近年来其抗菌肽的研究倍受关注,并取得了一定的研究成果,具有良好的应用前景。研究表明,从黑水虻幼虫血淋巴中提取的抗菌肽HP/F9能有效抑制小鼠肺部肺炎克雷伯菌Klebsiellapneumonia的繁殖,减轻小鼠肺部炎症(Leeetal., 2020);通过毕赤酵母Pichiapastoris表达的黑水虻抗菌肽DLP2和DLP4可以拮抗多重耐药性金黄色葡萄球菌Staphylococcusaureus感染(Lietal., 2017)。此外,国外学者对黑水虻基因进行分析,得到了7个全新的抗菌肽基因片段,其中在大肠杆菌Escherichiacoli中表达的stomoxynzh1蛋白对革兰阳性菌、革兰阴性菌以及真菌均具有良好的抑制作用(Elhagetal., 2017)。目前,国内外关于黑水虻抗菌肽抑菌方面研究较多,但是关于其抑癌作用及其机理报道还较少,我们仅检索到Hu X等(2018)分离得到的黑水虻抗菌肽cecropin-h1能够通过诱导肺腺癌A549细胞凋亡来抑制其增殖,但是关于其抑癌机理并未深入研究。
本课题组从黑水虻幼虫血淋巴中提取的抗菌肽HI-3,不仅具有良好的抑菌活性(田忠, 2017),还可有效诱导人结肠癌细胞株HCT-8细胞凋亡,且其诱导凋亡与ROS相关(冯群, 2019)。昆虫抗菌肽抑癌机理是多方协同作用,在各个领域均有研究,如破坏其膜结构(Kunda, 2020)、诱导其凋亡(Chengetal., 2017)、调控其自噬(Adachietal., 2015)和影响其免疫效应(Hilchieetal., 2019)等,但应用代谢组学技术进行昆虫抗菌肽抑癌机理的研究尚未见报道。
本研究基于气相色谱-质谱联用(gas chromatography-mass spectrometry, GC-MS)技术并结合RT-qPCR, Western blot, ELISA和生化反应等生物学手段研究抗菌肽HI-3对人结肠癌HCT-8细胞谷氨酰胺和谷氨酸代谢通路的影响,以丰富对黑水虻抗菌肽HI-3抑制HCT-8细胞增殖机理的认识,为进一步挖掘抗菌肽HI-3在结肠癌治疗中的作用提供科学依据和理论支持,也有助于揭示抗菌肽HI-3在结肠癌治疗中的作用靶点及相关代谢通路。
1 材料与方法
1.1 供试材料
黑水虻抗菌肽HI-3由本课题组分离纯化获得,其纯度为96.1%,分子量为5.98 kD。人结肠癌HCT-8细胞购自中国科学院上海ATCC细胞库,人正常结直肠粘膜FHC细胞购自北京北纳创联生物技术研究院。
1.2 HI-3对HCT-8细胞增殖的抑制检测
HCT-8细胞和FHC细胞均在含10%胎牛血清(杭州四季青生物工程材料有限公司,杭州)和1%双抗(氨苄青霉素和链霉素)的RPMI-1640培养基(GIBCO,美国)于37℃,5% CO2培养箱培养。用胰蛋白酶将培养状态良好的HCT-8细胞和FHC细胞消化为单细胞悬液,分别加入96孔板中,培养24 h后吸出原培养基,分别向各培养孔中加入100 μL含80, 160和320 μg/mL的HI-3的培养基,每组4个复孔,同时设置不加HI-3(0 μg/mL)的阴性对照组以及空白对照组(培养基中无细胞)继续培养24 h。弃去原培养基,将新鲜培养基与CCK-8试剂(DOJINDO,日本)以10∶1比例(体积比)混合,每孔各加110 μL此混合液,37℃孵育后,在波长450 nm处检测吸光度值(A450)。 抑制率(%)=(A阴性对照组-A实验组)/(A阴性对照组-A空白对照组)×100%,式中A为波长450 nm处吸光度值。
1.3 谷氨酰胺和谷氨酸代谢通路靶标酶筛选
将浓度为3×105个/mL的HCT-8细胞悬液加入直径为100 mm培养皿中(6 mL/皿),培养24 h后弃去原培养基,再加入6 mL终浓度为80, 160和320 μg/mL的HI-3培养基,同时设置不加HI-3(0 μg/mL)的阴性对照组,每组6个重复,继续培养24 h。收集样本离心,液氮淬灭1 min。真空冷冻干燥后称取各处理浓度下样本各2 mg,分别加入1 000 μL提取剂(乙腈∶异丙醇∶水=3∶3∶2, 体积比)进行提取,利用肉豆蔻酸-d27溶液超声萃取,取上清氮吹干燥。加入20 μL 40 mg/mL甲氧氨盐酸盐,30℃衍生处理90 min,加入90 μL含1%三甲基氯硅烷的N-甲基-N-(三甲基硅烷基)三氟乙酰胺,37℃衍生30 min,离心取60 μL委托武汉安隆科讯技术有限公司完成GC-MS检测。利用Golm代谢组学数据库对结果图谱进行对比分析,鉴定出具体的代谢物质;采用正交偏最小二乘法分析(orthogonal single collection partial least squares discriminant analysis, OPLS-DA)对各实验组与阴性对照组分别进行统计分析,建立统计模型,并利用R2Y值和Q2值对各组模型的准确性和可靠性进行评估;模型合格后,利用OPLS-DA的S-plot图找出对分组贡献明显的代谢物并结合t检验,将同时满足P<0.05的代谢物作为差异代谢物;将各实验组数据与阴性对照组数据分别代入模式生物的通路中,在R软件下进行通路分析,找出氨基酸含量差异最显著的代谢通路,并依据KEGG数据库代谢通路总图进行分析,找出代谢通路靶标酶。
1.4 谷氨酰胺酶活力检测
将浓度为3×105个/mL的HCT-8细胞悬液加入直径为60 mm培养皿中(3 mL/皿),培养24 h后弃去原培养基,加入3 mL终浓度为320 μg/mL HI-3的培养基,同时设置不加HI-3(0 μg/mL)的阴性对照组,每组3个重复,继续培养24 h后按照GLS活性试剂盒(南京建成生物科技有限公司,南京)检测并计算其活力。GLS活力=0.083×(ΔA+0.005)(每1万个细胞每分钟催化谷氨酰胺生成1 μmol氨定义为1个活力单位,其中:ΔA=A测定管-A空白对照管),式中A为吸光度值,空白对照管中除了试剂外加入蒸馏水,测定管加入实验组/阴性对照组细胞的提取液。
1.5 谷氨酰胺酶mRNA表达检测
将浓度为3×105个/mL的HCT-8细胞悬液加入6孔板(2 mL/孔),培养24 h后加入2 mL终浓度为320 μg/mL HI-3的培养基,同时设置不加HI-3(0 μg/mL)的阴性对照组,继续培养24 h。利用Trizol RNA抽提试剂盒提取细胞总RNA,用AMV第1链cDNA合成试剂盒(生工生物工程股份有限公司,上海)合成cDNA第1链。以此cDNA为模板在实时荧光定量PCR仪(Bio-Rad,美国)上进行RT-qPCR。谷氨酰胺酶基因扩增引物序列: F: 5′-CACTCAAATCTACAGGATTGCG-3′; R: 5′-CCAGAC TGCTTTTTAGCACTTT-3′。 反应体系(10 μL): cDNA 1 μL, 2×ChamQ Universal SYBR qPCR Master Mix 5 μL, 上下游引物(10 μmoL/L)各0.2 μL, ddH2O 3.6 μL。反应条件: 95℃预变性30 s; 95℃变性10 s, 60℃退火30 s, 循环40次。每组3个孔重复,用2-△△Ct法计算相对表达量。GAPDH为内参基因,引物序列: F: 5′-CATCTTCTTTGCGTCGCCA-3′; R: 5′-TTAAAAGCAGCCCTGGTGACC-3′。引物由生工生物工程(上海)股份有限公司设计合成。
1.6 谷氨酰胺酶蛋白表达检测
细胞培养和处理同1.5节,裂解细胞获得细胞蛋白后进行蛋白浓度测定,SDS-PAGE凝胶电泳,每孔蛋白上样量为5 μg,电泳完成后转膜。用5% BSA封闭膜1 h,4℃孵育谷氨酰胺酶蛋白(GLS-1)抗体(Cell Signaling, 美国)和GAPDH抗体(Proteintech, 美国)过夜。TBST洗膜后孵育二抗1 h, TBST洗膜,使用双色近红外多功能成像仪(Analytik Jena,德国)曝光。使用Image J 1.8.0软件进行灰度值分析。以目标蛋白GLS-1与内参蛋白GAPDH的灰度值比作为目标蛋白GLS-1的相对表达水平。
1.7 谷氨酰胺和谷氨酸代谢通路重要代谢物含量检测
细胞培养和处理同1.4节,按照谷氨酸(glutamic acid, Glu)测试盒、微量还原型谷胱甘肽(glutataione, GSH)测定试剂盒、ATP含量测试盒(南京建成生物科技有限公司,南京)、人谷氨酰胺(glutamine, Gln)ELISA试剂盒和人α-酮戊二酸(α-ketoglutaric acid, α-KG)ELISA试剂盒(蓝基生物科技有限公司,上海)说明书检测320 μg/mL HI-3处理浓度下HCT-8细胞内Glu, GSH, ATP, Gln和α-KG含量,同时设置不加HI-3(0 μg/mL)的阴性对照组。
1.8 数据分析
GC-MS实验数据使用R软件,其他所有数据均采用SPSS 20.0软件统计分析。以平均值±标准差表示计量数据,两两对比采用t检验,组间比较采用单因素方差分析,当P<0.05时具有统计学差异。
2 结果
2.1 HI-3对HCT-8细胞增殖的抑制
80, 160和320 μg/mL黑水虻抗菌肽HI-3对HCT-8细胞的抑制率分别为33.85%±3.50%, 46.26%±0.90%和55.53%±1.70%;对人正常结直肠粘膜FHC细胞的抑制率均较小,分别为3.76%±0.80%, 4.93%±1.20%和6.92%±2.20%,与相同处理浓度条件下HI-3对HCT-8细胞抑制率相比极显著降低(P<0.01)(图1),表明HI-3对正常细胞影响较小,但对HCT-8细胞具有很好的抑制作用。
2.2 谷氨酰胺和谷氨酸代谢通路靶标酶
对阴性对照组和3个不同浓度HI-3(80, 160和320 μg/mL)给药处理24 h后的衍生化样品经GC-MS分析后所得总离子流色谱图中色谱峰分离效果较好,共有429个;经Golm代谢组学数据库对比分析,鉴定得到代谢物共36种,主要为缬氨酸、谷氨酸、异亮氨酸等氨基酸类物质以及胆固醇、油酸、花生四烯酸等脂类物质。另外,还包括羧酸类(乳酸)、醇类(肌醇)和糖类(半乳糖)等物质(表1)。

表1 HCT-8细胞样本代谢物质定性检测结果Table 1 Qualitative results of metabolites of HCT-8 cell samples
利用OPLS-DA对各组样本进行统计分析,发现组内样本分布均匀,重现性较高,表明采集的样本稳定、可靠;80, 160和320 μg/mL HI-3处理组与阴性对照组分离完全,表明各处理组与阴性对照组相比差异显著;且各组中的R2Y和Q2,均大于0.5,说明本研究所建立的模型准确、可靠。进一步依据OPLS-DA分析中3个浓度处理组与阴性对照组间的S-plot图,并结合t检验,得到3个处理浓度下氨基酸类的共同差异代谢物有3种,分别为缬氨酸、谷氨酸和脯氨酸。其中,缬氨酸和脯氨酸含量随处理浓度增加而增加,谷氨酸含量则随处理浓度增加而降低(表2)。
分别将80, 160和320 μg/mL HI-3处理组细胞代谢产物与阴性对照组细胞代谢产物在R软件下进行代谢通路分析,发现所涉及氨基酸代谢通路有4条,分别为谷氨酰胺和谷氨酸代谢通路,精氨酸和脯氨酸代谢通路,丙氨酸、天冬氨酸盐和谷氨酸代谢通路,甘氨酸、丝氨酸和苏氨酸代谢通路。其中在320 μg/mL处理浓度下谷氨酰胺和谷氨酸代谢通路中的氨基酸代谢物含量与阴性对照组相比较差异最为显著,因此选择谷氨酰胺和谷氨酸代谢通路作为后续分析的靶向代谢通路,并选择320 μg/mL处理浓度为后续实验浓度。
根据KEGG数据库中谷氨酰胺和谷氨酸代谢通路总图分析表明,GLS能直接将Gln水解为Glu,是该通路的限速酶,同时结合表2中HI-3作用HCT-8细胞后Glu含量差异明显,且随处理浓度升高而降低(处理浓度最高时P值达到最小,为0.00028),故推测GLS为谷氨酰胺和谷氨酸代谢通路的靶标酶。
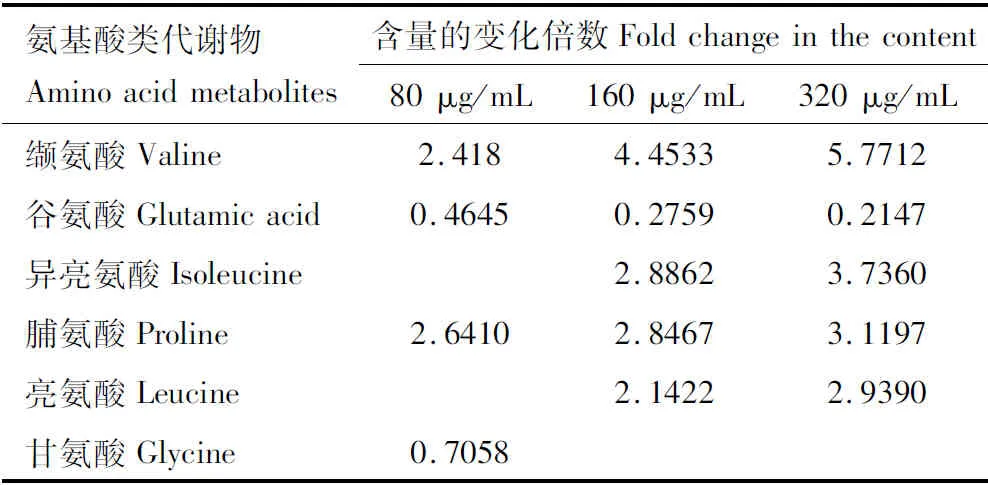
表2 不同浓度黑水虻抗菌肽HI-3处理后HCT-8细胞的氨基酸类差异代谢物Table 2 Differential amino acid metabolites of HCT-8cells treated by different concentrations of antimicrobialpeptide HI-3 from Hermetia illucens
2.3 谷氨酰胺酶活性和表达水平
与阴性对照组(0.069%±0.60%)相比,320 μg/mL HI-3处理HCT-8细胞的谷氨酰胺酶活性(U/104cells) 为0.029%±0.50%,极显著降低(P<0.01)。RT-qPCR检测结果表明,320 μg/mL HI-3处理后的HCT-8细胞其GLSmRNA表达量与阴性对照组相比极显著降低(P<0.01),是阴性对照组的0.649±0.01倍(图2)。
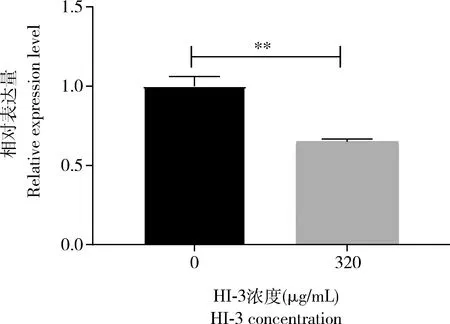
图2 黑水虻抗菌肽HI-3(320 μg/mL)对HCT-8细胞GLS基因表达量的影响Fig. 2 Effects of 320 μg/mL antimicrobial peptide HI-3from Hermetia illucens on the expression levelof GLS in HCT-8 cells图中数据为平均值±标准差;柱上双星号表示320 μg/mL HI-3处理组与阴性对照组(0 μg/mL HI-3)相比GLS mRNA表达量差异极显著(P<0.01, t检验)。Data in the figure are mean±SD, and the double asterisk above bars indicates extremely significant difference in GLS mRNA expression level between the 320 μg/mL HI-3 treatment group and the negative control group (0 μg/mL HI-3)(P<0.01, t-test).
Western blot检测结果表明(图3: A),320 μg/mL HI-3处理组与阴性对照组相比其GLS蛋白表达水平明显下降。对此结果进行灰度值分析表明,两组间蛋白表达水平具有极显著性差异(P<0.01)(图3: B)。

图3 黑水虻抗菌肽HI-3(320 μg/mL)处理的HCT-8细胞GLS蛋白表达Fig. 3 GLS protein expression in HCT-8 cells treatedby 320 μg/mL antimicrobial peptide HI-3from Hermetia illucensA: Western blot条带Western blot bands; B: 条带相对灰度值Relative gray level of bands. 图中数据为平均值±标准差;柱上双星号表示320 μg/mL HI-3处理组与阴性对照组(0 μg/mL HI-3)相比GLS蛋白表达量差异极显著(P<0.01, t检验)。Data in the figure are mean±SD, and the double asterisk above bars indicates extremely significant difference in GLS protein expression level between the 320 μg/mL HI-3 treatment group and the negative control group (0 μg/mL HI-3)(P<0.01, t-test).
2.4 谷氨酰胺和谷氨酸代谢通路中重要代谢物含量
对谷氨酰胺和谷氨酸代谢通路中处于重要地位的Gln, Glu和α-KG及其关键代谢产物GSH和ATP含量进行检测,结果如图4所示,320 μg/mL HI-3作用于HCT-8细胞后其细胞内Gln含量显著低于阴性对照组(P<0.05)(图4: A),其分解产物Glu含量和阴性对照组相比极显著减少(P<0.01)(图4: B),与2.2节GC-MS检测结果相一致。另外,Glu参与合成的抗氧化物GSH含量与阴性对照组相比亦极显著降低(P<0.01)(图4: C)。细胞能量代谢的重要中间产物α-KG含量及细胞内重要的能源物质ATP含量亦显著减少(α-KG,P<0.05; ATP,P<0.01)(图4: D, E)。这些结果均表明,HI-3作用后HCT-8细胞的谷氨酰胺和谷氨酸代谢通路发生了显著变化。
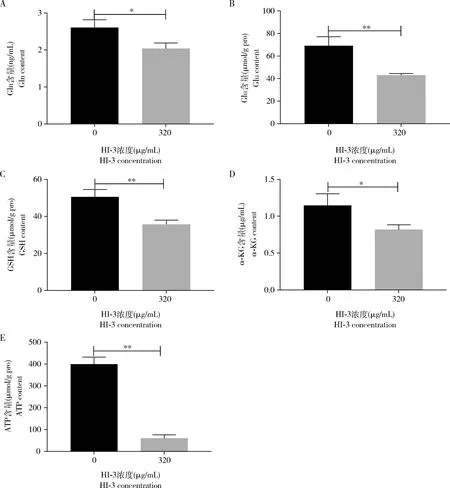
图4 黑水虻抗菌肽HI-3(320 μg/mL)对HCT-8细胞谷氨酰胺和谷氨酸代谢通路中重要代谢物含量的影响Fig. 4 Effects of 320 μg/mL antimicrobial peptide HI-3 from Hermetia illucens on the contentsof important metabolites in the glutamine and glutamic acid metabolic pathway in HCT-8 cellsA: Gln; B: Glu; C: GSH; D: α-KG; E: ATP. 图中数据为平均值±标准差;柱上星号表示320 μg/mL HI-3处理组与阴性对照组(0 μg/mL HI-3)相比相应代谢物含量差异显著(*P<0.05, **P<0.01, t检验)。Data in the figure are mean±SD, and the asterisks above bars indicate significant difference in the content of the corresponding metabolite between the 320 μg/mL HI-3 treatment group and the negative control group (0 μg/mL HI-3)(*P<0.05, **P<0.01, t-test).
3 讨论
细胞代谢组学是近年新兴起的概念(Zhangetal., 2013),是利用先进的技术对胞内代谢物质或者胞外代谢物质进行分析(Leónetal., 2013),鉴定出差异代谢物,在肿瘤研究方面具有无法比拟的优势性(Xieetal., 2019; Houetal., 2020)。本研究应用GC-MS技术对80, 160和320 μg/mL 3种处理浓度下HI-3作用后的HCT-8细胞进行细胞代谢组学分析,发现HI-3主要对HCT-8细胞氨基酸代谢特别是谷氨酰胺和谷氨酸代谢通路产生影响,并在320 μg/mL处理浓度时影响最大。
有研究表明,PIK3CA突变的结直肠癌(colorectal cancer, CRC)细胞会利用更多的谷氨酰胺并将其转化为α-KG来补充TCA循环,进而产生更多ATP,为细胞生长提供能量(Haoetal., 2016)。GLS作为谷氨酰胺和谷氨酸代谢通路中的重要代谢靶点,是将谷氨酰胺进行分解的限速酶,其高表达有助于CRC生长、扩散。GLS在CRC组织中的高表达与患者淋巴结转移及疾病恶化显著相关,其功能的丧失能明显抑制谷氨酰胺分解和有氧糖酵解,并使CRC细胞死亡(Songetal., 2017; Xiangetal., 2019)。另外,同时降低GLS和M2型丙酮酸激酶的表达能显著逆转CRC细胞对奥沙利铂的耐药,重新提高其对化疗的敏感性(Luetal., 2017)。本研究结果表明,320 μg/mL HI-3可显著抑制HCT-8细胞的增殖(图1),且在该浓度下GLS活性、mRNA和蛋白表达水平与阴性对照组相比均显著下降(图2和3),说明HI-3对HCT-8细胞的抑制作用与GLS表达降低有关,我们推测GLS为HI-3抑制HCT-8细胞增殖的作用靶点。
在320 μg/mL HI-3作用下,HCT-8细胞谷氨酰胺和谷氨酸代谢通路的关键代谢物Gln, Glu, α-KG以及代谢产物ATP和GSH含量与阴性对照组相比均显著减少(图4),揭示此代谢通路受到明显阻碍,与Hu M等(2018)研究木香烯内酯通过降低HCT-116细胞内GLS蛋白表达量及Glu, α-KG和ATP含量来抑制HCT-116细胞生长具有较好的一致性。谷氨酰胺和谷氨酸代谢通路受到阻碍可抑制CRC细胞的增殖,可能是由于细胞内ATP和GSH含量降低所致,因为ATP与细胞能量供应息息相关,而GSH则是维持细胞氧化还原稳态的重要物质。另外,沉默CRC细胞中葡萄糖-6-磷酸脱氢酶基因可减少NADPH的产生,降低GSH水平,从而通过ROS介导的损伤加强药物诱导CRC细胞凋亡的效果(Juetal., 2017),这也与本研究中GSH含量的降低以及本课题组前期研究发现HI-3处理后HCT-8细胞内的ROS水平增加与凋亡相关(冯群, 2019)相吻合。
本研究虽然从代谢方面阐述了黑水虻抗菌肽HI-3对HCT-8细胞的增殖影响,但是,由于本研究仅利用GC-MS技术和简单的生物学研究手段对谷氨酰胺和谷氨酸代谢通路进行了初步研究,研究内容尚不深入,对于抗菌肽HI-3的抑癌机理阐述尚不充分。后续将对GLS进行沉默或高表达,从而对其及谷氨酰胺和谷氨酸代谢通路中的重要代谢物含量变化进行更为深入的研究。
- 昆虫学报的其它文章
- 天宫二号航天蚕后代小茧突变体sc的发现与基因定位
- Analysis of the transcriptomes of Galeruca daurica(Coleoptera: Chrysomelidae) adults at different summer diapause stages
- Influence of foliar fertilizers on the development and reproduction of the citrus red mite, Panonychus citri (Acari: Tetranychidae), and the growth of citrus seedlings
- 敲减神经肽F基因(npf)对亚洲玉米螟取食、生长发育和繁殖的影响
- 荻草谷网蚜唾液蛋白基因Sm13498的克隆及功能分析
- 草地贪夜蛾成虫复眼明暗适应及黄光照射下明适应状态转化率

