禽致病性大肠杆菌生物被膜形成能力及相关特性分析
邓小玲,孙影,尤向峰,吴育发,王梦云,胡积东,王有为,阮祥春,4*
(1.安徽农业大学动物科技学院,安徽 合肥 230036;2.广德市农业农村局,安徽 广德 242200;3.青阳县畜牧兽医局,安徽 青阳 242800;4.兽医病理生物学与疫病防控安徽省重点实验室,安徽 合肥 230036)
大肠杆菌广泛存在于环境中,一旦附着在畜禽养殖的水线设备、料槽、地面等表面,形成生物被膜后难以被杀灭和清除,严重威胁畜禽的健康。禽大肠杆菌病是由禽致病性大肠杆菌(avian pathogenicEscherichiacoli,APEC)引起的最常见细菌性疾病之一。APEC公认的毒力特征包括黏附素、菌毛、毒素、铁清除系统、侵袭素和质粒等[1]。APEC能够引起禽局部或全身性感染,表现为各种体征,包括急性致命性败血症、亚急性心包炎、气囊炎、周围肝炎、蜂窝织炎和输卵管炎等,可导致巨大经济损失,且规模养殖鸡场的死亡率较散养户可能更高[2-3]。
生物被膜是一种或多种细菌为适应环境,抵抗外界不良影响而形成的一种微菌落聚合物[4]。细菌可以在生物或非生物表面以单个细胞或者细胞簇附着,形成单层或多层生物被膜[5]。大多数细菌能产生生物被膜,如:大肠杆菌(Escherichiacoli)、沙门氏菌(Salmonella)、铜绿假单胞菌(Pseudomonasaeruginosa)、金黄色葡萄球菌(Staphylococcusaureus)、炭疽杆菌(Bacillusanthraci)等[6]。生物被膜是由不同成分组成的胞外聚合物(extracellular polymeric substance,EPS)。EPS是生物被膜形成的三维支架,发挥黏附和将游离状态的物质凝聚于生物被膜内的作用。EPS的主要成分包括多糖、蛋白质、核酸、脂质、菌毛、鞭毛、腐殖质等。这些成分在生物被膜结构中起到十分重要的作用,包括附着、聚集、信息交流、抵抗宿主特异性与非特异性免疫、耐药性等[7]。
本试验基于禽致病性大肠杆菌生物被膜形成能力及相关特性分析,包括大肠杆菌形成生物被膜的成膜能力、膜成熟时间、膜成分,与生物被膜形成相关基因以及对10种抗菌药物耐药性分析,为临床禽致病性大肠杆菌病防治及抗菌药的合理使用提供借鉴。
1 材料与方法
1.1 材料
1.1.1 试验菌株本研究中涉及的70株禽致病性大肠杆菌,均为2019—2020年从安徽省内送检的濒死或刚死亡鸡肝脏中无菌分离获得。其中从送检至安徽农业大学畜禽疾病诊断中心的病例中分离到59株,由潘玲、王勇和李郁老师馈赠。另外,11株从安徽广德市和青阳县辖区内养殖场送至安徽农业大学动物科技学院兽医药理毒理实验室病鸡的肝脏中无菌分离获得。经鉴定为大肠杆菌,保存用于本试验。
1.1.2 抗菌药物氨苄西林(AMP)、头孢曲松钠(CRO)、阿奇霉素(AZM)均购于北京索莱宝科技有限公司;阿莫西林(AMX)购自联邦制药国际控股有限公司;多西环素(DOX)购自扬州联博药业有限公司;氟苯尼考(FFC)购自江苏恒盛药业有限公司;恩诺沙星(ENR)购自浙江国邦药业有限公司;新霉素(NEO)购自上海麦克林生化科技有限公司;替加环素(TGC)与多黏菌素B(POL)均购自上海源叶生物科技有限公司。
1.1.3 培养基及试剂LB营养肉汤、LB营养琼脂、麦康凯琼脂、MH(B)培养基均由北京奥博星生物技术有限责任公司生产;冰醋酸、结晶紫、甲醇均为国产化学纯级试剂。
1.2 方法
1.2.1 生物被膜阳性菌株的筛选参考范玉堂[8]报道的刚果红平板法,挑取培养在麦康凯培养基上的单菌落,接种于刚果红平板上,37 ℃静置培养24 h后,于室温培养3~7 d,每天观察并记录结果。判定菌落及周围琼脂变为黑色为能形成生物被膜菌株,而菌落及周围颜色没有变化的为不能形成生物被膜的菌株。
1.2.2 生物被膜形成能力测定取无菌96孔板,将筛选出能形成生物被膜的禽致病性大肠杆菌制备成菌液(A600=0.01),每孔加入200 μL。阴性对照孔加入LB营养肉汤,每组重复6孔。37 ℃静置培养24 h后,移除孔内液体,用0.01 mol·L-1PBS缓冲液(pH7.4)洗3次后,向每孔中加入200 μL甲醇,固定15 min,再用PBS缓冲液洗3次。待自然干燥后,每孔加入200 μL结晶紫,染色5 min,用 PBS缓冲液洗涤。自然干燥后,每孔加入200 μL 33%冰醋酸溶液,静置30 min后,用酶标仪测定吸光值(A570)。结果以A570c值(A570c为阴性对照孔的平均值加上其3倍标准差)为参考,判定不成膜株(A570≤A570c)、弱成膜能力株(A570c
1.2.3 生物被膜成熟时间的测定取无菌96孔板,每孔加入制备好的菌液(A600=0.01)200 μL,空白对照为LB营养肉汤,每组重复6孔。37 ℃静置培养,每天更换LB营养肉汤。分别在接种后0.5(12 h)、1、2、3、4、5、6和7 d用灭菌生理盐水洗去浮游菌,按1.2.2节方法进行结晶紫染色并测量A570值。根据A570值来绘制生物被膜生长曲线[10]。
1.2.4 卷曲菌毛和胞外纤维素的检测将生物被膜阳性菌株在麦康凯琼脂平板上划线培养,挑取单菌落接种于装有5 mL LB肉汤的试管中,对照组为等体积的LB肉汤。28 ℃静置培养72 h后,观察气液交界面以及玻璃试管内状态。若气液交界面形成致密的生物被膜,表明该菌株有卷曲菌毛并能够产生胞外纤维素;形成脆弱的生物被膜表明该菌株仅有卷曲菌毛;试管底部形成沉淀表明该菌株只能产生胞外纤维素;菌液均匀浑浊表明该菌株不具有卷曲菌毛并不能产生胞外纤维素[8]。
1.2.5 生物被膜胞外多糖的测定采用浓硫酸-苯酚法测定生物被膜胞外多糖的含量[11-13]。将提前配制好的1 mg·mL-1葡萄糖标准储备液,按比例稀释成不同浓度的葡萄糖标准工作液。取20 μL葡萄糖标准工作液至96孔板,每个浓度重复6孔。每孔加入30 μL 6%的苯酚水溶液后,立即加入150 μL浓硫酸,室温静置1 h后测定吸光值(A490),绘制葡萄糖浓度-吸光(A490)值的标准曲线。取200 μL生物被膜阳性菌株的悬液(A600=0.01)加入到96孔板中,每株菌重复6孔。37 ℃静置培养36 h后,用灭菌PBS缓冲液缓慢洗去浮游菌,采用浓硫酸-苯酚法测定吸光值(A570),根据制备的葡萄糖标准曲线,计算出菌株生物被膜中胞外多糖的含量。
1.2.6 生物被膜相关基因的检测使用Primer Premier 5.0软件设计引物,引物序列见表1。PCR体系(25 μL)包括:12.5 μL 2×SparkTaqPCR Master Mix,9.5 μL dd H2O,上、下游引物各1 μL,1 μL菌悬液模板。PCR条件:95 ℃预变性5 min;95 ℃变性30 s,退火温度(Tm)退火30 s,72 ℃延伸1 min,30个循环;最后72 ℃延伸5 min(退火温度见表1)。
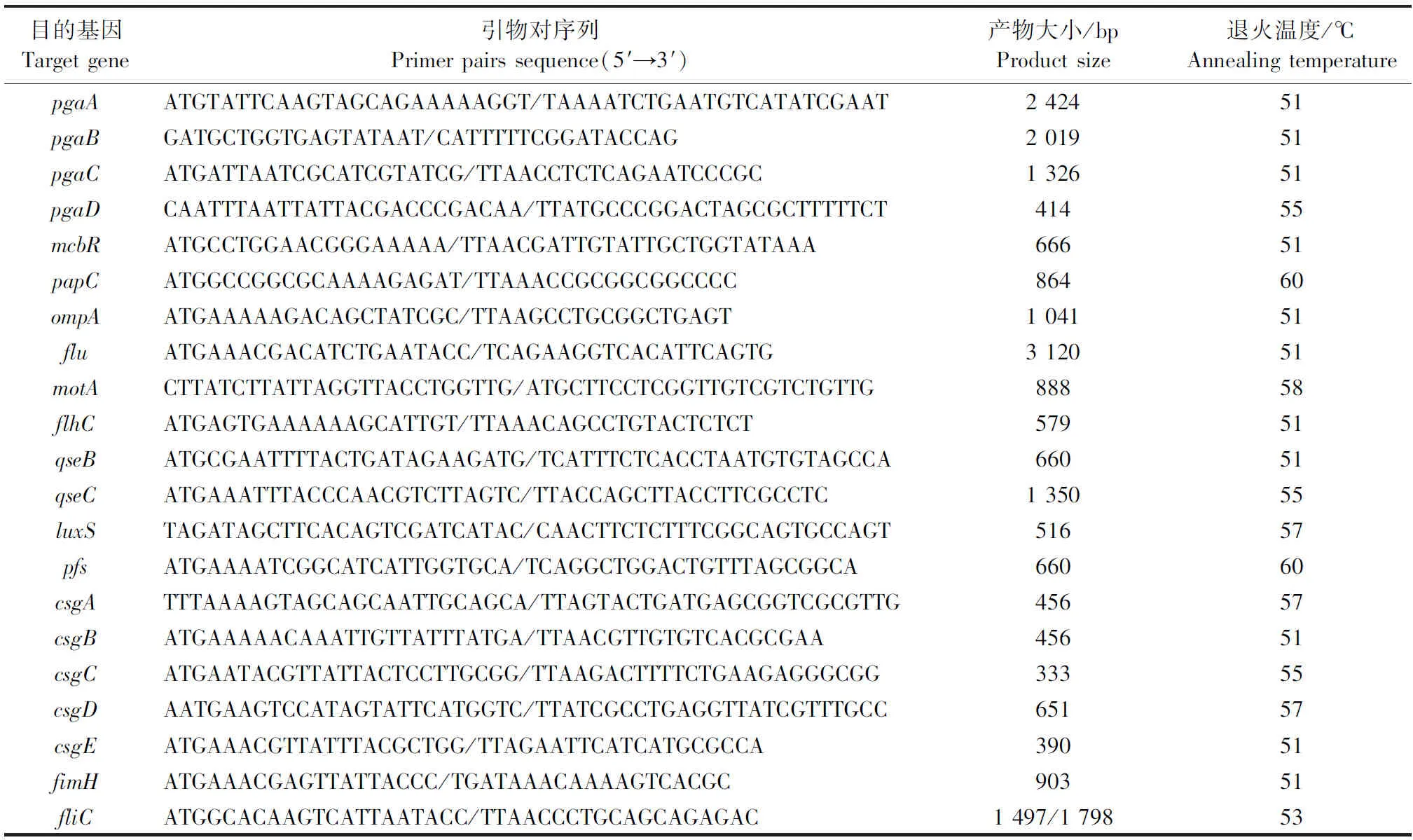
表1 生物被膜相关基因的引物Table 1 Primerpairs of biofilm-related genes
1.2.7 致病性大肠杆菌的耐药性检测根据美国临床和实验室标准协会方法委员会(CLSI)标准[14],通过肉汤微量稀释法检测禽致病性大肠杆菌对10种抗菌药的最小抑菌浓度。取无菌U型96孔培养板,前10列孔作为试验组,第11列孔为阳性对照,第12列孔为阴性对照。将待测药物配制成256 μg·mL-1,加入第1个孔,用MH(B)培养基(pH值 7.2~7.4)进行连续倍比稀释。试验组及阳性对照每孔均加入100 μL禽致病性大肠杆菌菌液(A600=0.1),阴性对照加入等体积的MH(B)培养基,每组3个重复。37 ℃静置培养18~24 h后,观察并记录结果。根据CLSI标准判定每株菌对10种抗菌药的耐药性情况。
2 结果与分析
2.1 生物被膜阳性菌株检出情况
通过刚果红平板筛选,不能形成生物被膜菌株的菌落及周围未有黑色的颜色变化(图1-A),而生物被膜阳性菌株在刚果红平板上表现为菌落及周围琼脂变为黑色(图1-B)。根据试验的结果,鉴别出有31株临床分离禽致病性大肠杆菌能形成生物被膜[15]。

图1 生物被膜阳性菌株筛选Fig.1 Screening of biofilm-positive strainsA. 生物被膜阴性菌株 The biofilm-negative strains;B. 生物被膜阳性菌株The biofilm-positive strains.

图2 生物被膜阳性菌株成膜能力测定Fig.2 Determination of the biofilm forming ability of positive strains*P<0.05; **P<0.01. The same as follows.
2.2 生物被膜形成能力测定
对禽致病性大肠杆菌形成的生物被膜用结晶紫染色,测定其A570值。依据陈传荣等[9]报道的判定方法,鉴定出10株强成膜菌株(32.26%)、7株中等成膜菌株(22.58%)、14株弱成膜菌株(45.16%)。并且强成膜菌株与中等、弱成膜菌株的A570值差异极显著(P<0.01),而中等与弱成膜菌株的A570值差异不显著(P>0.05)(图2)。
2.3 生物被膜成熟时间的测定
生物被膜阳性菌株在3~7 d形成成熟的生物被膜。其中膜成熟时间在第3天的有5株(16.13%),第4天与第5天的各1株(3.23%),第6天的有3株(9.68%),第7天的有21株(67.74%)。强、中、弱成膜菌株平均膜成熟时间分别为(5.5±1.69)d、(5.43±1.84)d和(6.86±0.52)d。强与中等成膜菌株平均膜成熟时间差异不显著(P>0.05),但显著短于弱成膜菌株(P<0.05)。总体趋势为成膜能力较强的菌株膜成熟时间短(图3)。根据膜成熟时的吸光值,判断菌株产生膜基质量。结果(图4)表明,强成膜菌株产生膜基质量平均为(2.55±1.60),与中等成膜菌株差异显著(P<0.05),与弱成膜菌株差异极显著(P<0.01)。中等与弱成膜菌株差异不显著(P>0.05)。
2.4 卷曲菌毛和胞外纤维素的检测
观察发现:有卷曲菌毛并产生胞外纤维素的有15株菌,占48.39%;仅有卷曲菌毛的有9株菌,占29.03%;只产生纤维素的有3株菌,占9.68%;两者均无的有4株菌,占12.90%(图5)。有卷曲菌毛和胞外纤维素的强成膜菌株所占比例最高(60.00%),而弱成膜菌株所占比例最低(35.71%)。中等成膜菌株形成的生物被膜中不产生胞外纤维素,产生胞外纤维素的强成膜菌株数多于弱成膜菌株数。中等、弱成膜菌株中存在菌毛和纤维素均不产生的菌株,且弱成膜菌株数多于中等成膜菌株数。在含有菌毛且产生胞外纤维素的菌株中,强成膜能力的菌株数最多,所占的比例也最高(图6)。

图3 生物被膜阳性菌株膜成熟时间Fig.3 The maturation time of biofilm positive strains

图4 不同成膜能力菌株膜成熟产生的基质量Fig.4 The amount of matrix produced by the biofilm maturation of the strains with different film-forming abilities

图5 卷曲菌毛和胞外纤维素的检测Fig.5 Detection of curli and extracellular cellulose A. 有卷曲菌毛并产生胞外纤维素;B. 仅产生卷曲菌毛;C. 仅有胞外纤维素;D. 无卷曲菌毛且不能产生胞外纤维素;E. 对照组。A. Carrying curli and producing extracellular cellulose;B. Carrying curli only;C. Producing extracellular cellulose only;D. Neither carrying curli nor producing extracellular cellulose;E. Control group.

图6 不同成膜能力菌株卷曲菌毛和胞外纤维素的检出率Fig.6 Detection rate of curli and extracellular cellulose of strains with different biofilm forming abilities Cur+/Cur-:有/无产生卷曲菌毛能力菌株;Cel+/Cel-:有/无产生胞外纤维素能力菌株。Cur+/Cur- indicates the strain with the ability to produce or no curli;Cel+/Cel- indicates the strain with the ability to produce or no extracellular cellulose.

图7 不同成膜能力菌株生物被膜胞外 多糖的含量Fig.7 Content of extracellular polysaccharide in biofilm of strains with different biofilm forming ability
2.5 生物被膜胞外多糖含量的测定
从图7可以看出:根据制定葡萄糖标准曲线的线性方程Y=0.002 4x(R2=0.999),测定强、中等和弱成膜菌株形成生物被膜中平均胞外多糖含量,分别为(70.56±25.90)μg·mL-1、(45.45±12.54)μg·mL-1和(46.09±9.19)μg·mL-1。强成膜菌株的胞外多糖含量与中等和弱成膜菌株相比,差异极显著(P<0.01),中等成膜菌株与弱成膜菌株的胞外多糖含量无显著差异(P>0.05)。
2.6 生物被膜相关基因的检测
在生物被膜阳性菌株中,生物被膜相关基因检出率由高到低依次为:群体感应、菌毛、鞭毛、蛋白、多糖相关基因。群体感应系统相关基因qseB、qseC、pfs、luxS的检出率均为100%,不同成膜能力菌株的检出率差异不显著;除csgB的平均检出率为96.77%外,其他与菌毛相关基因csgA、csgC、csgD、csgE、fimH的检出率均为100%,其中强和中等成膜菌株的检出率均高于弱成膜菌株,但差异不显著;与鞭毛相关基因motA、flhC、fliC的平均检出率为84.95%,强成膜菌株检出率高于弱成膜菌株和中等成膜菌株,差异不显著;与蛋白相关基因ompA、papC的检出率较高,而flu的检测率较低,强成膜菌株检出率高于弱成膜菌株和中等成膜菌株,差异不显著;与多糖相关的基因除pgaD、mcbR外,pgaA、pgaB、pgaC的检出率最低,弱成膜菌株的检出率高于中等成膜菌株和强成膜菌株,差异不显著(表2)。

表2 生物被膜形成相关基因的平均检出率Table 2 Average detection rate of genes related to biofilm formation %
2.7 生物被膜阳性菌株耐药性结果
31株生物被膜阳性菌株平均耐(4.68±1.63)种药,耐药3种以上的菌株占90.32%。对氨苄西林、阿莫西林、多西环素、氟苯尼考、头孢曲松、恩诺沙星、阿奇霉素、新霉素、多黏菌素B、替加环素的耐药率分别为83.87%、80.65%、67.74%、67.74%、67.74%、41.94%、29.03%、25.81%、6.45%、0.00%。其中,氨苄西林的耐药率最高,而对替加环素和多黏菌素B耐药率很低。不同成膜能力的菌株只有对氟苯尼考和头孢曲松的耐药率差异显著,其他8种抗菌药物的耐药率差异不显著;强、中等成膜菌株对10种抗菌药的平均耐药率比弱成膜菌株高,例如强成膜菌株对多黏菌素的耐药率达到了 20.00%(2/10),远高于中等成膜菌株(0/7)和弱成膜菌株(0/14)(表3)。
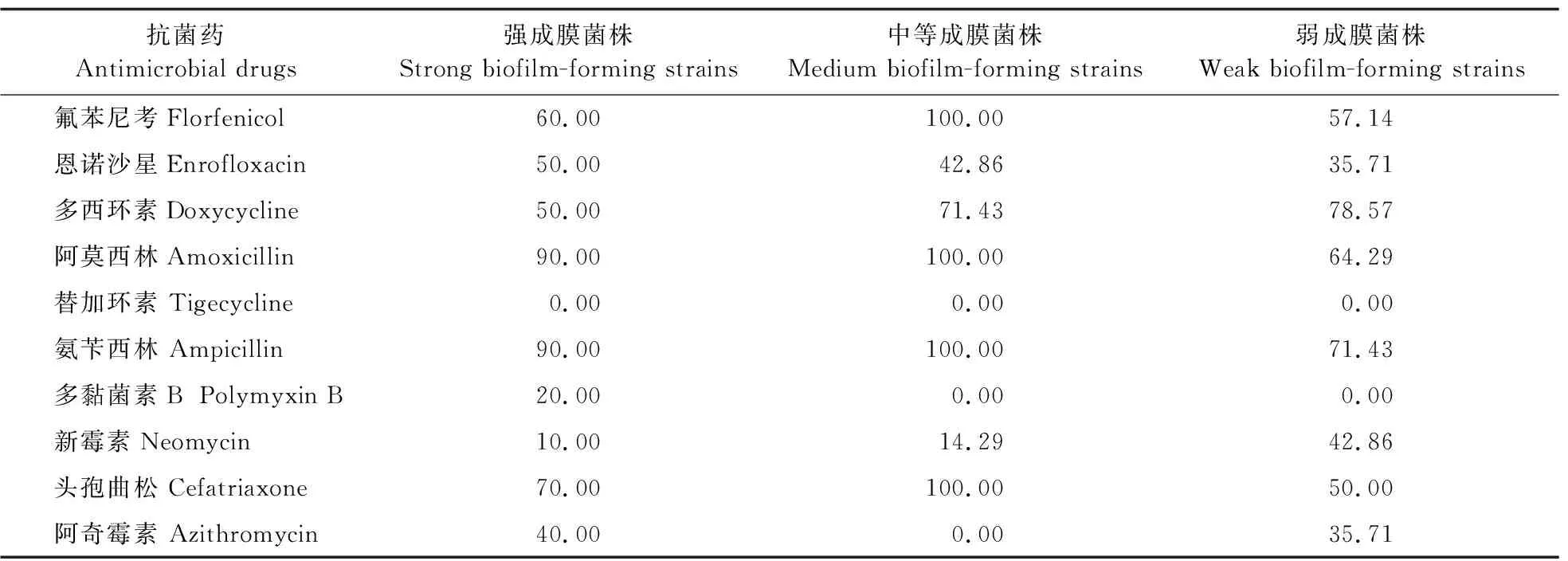
表3 不同成膜能力菌株对10种抗菌药的耐药率Table 3 Drug resistance rate of strains with different biofilm forming abilities to ten kinds antimicrobial drugs %
3 讨论
由于不同的细菌及同类菌株之间存在一定的差异,导致生物被膜形成的不同,如:能否形成生物被膜、成膜能力、膜成熟时间、膜的组成以及与膜形成相关基因的差异等。生物被膜的检测方法较多,有试管法、银染法、阿利新兰刚果红联合染色法、结晶紫半定量染色法、电镜法等[16-17]。一般为了提高试验结果的准确性,通常会进行多种方法鉴定。李晗等[18]采用细菌细胞活性测定试剂盒/激光共聚焦显微镜检测方法得到清晰的生物被膜图片。这种方法可以作为临床实践中细菌生物被膜鉴定,具有稳定、高质量等优点。但是也存在准备时间长、成本高、操作复杂等缺点。结晶紫半定量染色法具有简便快捷的特点,能较准确反映细菌生物被膜成膜情况,广泛应用于实验室细菌生物被膜的检测[17]。本试验采用结晶紫半定量染色法鉴定禽致病性大肠杆菌是否形成生物被膜及成膜能力。在70株禽致病性大肠杆菌中,生物被膜阳性菌株检出率为44.29%,与张伟等[19]的研究结果(36.9%)相似,但与陈传荣等[9]的研究结果(96.1%)差异较大。这可能与菌株的差异、参考的方法、生物被膜培养时间等原因有关。
生物被膜形成的过程是一个动态的过程,分为起始黏附期、集聚增殖期、成熟期以及脱落散播期4个阶段[20]。在强、中等成膜能力的菌株中,它们膜成熟的时间相对较短。弱成膜能力的菌株膜成熟时间主要在5~7 d(6.86±0.52 d),比强、中等成膜菌株膜成熟时间要长,且差异显著。这表明成膜能力强的菌株,其膜成熟时间相对较短。临床很多感染性疾病与细菌生物被膜有关,其中约80%的慢性感染性疾病与细菌生物被膜有关[21],且其成膜能力与其毒力呈正相关[10]。细菌对宿主细胞的黏附和侵袭在细菌定殖过程中至关重要,并且生物被膜的形成与黏附有关,其在入侵和定居期间可产生毒力[22]。APEC的致病性不仅由血清群决定,还受毒力基因和生物被膜形成能力等其他因素影响。大多数临床分离的APEC具有强或中等的生物被膜形成能力,由此推断产生生物被膜是引起其高致病性的一个原因,或是产生生物被膜后引起耐药性增强而导致感染难以治愈[23]。
细菌生物被膜形成与鞭毛、菌毛、群体感应系统等基因密切相关[24]。鞭毛是细菌的运动器官,与运动性、趋化性、定殖、黏附密切相关[25]。菌毛在生物被膜形成过程中,起到黏附素的作用,参与生物被膜不可逆黏附阶段[26]。群体感应是依赖于细胞密度实现细菌之间通讯的信号机制,此种通讯系统在生物被膜形成的调控中起着关键作用[27]。胞外多糖是细菌生物被膜最重要的成分[27],主要包括β-1,6-N-乙酰基-D-葡糖胺聚合物(PGA)、可乐酸和纤维素[28],是生物被膜成熟必不可少的成分之一。本试验中,成膜能力强的菌株形成生物被膜的基质量多,而生物被膜基质内多糖的含量高。可溶性蛋白是关键蛋白,可以调节细胞渗透、增强细胞的保水作用,对于细菌生物被膜具有保护作用[29]。生物被膜形成密切相关的基因表达检测发现,除了少数基因检出率较低外,绝大多数的基因检出率很高。因此,与鞭毛、菌毛、群体感应等生物被膜形成相关基因均可作为药物研究的潜在靶点,来筛选能够抑制生物被膜形成的药物。
生物被膜的形成降低了细菌对抗菌药的敏感性,比游离状态的耐受性甚至提高了1 000倍,给疾病防治带来困难[30-31]。生物被膜引起细菌耐药的机制包括:抗菌药物渗透障碍;基因结构的改变;阻挡机体免疫系统的吞噬、杀伤作用;生物被膜内层细菌营养代谢异常而引发生长抑制,出现对某些抗菌药的不敏感[4,32]。形成生物被膜致病菌造成临床很多感染性疾病治疗效果差、反复感染等现象[33-35]。耐药性检测表明,临床分离禽致病性大肠杆菌对10抗菌药产生了不同程度的耐药性。我们对不形成生物被膜的菌株也进行了耐药性检测,发现都是浮游状态下,对10种抗菌药平均耐药性程度基本一致。然而,在能形成生物被膜的菌株中,生物被膜阳性菌株的耐药程度与生物被膜的形成能力呈现一定的正相关。对送检养殖企业临床用药进行调查,发现在鸡发生疾病后,主要使用阿莫西林、多西环素、氟苯尼考等抗菌药进行治疗。经常或者不合理使用这些药物,容易产生耐药性,这与本研究中耐药性检测结果相一致。另外,耐药性检测发现,约1/3的菌株对阿奇霉素产生了耐药性,这与临床中不合理用药有密切关系。除此之外,生物被膜形成菌株对临床常用抗菌药物的耐药性较强,但对于多黏菌素与替加环素的耐药性较低。20%的强成膜菌株对多黏菌素产生了耐药性,而中等与弱成膜菌株均对多黏菌素敏感。总体而言,生物被膜形成能力强的菌株其耐药性高于生物被膜形成能力弱的菌株。因此,养殖企业在预防和治疗疾病的过程中需要遵循“对症用药、少用药、合理用药”的原则,减少细菌耐药性的发生;另外生物被膜对临床禽致病性大肠杆菌病防治具有重要意义,对生物被膜的研究有很大的临床应用价值。
生物被膜在细菌对耐药、逃避宿主免疫防御及反复感染等方面发挥重要作用[31]。临床上当抗菌药的治疗效果较差时,除了考虑耐药性因素,还应考虑病原菌生物被膜因素。结合物理、噬菌体、金属离子等方法[36],破坏或者清除细菌生物被膜后,再使用抗菌药杀灭游离病原菌,从而提高临床治疗效果。中药具有的抗菌消炎、低价、无毒、无残留和不易产生耐药性等优点,很多研究结果也证明了其显著的抗菌效果、抗细菌生物被膜作用及其他优点[37-38]。这为临床禽致病性大肠杆菌病防治及抗菌药的合理使用提供借鉴。
致谢:潘玲、李郁和王勇3位老师慷慨赠予临床分离的禽致病性大肠杆菌菌株,谨致谢意。

