耕作方式对燕麦田土壤微生物群落多样性的影响
王丽芳 张德健 张婷婷
(内蒙古大学生命科学学院/牧草与特色作物生物技术教育部重点实验室,010070,内蒙古呼和浩特)
土壤微生物的生长代谢活动都发生在土壤环境中,其群落的丰富度、均匀度以及优势度与土壤的理化性质息息相关。自然因素与人为因素通过影响土壤的理化性质进而影响微生物群落多样性[1-3],相比于自然因素,合理的耕作方式、施肥和喷洒农药等田间管理措施改善土壤环境更易于操作。因为耕作方式对土壤的容重、孔隙度、含水量、温度、养分含量和pH值等变化有着复杂的影响[4-7],直接或间接地影响到土壤微生物的生活环境,是近些年国内外学者重点研究的方向。
研究表明,土壤环境、土壤微生物及农作物会形成一个相互制约、相互促进的系统,合适的耕作方式可以对这个系统进行优化,实现更高的作物产量以及土地利用的可持续发展[8]。土壤微生物的存在可以通过自身的代谢活动反作用于土壤环境,除直接影响农作物对营养成分的吸收外,还会影响土壤酶的活性,提高土壤有机质含量,释放一些对农作物生长起促进作用的植物激素[9-11],且研究发现土壤微生物群落的改变会影响土壤环境中植物激素的种类和浓度,从而调节农作物的生长发育[12]。同时,人为干预土壤中微生物的群落种类与数量对于农作物的增产也有十分积极的作用[13]。研究表明,大部分土壤微生物对耕作措施很敏感,并表现出不同的反应[14-15]。李景等[16]研究发现,采用免耕和深松结合小麦秸秆覆盖以及小麦-花生轮作等措施均可改善土壤团聚体状况,提高土壤微生物多样性指数。Carpenter-Boggs等[17]研究表明,在免耕系统中,土壤微生物的活性和数量都显著高于翻耕土壤。钟文辉等[18]研究表明,减少土壤耕作结合秸秆覆盖可提高表层土壤细菌总量,增加土壤微生物的多样性。Meriles等[19]发现在花生-玉米-大豆的轮作体系中,玉米残茬中木霉菌群显著增加。Drijber等[20]也发现在长期小麦轮作种植制度下,土壤细菌群落会发生变化。但是,在燕麦生产系统下,不同耕作措施对土壤微生物群落多样性的影响研究还鲜见报道。本研究以燕麦田土壤微生物为研究对象,采用16S rRNA测序技术及ITS测序技术探究耕作方式对其群落多样性的影响,旨在为燕麦农田保育和农田生态系统优化提供借鉴。
1 材料与方法
1.1 试验区概况
试验区地处内蒙古呼和浩特市武川县(40°47′~41°43′N、110°30′~115°53′E),位于内蒙古高原南端,海拔约1600m,属温带大陆性季风气候,全年降雨分布不均匀,多集中在夏季,其余时间比较干旱。全年无霜期95~110d,6级以上大风天有39d以上。
1.2 试验设计
采用完全随机区组设计,共设置机械免耕播种和传统翻耕(CK)2种耕作方式,3次重复,共6个小区,小区面积为150m2(15m×10m),行距20cm,随机排列。种肥施磷酸二铵120kg/hm2和尿素30kg/hm2,田间采用常规管理。于燕麦拔节期和灌浆期采集土壤样品,4个处理分别为翻耕拔节期(FGB),免耕拔节期(MGB),翻耕灌浆期(YGF)和免耕灌浆期(YGM)。在各小区用“S”形取样法确定5~7个取样点,用土钻钻取0~20cm的土层,每次取样500g,将土样混合均匀,拣出草根和石块等杂物,放入-80℃冰箱冷藏备用。
1.3 测定项目和方法
将各处理土样注好标签,制成模板工作液。用MiSeq宏基因组测序法测定细菌群落多样性,对细菌的16S V4区进行扩增,稀释定量至4~5pM后上机进行测序。用454宏基因组测序法检测真菌群落多样性,对真菌的ITS区进行PCR扩增,利用Roche 454 GS FLX+测序仪完成测序。
1.4 数据处理
测序平台为Illumina MiSeq平台[21]。通过RDP-classifier方法,以RDP数据库的序列为基础,对OTU代表序列进行注释,在此基础上使用mothur软件生成各OTU之间的维恩图。然后利用样本之间的物种演化信息和丰度信息进行单线性分析,得到样本之间差异的距离矩阵。应用R(vegan)软件绘制PCA图和heatmap图,再利用软件MetaPhlAn绘制生物群落结构图。
2 结果与分析
2.1 优质序列统计
优质序列是指有效测序序列中含有特异性扩增引物、不含模糊碱基和长度大于可供分析标准的序列。各处理土壤样品真菌序列统计结果见表1,共得到优质序列66 832条,其中燕麦MGB处理的优质序列比例最高,占比86.87%,其余3个处理优质序列比例普遍偏低,且处理间相差不大。
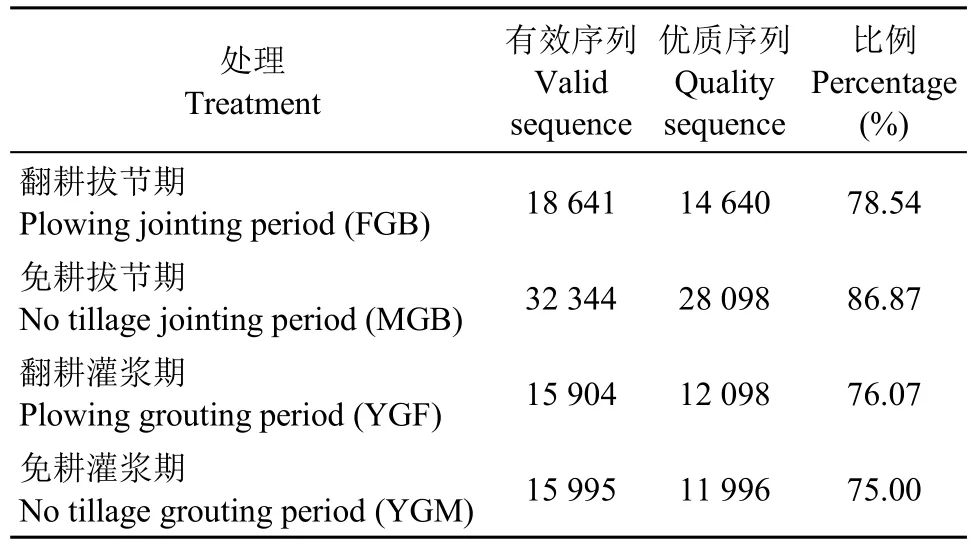
表1 土壤真菌序列数Table 1 Soil fungal sequences number
不同耕作方式所得土壤样品细菌序列统计结果见表2,共得到优质序列258 304条,YGM的优质序列比例略高于YGF。
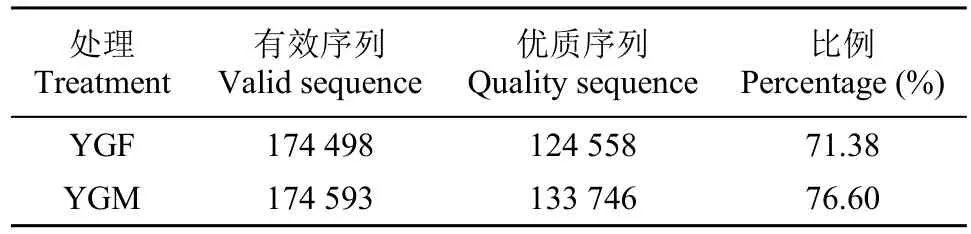
表2 燕麦灌浆期土壤样品细菌序列数Table 2 Number of bacterial sequences in soil samples during oat grouting period
2.2 操作分类单元(OTU)聚类分析
OTU(operational taxonomic units)是通过一定的距离测量方法,计算出2个不同序列之间的距离或相似度,然后设置特定的分类阈值,得到相同阈值下的距离矩阵,并进行聚类运算以形成不同的分类单元。这种对序列进行聚类的方法不需要对每一条序列都进行物种注释,提高了测序分析的准确性[22]。
图1(左)为燕麦田土壤真菌OTU聚类所得到的韦恩图,可以看出,不同处理共得到真菌种类6096种,其中3810种为4个处理共同具有,占总数的62.50%。YGF处理特有的真菌种类最多,为33种;而FGB处理特有的真菌种类最少,只有4种。4个处理的真菌种类丰富度由高到低分别为YGM处理(5547种)、MGB处理(5484种)、YGF处理(5413种)、FGB处理(4962种)。
图1(右)为燕麦田土壤细菌OTU聚类所得到的韦恩图,共检测到细菌1578种,其中94种为4个处理共有,约占总数的6.00%。MGB处理拥有最多的特有性细菌,为454种,其他3个处理中检测到的细菌种类相差不大。同样,MGB处理所得细菌种类也最多,并远高于其他3个处理,为705种。其他3个处理细菌丰富度由高到低为FGB处理(527种)、YGM处理(519种)和YGB处理(451种)。
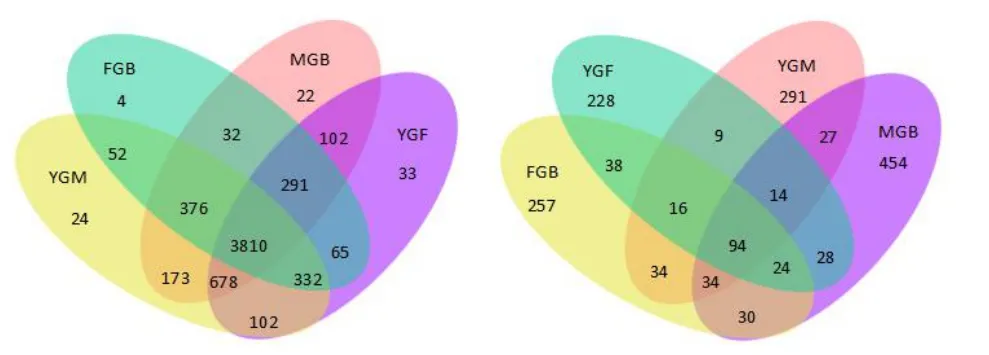
图1 不同耕作方式下燕麦田土壤真菌(左)和细菌(右)OTU聚类图Fig.1 OTU clustering diagram of soil fungi(left)and bacterium(right)in oat field under different tillage methods
2.3 物种丰度分析
丰度分布曲线(rank abundance curve)是分析物种多样性的一种方式,其构造方法是对单个样本中每个OTU中包含的序列数进行计数,根据丰度(包含的序列数)从大到小对OTU进行排序,以OTU等级为横坐标,以每个OTU中所含的序列数为纵坐标绘制成图。丰度分布曲线可以用来反映微生物的物种丰度和物种均匀度[23]。曲线在横坐标上的范围反映物种的丰度,范围越大,物种的丰度越高;曲线的平滑程度反映物种的均匀度,曲线越平缓,物种分布越均匀。图2为不同耕作方式下燕麦田土壤真菌和细菌丰度分布曲线,很显然,MGB处理真菌种类的组成最为丰富,物种组成的均匀程度也最高,其他3个处理差异不太明显;4个处理的细菌种类丰富度与均匀度无较大差异。

图2 不同耕作方式下燕麦田土壤真菌和细菌丰度分布曲线Fig.2 Distribution curve of soil fungi and bacteria abundance in oat fields under different tillage methods
2.4 Alpha多样性分析
Alpha多样性指数反映群落内物种数量及其相对丰度,是群落内各物种利用同一生境互相竞争或共生的结果。Alpha多样性指数分为3类,物种丰富度指数、物种均匀度指数和物种多样性指数。物种多样性指数是物种丰富度指数和物种均匀度指数的综合。表3中除simpson指数之外,均与物种丰富度和多样性都呈正相关,simpson指数与物种多样性呈负相关[24-25]。不同耕作方式和不同生育期燕麦土壤微生物多样性指数计算结果见表3,FGB处理的真菌群落丰富度最高(ace=1343.8190,chao=1022.2000),而细菌群落丰富度没有明显差异。MGB处理的真菌群落多样性(shannon=4.6401,simpson=0.0254)和细菌群落多样性(shannon=6.9325,simpson=0.0030)最高。YGM处理真菌群落多样性(shannon=3.4812,simpson=0.1053)最低,同时各处理之间细菌群落多样性指数差别不大。
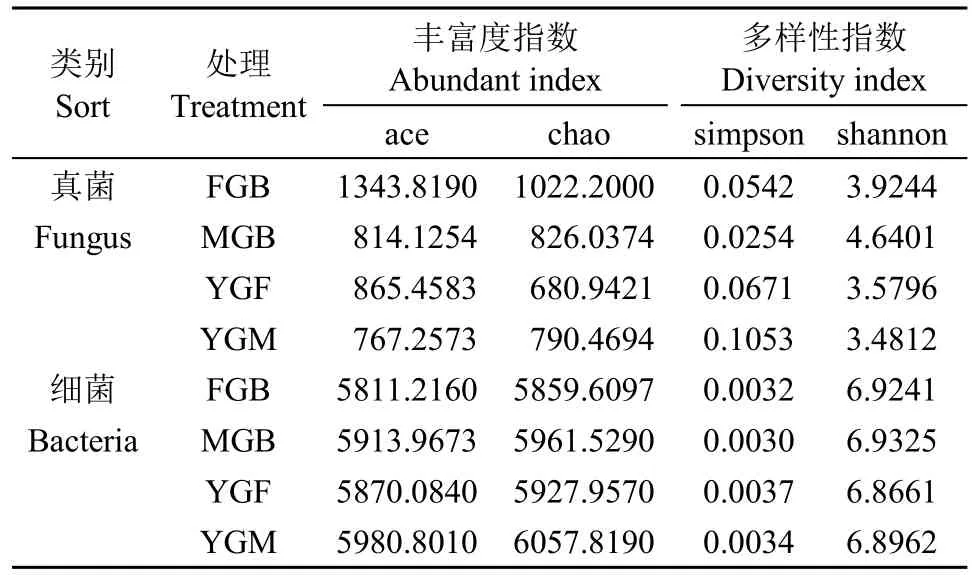
表3 不同耕作方式下燕麦不同生育期土壤微生物多样性指数Table 3 Soil microbial diversity indexes of oat under different tillage methods and different growth stages
2.5 群落结构分析
利用Qiime对OTU表生成门水平上的物种丰度表和多样性物种分布图(图3和表4)。在土壤真菌群落分布图中,占优势的门主要有子囊菌门(Ascomycota)、担子菌门(Basidiomycota)。在门水平上土壤真菌的演替规律比较明显,其中子囊菌门在各个处理各生育时期均占绝对优势(64.30%),其中以FGB处理的物种丰度和物种组成最为丰富。相较而言,土壤细菌在各处理以及各时期的物种丰度和物种组成较为均匀。在门水平上比较占优势的是放线菌门(37.30%)、变形菌门(23.50%)和酸杆菌门(12.30%)。
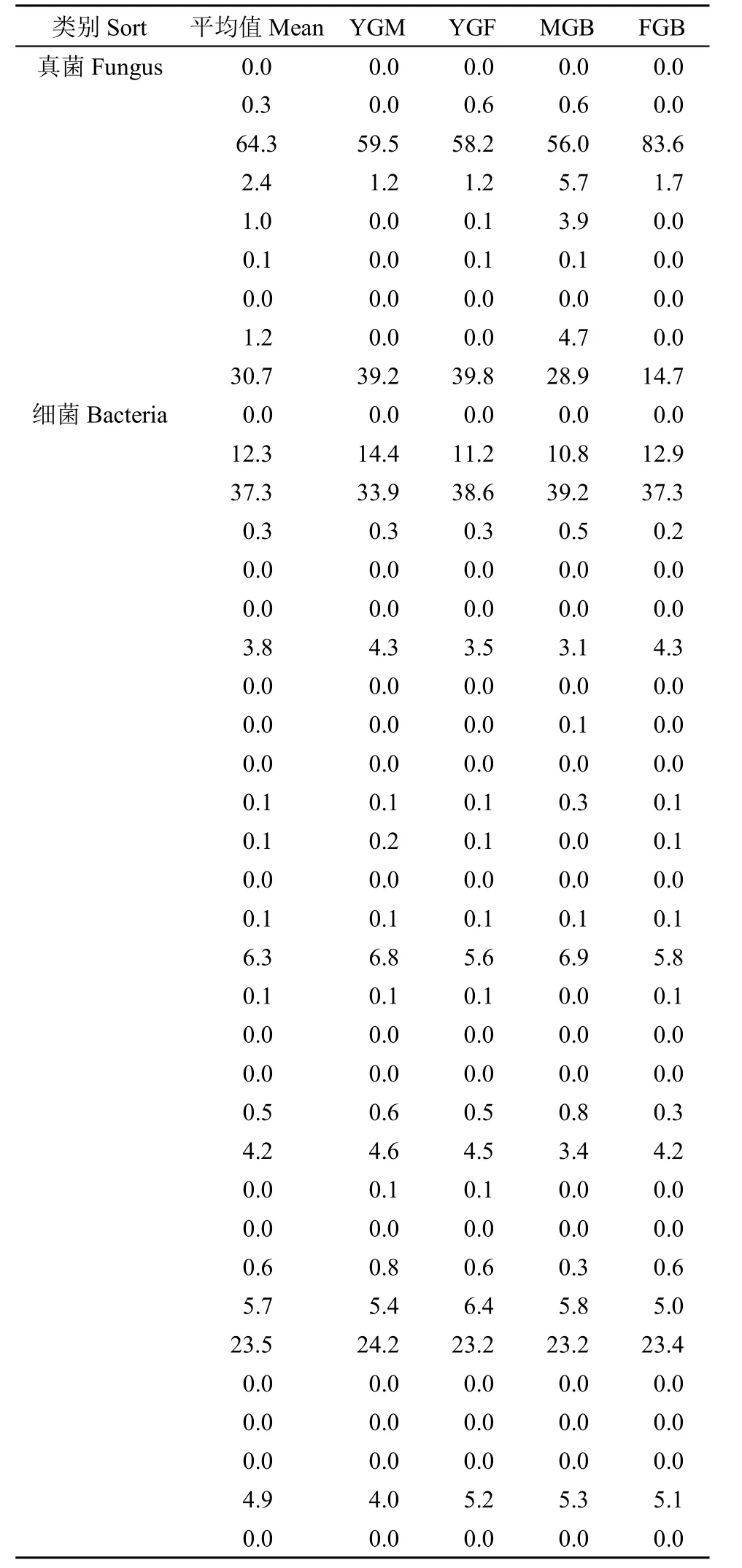
表4 不同耕作方式对燕麦土壤真菌和细菌丰度的影响Table 4 Effects of different tillage methods on the fungi and bacteria abundance of oat soil %

图3 不同耕作方式对燕麦土壤真菌和细菌分布的影响Fig.3 Effects of different tillage methods on the distribution of oat soil fungi and bacterium
2.6 主成分分析
通过主成分分析(principal components analysis,PCA)可以观察微生物群落间的差异,2点之间的距离越小,表明2个样品的微生物群落差别越小[26-27]。图4是使用R软件绘制的PCA散点图,表现出土壤微生物在属水平上的分类和物种丰富度。由图4可以观察到,FGB与MGB处理的真菌群落结构比较接近,而其他处理之间的真菌群落结构差异性明显。细菌的主成分分析图则表明,MGB与YGF处理的细菌群落多样性相似度较高,而其他处理之间的差异度较高。
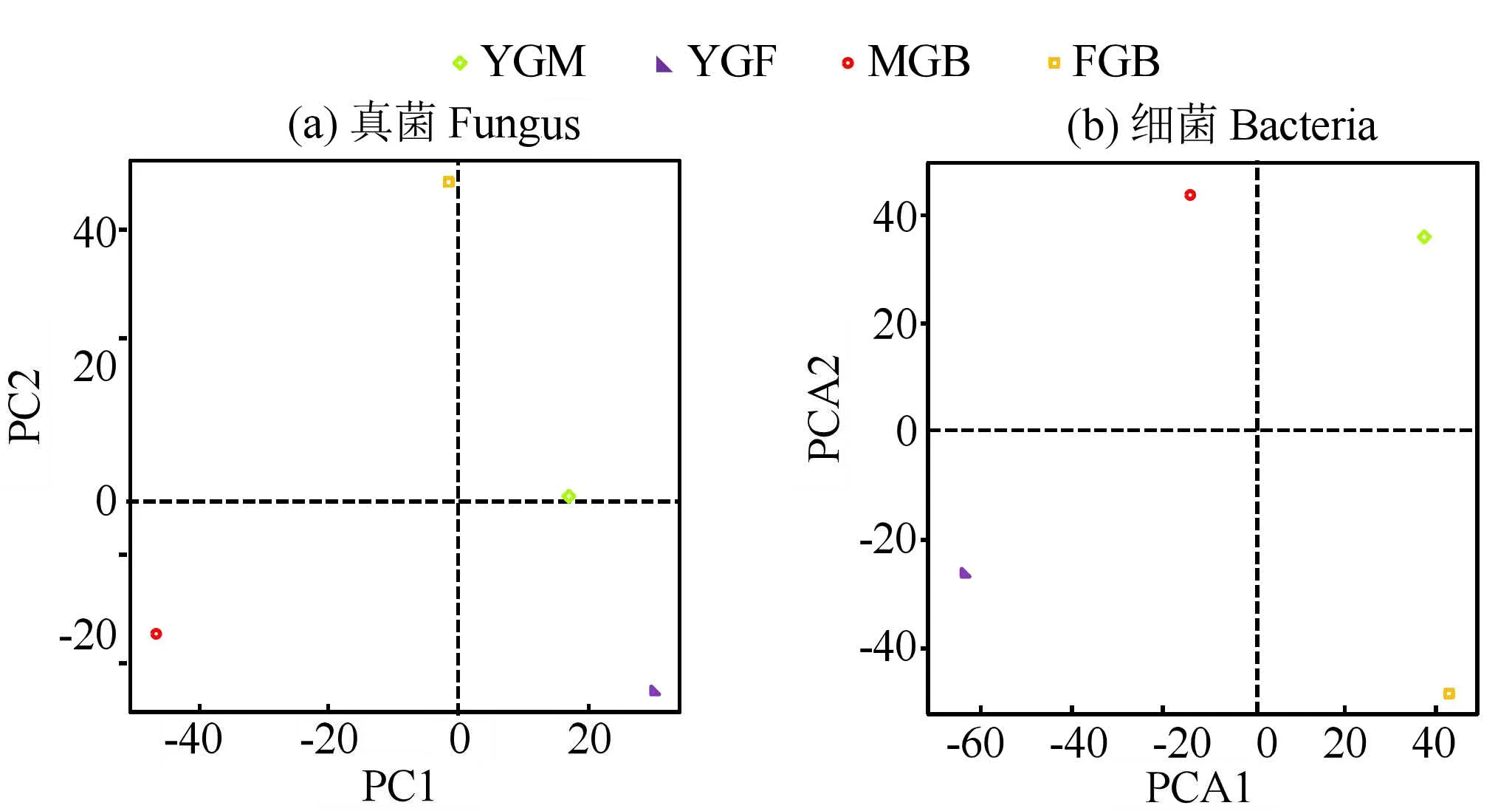
图4 真菌和细菌主成分分析Fig.4 PCA of fungi and bacterium
2.7 物种差异分析
将不同的样品在一定分类水平上,按照物种丰度高低进行聚类,聚类结果用色块表示。色块间的颜色差异可以用来反映多个样品在群落构成上的相似性和差异性[28]。图5中的每个色块代表一个样品的一个属的丰度,通过不同处理的聚类分析热图可以看出,不同的样品在不同处理方式下均表现出一定程度的相似性,但不同处理对真菌种类的差异性影响表现不同,其中MGB处理的土壤样品中真菌的种类相对于其他时期的土壤样品表现出高度的差异性。而不同土壤样品中细菌种类只有在YGF处理表现出了明显的相似性,其他时期无明显相似性或具有一定差异性。相比之下,YGM和MGB处理土壤样品中细菌的差异性更加明显。

图5 不同处理真菌和细菌聚类分析图Fig.5 Cluster analysis of fungi and bacterium under different treatments
2.8 进化关系分析
图6为生物群落结构图,可以反映样品中的微生物种类和丰度分布情况,可以观察到丰度较高的微生物种类。由内而外的节点显示出群落结构的从属关系,依次代表界、门、纲、目、科、属、种。节点的大小反映了对应分类水平上的物种丰度,丰度≥1%的物种水平在图中用不同的颜色标识出来。线条的长短距离表示进化距离,可以反映物种之间的差异程度[29-30]。燕麦田真菌共检测到4个目(肉座菌目、柔膜菌目、刺盾炱目和爪甲团囊菌目)和4个科(丛赤壳科、粉褶菌科、黑线菌科和沙漠壳菌科),其中丛赤壳科从属于肉座菌目,这一支也在整个群落中占据优势地位,即图6中的红色节点。另外,黑线菌科从属于刺盾炱目,柔膜菌目、黑线菌科和刺盾炱目在进化上距离较近。燕麦田土壤细菌共检测到10个属丰度较大,其中有些属无法培养或确认,可以分辨的有5个属,分别为索溴杆菌属、芽生球菌属、节杆菌属、诺卡氏菌属和微枝形杆菌属。
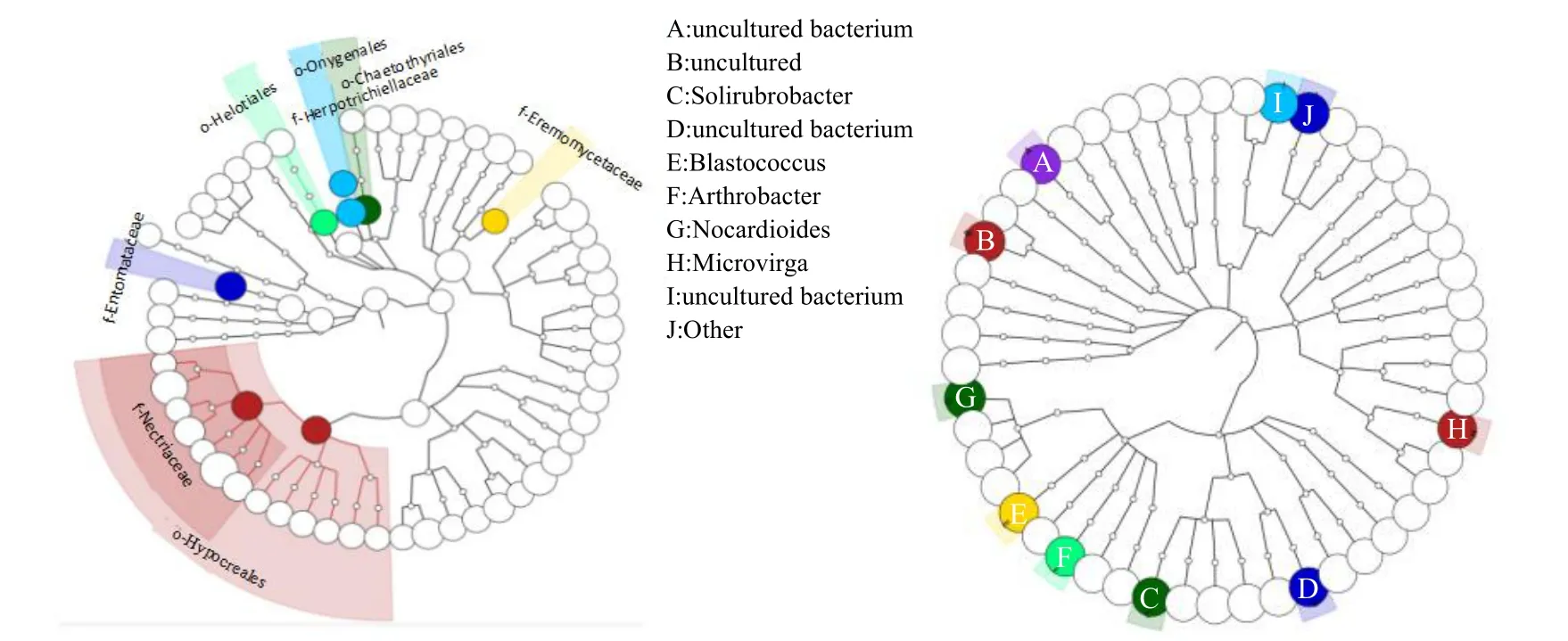
图6 不同处理燕麦田土壤真菌(左)和细菌(右)群落结构图Fig.6 Community structure of fungi(left)and bacterium(right)in oat fields under different treatments
3 讨论
3.1 不同耕作方式下土壤微生物群落多样性比较
通过本试验可以发现与燕麦田土壤微生物多样性密切相关的因素为耕作方式的转变。在同一生育时期,免耕处理下的样品经过OUT聚类检测到更多的微生物种类,物种丰度曲线范围广且平滑,simpson和shannon指数也最高。且通过heatmap热图可以看出免耕有利于土壤微生物差异化的形成。以上都表明,免耕处理更有利于形成丰富度和均匀度高的土壤微生物群落。肖琴等[31]和卢闯等[32]的研究表明,免耕方式可以保护土壤中的团粒结构,从而保存土壤水分与温度,增加土壤有机质含量,为微生物生长提供充足养分,有利于微生物量的增加,这与本试验的研究结果一致,免耕作为一项保护性耕作技术,可能成为指导燕麦田田间管理措施的切入点,通过调节微生物群落的多样性来提升土壤肥力和改善燕麦田土壤环境,有望成为将来的研究趋势。
3.2 燕麦不同生育期土壤微生物群落多样性比较
燕麦不同生育期对土壤微生物的种类及数量也有影响,但本试验中并不能总结出统一的规律。在前人的研究中,作物不同生长期对土壤微生物的影响有不同结论。研究表明[33-34],在玉米生长期中微生物的群落多样性会先增加后减少。这可能是由于各处理土壤微生物群落结构存在明显的季节性变化及生境上的变化。与玉米土壤微生物群落结构组成关联最大的因素是温度,其次是耕作方式和土壤含水量,土壤养分及pH值影响最小。潘孝晨等[35]则认为,土壤微生物量随作物生长呈上升趋势,原因可能是作物的根系脱落物可为土壤微生物提供养分。樊晓刚[34]的研究则认为不同耕作方式下微生物量及其多样性存在差异,免耕和少耕等保护性耕作为土壤微生物的生长繁殖创造了良好的生境条件,一定程度上增加了土壤表层微生物量及大量的根系分泌物,增加了微生物种群数量,有利于维持微生物多样性,这与本研究结论一致。不同结论可能与作物及其生长过程中根际营养环境发生变化以及作物与微生物进行营养竞争有关。
3.3 燕麦田土壤优势真菌种类分析
不同作物种类、不同的耕作方式以及其他各方面可能造成土壤环境变化的因素决定了土壤微生物的种类与数量。赵丽琨[36]研究了不同耕作方式对玉米地真菌种类及数量的影响,得出,玉米土壤真菌的优势属有镰孢菌属、腐霉属、根霉属、链格孢属、木霉属、肉座菌属、绿僵菌属、青霉属和曲霉属等,这些都分属于子囊菌门、接合菌门和肉座菌目。徐佳等[37]发现不同作物田中优势真菌属有青霉(子囊菌门)、曲霉(子囊菌门)、镰刀菌(子囊菌门)和木霉(肉座菌目)。本研究发现燕麦田土壤真菌的优势菌门为子囊菌门和担子菌门,优势菌目为肉座菌目、柔膜菌目、刺盾炱目和爪甲团囊菌目,与前人研究基本一致。
3.4 燕麦田土壤优势细菌种类分析
在土壤细菌方面,汪娅婷等[38]的研究表明云南地区玉米根际微生物群落的优势菌门为拟杆菌门、变形菌门和放线菌门。Jin等[39]在陕西杨凌和河北张家口地区的试验发现,谷子根际微生物的优势菌门为放线菌门和变形菌门。Kwak等[40]通过对番茄土壤微生物的研究得出,变形菌门、拟杆菌门、酸杆菌门、厚壁菌门为优势菌门。本试验所得结论为燕麦在不同生长发育期细菌优势菌门主要为放线菌门、酸杆菌门和变形菌门,与前人研究结果基本一致。
4 结论
在传统翻耕和机械免耕2种处理下,对燕麦拔节期和灌浆期的土壤微生物群落多样性进行了分析。结论如下:从OUT聚类分析、物种丰度曲线、Alpha多样性分析以及heatmap图中均可以看出与传统翻耕相比,免耕处理下土壤微生物多样性更高,群落之间差异性更大。免耕可以减少土体扰动,有助于土壤大团聚体的形成,保存土壤养分,因此,免耕能为微生物的生命活动创造更好的微环境,进而增加土壤微生物多样性。燕麦田土壤真菌群落的优势门有子囊菌门和担子菌门;土壤细菌群落的优势门有放线菌门、变形菌门和酸杆菌门。

