谷子粒黑穗病菌PCR 检测体系的建立
郝雅萍,焦思薇,郭二虎,仪慧兰
(1.山西农业大学农学院,山西太原 030031;2.山西大学生命科学学院,山西太原 030006;3.山西农业大学谷子研究所,山西长治 046000)
谷子(Setaria italica)是一种重要的禾本科作物,在我国有8 000 多年的栽培历史,属山西省优势杂粮作物。随着谷子种植面积的不断扩大,多种病害时有发生[1],谷子黑穗病在我国的主要产区均有不同程度的发生,其中,谷子粒黑穗病是最常见的,其致病菌为粒黑穗病菌(Ustilago crameri)[2]。病菌孢子随谷种播种进入土壤,随后孢子萌发侵染幼苗,在植株体内蔓延,最终危害谷子穗部。被病菌侵染的籽粒因病原菌冬孢子大量形成变为黑粉,黑粉外包坚韧的灰白色膜,有一定机械强度。当谷子收获脱粒或经风吹摩擦时,籽粒破裂散出黑粉污染种子,来年随种子播种进入谷田。目前对谷子黑穗病的控制主要靠农药[3],而抗病品种的使用才是解决问题的根本。
针对不同地域病原菌生理小种的差异[4],对抗病品种的常规筛选主要是应用形态学鉴定,通过对相同种植条件下不同品种谷子植株的感病特性进行分析比较,由发病率和发病程度判断品种对病原菌小种的敏感或抗性[5-6],该过程比较费时,不利于控制病害的传播。因此,寻找一种快速、灵敏、有效的方法来检测不同品种的抗病性是十分重要的。
近年来,研究人员应用PCR 技术检测植株组织中的病原菌DNA 来判断病原菌对植株的侵染特征,该过程操作简便、特异性强、快速、经济[7]。目前已建立了针对玉米和高粱的丝黑穗病[8-9]、小麦白粉病和散黑穗病[10-11]、甘蔗黑穗病[12]等的PCR 检测技术。用PCR 技术检测特定植物病原菌主要靠引物的有效性,引物设计用到的基因序列有:真菌核糖体脱氧核糖核酸(rDNA)及间隔区,如基因间区(Intergenic spacer,IGS)、核糖体基因内转录间隔区(Internal transcribed spacer,ITS)等[13-14];未知的特异DNA 片段;保守的蛋白基因序列。但到目前为止,应用PCR 方法检测谷子粒黑穗病菌的研究未见报道。
本研究根据黑穗病菌ITS 序列设计PCR 引物,建立了谷子粒黑穗病菌的快速检测体系,并证明所用引物和PCR 检测体系在鉴定病菌感染和植株抗病性方面具有较高的特异性,可快速、准确地监测谷子粒黑穗病,并为提前预防谷子粒黑穗病提供特异性高、实用性强的技术支持。
1 材料和方法
1.1 试验材料
谷子粒黑穗病菌(Ustilago crameri)冬孢子、谷瘟病菌(Pyricularia setariae)菌丝,由山西农业大学谷子研究所郭二虎研究员提供;谷子白发病菌(Sclerospora graminicola)孢子、玉米黑粉菌孢子采自大田发病植株。
1.2 试验方法
1.2.1 材料准备 取谷子粒黑穗病菌冬孢子粉过0.297 mm 筛,用于谷种拌菌。选用对黑穗病抗性不同的谷子品种晋谷21 和长农35,设谷种拌菌组与不拌菌对照组,同期播种于山西农业大学谷子研究所试验田。每个处理播种3 个小区作为重复,每个小区面积30 m2,拌菌组与对照组间设置隔离带。在谷子拔节期与抽穗期,每小区随机选3 个样点,每个样点随机选取生长一致的5 株植株,采集拌菌组与对照组植株各5 株,带回实验室备用。
1.2.2 病原菌和谷子DNA 的提取 称取一定量的病原菌孢子粉或谷子叶片/穗梗于研钵中,加少许石英砂,加入CTAB 提取液[15-16],充分研磨,匀浆液转入离心管中于65 ℃水浴50 min,10 000 r/min 离心10 min,取上清加入等体积的氯仿∶异戊醇(24∶1(V/V)),10 000 r/min 离心10 min。取上清,加入RNase A,37 ℃水浴40 min。加入等体积的预冷异丙醇,12 000 r/min 离心15 min,沉淀用75%乙醇漂洗,溶于TE。用琼脂糖凝胶电泳检测所提DNA分子的完整性,测OD260和OD280值检测提取物的浓度和纯度。
1.2.3 谷子粒黑穗病菌DNA 的序列分析 以真菌ITS 的通用引物ITS1(5′-TCCGTAGGTGAACCTGC GG-3′)和ITS4(5′-TCCTCCGCTTATTGATATGC-3′)为扩增引物,以谷子粒黑穗病菌DNA 为模板,进行PCR 扩增。扩增产物经琼脂糖凝胶电泳检验合格后送华大基因有限公司测序,测序结果用Blast 进行分析,并用Clustal X,MEGA 5.0 获得系统发育树。
1.2.4 谷子粒黑穗病菌特异性引物设计 将菌株Ustilago avenae(登录号AY740062.1)、Ustilago hordei(登录号AY740068.1)、Ustilago maydis (登录号AY345004.1)、Ustilago nuda(登录号AY740069.1)的rDNA-ITS 序列与谷子黑穗病菌ITS 序列进行比对,选择与谷子黑穗病菌ITS 序列相似度高的菌株的ITS 序列,利用生物学软件Clustal X 进行比对分析,运用软件Primer Premier 5.0 设计谷子粒黑穗病菌特异性引物,其中,上游引物F1序列为5′-AGAC GGGTTTACCACTCAAC-3′,下游引物R1序列为5′-AAGCCACGGTGAATGGCAAAG-3′,由生物工程(上海)股份有限公司合成。
1.2.5 引物特异性及灵敏度检测 分别以谷子黑穗病菌孢子、谷子白发病菌孢子、谷瘟病菌菌丝、玉米黑粉菌孢子及对照组谷子叶片的基因组DNA 作为PCR 扩增模板,用自行设计的谷子粒黑穗病菌ITS 引物进行PCR 扩增。扩增体系为20 μL,包括:10×Buffer 2 μL,dNTP 1.6 μL,引物各0.4 μL,DNA模板量0.4~1.0 μL,Taq 酶0.2 μL,余量用双蒸水补足。扩增程序为:94 ℃预变性5 min;94 ℃变性1 min,55 ℃退火1 min,72 ℃延伸1 min,30 个循环;最后72 ℃延伸10 min。扩增产物用1%琼脂糖凝胶电泳检测。
将谷子粒黑穗病菌基因组DNA 浓度分别调整为100、10、1 ng/μL、100、10、1、0.1 pg/μL,作为PCR扩增模板,采用上述引物和条件进行PCR 扩增,扩增产物用1%琼脂糖凝胶电泳检测。
1.2.6 大田谷子植株粒黑穗病菌侵染性检测 以谷种拌菌组和不拌菌对照组谷子的旗叶和穗梗的基因组DNA 作为PCR 扩增模板,用谷子粒黑穗病菌ITS 引物进行PCR 扩增,扩增产物用1%琼脂糖凝胶电泳分析,若出现特异性扩增条带则说明谷子特定组织被黑穗病菌侵染。
2 结果与分析
2.1 谷子粒黑穗病菌ITS 序列特征分析
将提取的谷子粒黑穗病菌冬孢子DNA 进行ITS-PCR 扩增,扩增产物测序结果在GeneBank 中进行Blast 检索分析,构建Neighbour Joining 分子发育树。结果显示(图1),粒黑穗病菌孢子ITS 序列长度在700 bp 左右,与GeneBank 数据库中的谷子粒黑穗病原菌(AY344999.1 Ustilago crameri)的序列同源性为95%,系统发育树中聚在一支。说明本研究从田间发病谷穗得到的病原菌为谷子粒黑穗病菌。

2.2 引物特异性与灵敏度检测
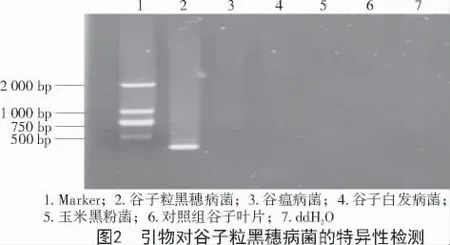
用自行设计的谷子粒黑穗病菌引物对不同供试样品基因组DNA 进行PCR 扩增,扩增产物电泳分析发现,仅谷子粒黑穗病菌基因组DNA 作模板时能扩增出1 条特异性条带,大小与目标片段(320 bp)基本一致,其他供试菌株及对照组谷子叶片没有扩增产物。结果表明,所设计的引物对谷子粒黑穗病菌具有特异性(图2)。
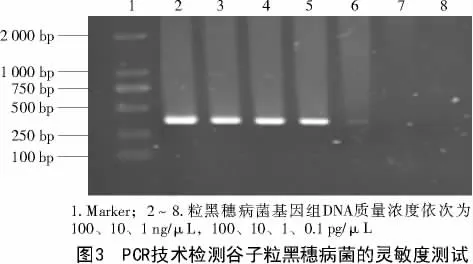
采用相同的扩增体系和扩增程序,测试粒黑穗病菌基因组DNA 模板量对扩增的影响,结果表明(图3),模板质量浓度为100、10、1 ng/μL 以及100、10 pg/μL时均可获得清晰的目标条带,模板量为1、0.1 pg/μL 时,PCR 扩增未能得到目标条带。因此,本研究建立的PCR 检测体系在粒黑穗病菌基因组DNA 质量浓度为10 pg/μL 时能够检出。
2.3 PCR 检测大田谷子植株中的病原菌结果
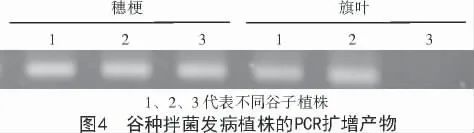
以谷子穗梗和旗叶顶端组织基因组DNA 作模板,用自行设计的谷子粒黑穗病菌引物进行PCR检测。结果发现,以未拌菌对照组谷子穗梗和旗叶基因组DNA 为模板进行PCR 扩增时,琼脂糖凝胶电泳未检出扩增产物;以拌菌发病植株穗梗和旗叶的基因组DNA 为模板,PCR 扩增检出了谷子粒黑穗病菌的特异性序列(图4)。
以拌菌未发病植株穗梗和旗叶基因组DNA 为模板,用特异性引物进行PCR 扩增,扩增产物电泳结果表明(图5),晋谷21 的5 株植株中有1 株的穗梗及旗叶中扩增出特异性条带,有1 株旗叶中扩增出条带、穗梗中未扩增出条带,其余3 株的穗梗和旗叶中均没有扩增产物;长农35 有4 株的穗梗和旗叶中检测出特异性条带,1 株穗梗和旗叶中均没有检出扩增产物。结果表明,长农35 拌菌组植株中黑穗病菌检出率高于晋谷21,该结果与2 个品种的黑穗病发病率[6]相一致。

3 结论与讨论
谷子粒黑穗病是一种真菌性病害,黑穗病发生的严重程度取决于谷子品种的抗病性和环境条件。本研究根据谷子粒黑穗病菌ITS 序列,设计了1 对引物F1/R1,应用该引物对谷子粒黑穗病菌、白发病菌、谷瘟病菌和玉米黑粉菌基因组DNA 进行PCR扩增,结果表明,只有谷子粒黑穗病菌扩增出1 条特异性条带,说明这对引物对谷子粒黑穗病菌是特异的,且检测到的黑穗病菌基因组DNA 的最低质量浓度为10 pg/μL。对谷种拌菌组植株的检测结果表明,所设计的特异性引物在鉴定植株抗病性方面具有较高的特异性。
朱桂清等[11]用真菌rDNA 非编码区ITS1 的通用引物设计了特异性引物,对小麦散黑穗病菌进行了PCR 检测;程颖慧等[17]根据ITS 片段设计引物检测小麦腥黑穗病菌,并用于与黑麦腥黑粉菌的区分。商蓓等[18]应用真菌rDNA 的ITS 序列设计了对苹果黑星病菌有高度特异性的引物,可检测到苹果黑星病菌基因组DNA 浓度是100 fg/μL;王楠等[19]研究设计的谷子锈病菌IGS 序列特异性引物,利用巢式PCR 建立了对谷子锈病的检测体系,检测到病原菌基因组DNA 最低质量浓度为100 pg/μL。本研究建立的PCR 技术体系能够检测到的谷子粒黑穗病菌基因组DNA 最低质量浓度为10 pg/μL,具有较高的检测灵敏度。
用设计的特异引物对谷种拌菌组发病植株进行病原菌检测,在穗梗和旗叶中都检出特异性条带,表明病原菌随植株的生长发育,对植株顶端的旗叶及穗梗都进行了侵染,病菌对植株的侵染是全身性的。用此引物对拌菌组中未发病植株进行检测,长农35 穗梗与旗叶中检出粒黑穗病菌的植株数多于晋谷21,这与田间植株发病率数据[5]基本一致。本研究建立的PCR 体系可对谷子粒黑穗病菌进行定性检测,对定量检测还需进一步研究。
综上所述,本研究初步建立了谷子粒黑穗病菌的PCR 检测鉴定方法,这种快速、高效的检测手段为今后谷子粒黑穗病菌的检测鉴定提供了基础,并且可以用于检疫研究、流行病害调查、谷子粒黑穗病过程控制和不同谷子品种抗病性鉴定。

