植物内生细菌MY1 的发酵条件优化及其抑菌物质稳定性分析
王赛风,石玉星,马东丽,张宝俊,任 璐,赵晓军
(山西农业大学植物保护学院,山西太谷 030801)
利用植物内生细菌防治植物病害是一种行之有效的防治手段[1-2]。目前,其已被广泛应用于经济作物[3-4]、粮食作物[5-6]和中药材[7-9]等多种植物真菌病害的防治,包括植物根、茎、叶、花各部病害及采收后果品病害等[10]。内生细菌作为防治植物病害的天然资源菌,具有广阔的理论研究价值和开发应用前景[11-12]。
植物内生细菌为宿主植物提供健康屏障,是植物生态系统中的重要组成部分[13],也是生防微生物的重要来源[14]。内生细菌产生的活性物质可以促进植物的生长发育,增强寄主植物的抗病能力[15-16]。目前,对于内生细菌的研究主要集中在发现新来源菌株和对已发现的植物内生细菌进行深入研究。张立新等[17]分析了内生细菌YT-6 对樱桃采后灰霉病的抑制效果以及促生特性;李乔曼等[18]对内生细菌LYM3 进行分离鉴定并研究了其抗菌活性物质的发酵条件;姬文秀等[19]从产ACC 脱氨酶的人参中分离出6 株内生细菌,并对其活性物质进行了发酵条件优化。目前,有关甲基营养型芽孢杆菌的研究在农业、工业、养殖业以及医药等方面均有报道[20]。有关甲基营养型芽孢杆菌的研究主要集中在菌株的筛选、分类鉴定、发酵条件优化及代谢产物的稳定性方面,并且对其抑菌机制和生防制剂的开发等进行了研究[21-22]。
植物内生细菌MY1 由山西农业大学植物化学保护实验室筛选得到,是一株对多种植物病原真菌具有良好抑菌活性的生防菌株,经鉴定为甲基营养型芽孢杆菌(Bacillus methylotrophicus)[23]。本试验通过对其发酵条件和抑菌物质的稳定性进行初步研究,旨在明确其最优培养条件,为今后更加有效利用菌株MY1 提供理论依据。
1 材料和方法
1.1 供试材料
1.1.1 供试菌株 植物内生细菌MY1 由曼陀罗(Datura stramonium)叶片中分离获得,经初步鉴定为甲基营养型芽孢杆菌(Bacillus methylotrophic);植物病原真菌谷瘟病菌(Pyricularia grisea)为指示病原菌,均由山西农业大学植物化学保护实验室保存提供。
1.1.2 供试培养基 马铃薯葡萄糖琼脂培养基(PDA):马铃薯200.0 g,葡萄糖20.0 g,琼脂15.0 g,蒸馏水1 000 mL,自然pH[24]。
营养琼脂培养基(NA):蛋白胨10.0 g,NaCl 5.0 g,牛肉膏3.0 g,琼脂15.0 g,蒸馏水1 000 mL,pH 值7.0[25]。
细菌基础培养基(LB):蛋白胨10.0 g,酵母粉5.0 g,NaCl 10.0 g,蒸馏水1 000 mL,pH 值7.0[25]。
营养肉汤培养基(NB):蛋白胨5.0 g,牛肉膏3.0 g,NaCl 5.0 g,蒸馏水1 000 mL,pH 值7.0[24]。
肉汤培养基(CM):蛋白胨10.0 g,牛肉浸膏5.0 g,蒸馏水1 000 mL,pH 值7.0[25]。
NYBD 培养基:酵母浸膏5 g,牛肉浸膏8 g,葡萄糖10 g,蒸馏水1 000 mL,pH 值7.0[25]。
BPY 培养基:蛋白胨10.0 g,NaCl 5.0 g,牛肉浸膏5.0 g,酵母粉5.0 g,葡萄糖5.0 g,蒸馏水1 000 mL,pH 值7.0[24]。
YSP 培养基:乳糖15.0 g,酵母粉6.25 g,牛肉膏2.5 g,蛋白胨2.5 g,蒸馏水750 mL,pH 值7.0[25]。
1.2 内生细菌MY1 发酵条件优化
1.2.1 种子液的制备 将保存的MY1 菌株接入NA 平板上进行活化,28 ℃培养5 d 后接种到LB培养基中,28 ℃、160 r/min 振荡培养24 h,备用。
1.2.2 发酵滤液的制备 按照1%(V/V)的接种量将制备好的MY1 菌株种子液接入LB 培养基中,28℃、160r/min 振荡培养72h 后,于4℃、12000r/min离心10 min,弃菌体,收集上清发酵液,使用0.22 μm微孔滤膜过滤发酵液,得到MY1 发酵滤液,将滤液4 ℃留存备用。
1.2.3 菌株MY1 生长曲线的绘制 按照1%(V/V)的接种量将MY1 种子发酵滤液接入到250 mL LB培养基中,以空白无菌培养基为对照,28 ℃、160 r/min条件下振荡培养,每隔4 h 检测一次OD600值,连续测量72 h 后结束。试验设置3 个重复。
1.2.4 基础培养基的筛选 按照1%(V/V)的接种量将MY1 种子发酵液分别接入到250 mL BPY、CM、LB、NB、NYBD、YSP 培养基中,以空白无菌培养基作为对照,28 ℃、160 r/min 振荡培养;分别测定培养24、48、72 h 的菌体生长量及发酵终止后抑菌物质积累量,确定最佳基础培养基。
1.2.4.1 菌体生长量测定 采用比浊法,使用分光光度计测定发酵液的OD600值,作为菌体生长量。以不接菌的培养基作对照,每组重复3 次。
1.2.4.2 发酵滤液抑菌物质活性测定 以Pyricularia grisea 为靶标菌,采用生长速率法测定抑菌物质的积累量。用直径为5 mm 的打孔器在生长7 d的Pyricularia grisea 菌落边缘打取菌饼;按照1∶9(V∶V)比例将发酵滤液和PDA 培养基混匀制备平板;待平板培养基凝固后,接入Pyricularia grisea 菌饼,25 ℃恒温倒置培养。以空白PDA 培养基接种Pyricularia grisea 为对照,每个处理重复3 次。培养7 d 后,采用十字交叉法测量菌落直径,计算抑菌率。
1.2.5 最优碳源的筛选 将蔗糖、葡萄糖、甘露醇、麦芽糖、果糖、可溶性淀粉、乳糖分别加入基础培养基,配成质量浓度为5 g/L 含不同碳源的液体培养基。将MY1 种子发酵液按照1%的接种量接种到上述培养基,以空白无菌培养基作为对照,置于28 ℃、160 r/min 振荡培养。按照1.2.4 的方法确定最优碳源。
1.2.6 最优氮源的筛选 固定碳源为1.2.5 筛选出的最优碳源,将蛋白胨、尿素、酵母粉和牛肉膏混配、牛肉膏和蛋白胨混配、胰蛋白胨和牛肉膏混配、蛋白胨和酵母粉混配、酵母粉和胰蛋白胨混配、牛肉膏、蛋白胨和酵母粉三者混配分别加入基础培养基中,配成质量浓度为5 g/L 含不同氮源的液体培养基。以空白无菌培养基作为对照,按照1%的接种量接种到上述培养基中,置于28 ℃、160 r/min 振荡培养。按照1.2.4 的方法确定最优氮源。
1.2.7 最佳发酵温度的筛选 分别以1.2.4、1.2.5、1.2.6 筛选出的基础培养基、最优碳源、最优氮源配制培养基,按照1%的接种量接种MY1 种子发酵液。以空白无菌培养基作为对照,将接种后的灭菌培养基分别放置在26、28、30、35 ℃下,160 r/min 振荡培养。按照1.2.4 的方法确定最佳发酵温度。
1.2.8 发酵条件的正交优化 通过正交试验L16(45)对菌株MY1 发酵滤液的发酵条件进行优化(表1),每个处理重复3 次。按照1.2.4 的方法确定内生细菌MY1 发酵的最佳pH、装液量、接种量、转速、发酵时间。
1.3 内生细菌MY1 抑菌物质稳定性测定
1.3.1 热稳定性测定 分别将10 mL 制备的MY1发酵滤液放置于温度为20、40、60、80、100、121 ℃水浴中处理30 min;静置冷却至室温,后采用1.2.4所述方法测定其抑菌率。
1.3.2 酸碱稳定性测定 用1 mol/L HCl 和1 mol/L NaOH 溶液,分别调整10 mL 制备的MY1 发酵滤液pH 值为1.0、3.0、5.0、7.0、9.0、11.0、13.0,室温下静置3 h,后调整pH 值为7.0,采用1.2.4 所述方法测定其抑菌率。
1.3.3 紫外辐射稳定性测定 分别取10 mL 制备的MY1 发酵滤液置于7 个灭菌培养皿,而后分别置于18 W 紫外灯(254 nm)下10 cm 处照射2、4、6、8、10、12 h,以未经照射处理的发酵滤液作为对照,采用1.2.4 所述方法测定其抑菌率。
1.3.4 光稳定性测定 分别取10 mL 制备的MY1菌株发酵滤液,置于6 个灭菌培养皿中,分别在光照下照射6、12、24、36、48 h,以未经照射处理的发酵滤液作为对照,采用1.2.4 所述方法测定其抑菌率。
1.3.5 贮存稳定性测定 分别将10 mL 制备的MY1 发酵滤液黑暗条件下贮存在室温和4 ℃冰箱中;在贮存的第7、15、30、60 天时取样,采用1.2.4所述方法测定其抑菌率。同时以制备好的新鲜发酵滤液作为对照。
1.4 数据处理
利用Microsoft Excel 2003 进行试验数据平均值和标准差分析并绘制图表;采用SPSS Statistics 17.0 软件进行Duncan's 新复极差法检验数据差异显著性(P<0.05)。
2 结果与分析
2.1 内生细菌MY1 发酵条件优化
2.1.1 菌株MY1 的生长曲线 在发酵培养过程中,MY1 菌株在0~12 h 生长缓慢;在12~32 h 生长迅速;在32~56 h 处于生长稳定期,生长变化没有明显波动,基本持平;在56 h 时,菌体生长量达到最大值,56 h 后出现缓慢衰退现象(图1)。

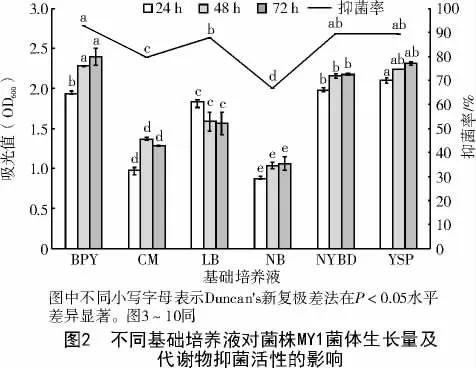
2.1.2 菌株MY1 基础培养基的筛选 菌株MY1在不同基础培养基中生长情况明显不同;在培养72 h后,菌株MY1 生长量从小到大依次为NB 培养基(1.060)<CM培养基(1.286)<LB 培养基(1.561)<NYBD 培养基(2.178)<YSP 培养基(2.312)<BPY培养基(2.397),OD600值在BPY 培养基中最大,在NB 培养基中最小,且BPY 培养基除与YSP 培养基无显著差异外,与其他各培养基均有显著差异(P<0.05)。
由图2 可知,所用基础培养基不同,菌株MY1发酵滤液对Pyricularia grisea 的抑制率也明显不同;培养72 h 后,菌株MY1 发酵滤液的抑菌率从小到大依次为NB 培养基(66.60%)<CM 培养基(79.65%)<LB 培养基(87.74%)<YSP 培养基(89.36%)<NYBD 培养基(89.41%)<BPY 培养基(92.68%),发酵滤液的抑菌率在BPY 培养基中最高,在NB 培养基中最低,且在BPY 培养基中显著高于CM 培养基、LB 培养基和NB 培养基(P<0.05)。因此,菌株MY1 的最佳基础培养基为BPY培养基。
2.1.3 菌株MY1 最佳碳源的筛选 由图3 可知,MY1 菌株在不同碳源培养基中的生长情况出现明显差异;培养72 h 后,不同培养基中MY1 的生长量从小到大依次为可溶性淀粉(1.597)<蔗糖(2.352)<葡萄糖(2.448)<甘露醇(2.510)<麦芽糖(2.527)<乳糖(2.531)<果糖(2.607),OD600值(菌体生长量)在以果糖为碳源的培养基中最大,以乳糖为碳源的培养基中次之,以可溶性淀粉为碳源的培养基中最小,且以果糖为碳源的菌体生长量显著高于其他碳源(P<0.05),而以可溶性淀粉为碳源的菌体生长量显著低于其他(P<0.05)。

在不同碳源的培养基中,MY1 发酵滤液对P.grisea 的抑制率也出现明显差异;培养72 h 后,抑菌率从小到大依次为麦芽糖(93.96%)<蔗糖(94.90%)<葡萄糖(95.75%)<果糖(97.34%)<乳糖(100%)=甘露醇(100%)=可溶性淀粉(100%)(图3),发酵滤液的抑菌率在以乳糖、甘露醇、可溶性淀粉为碳源的培养基中最大,且以乳糖、甘露醇、可溶性淀粉为碳源的发酵滤液的抑菌率著显著高于其他碳源(P<0.05)。因此,菌株MY1 的最优碳源为乳糖。
2.1.4 菌株MY1 最佳氮源的筛选 MY1 菌株在不同氮源培养液中的生长情况出现明显差异(图4);培养72 h 后,不同培养基中MY1 的生长量从小到大依次为尿素(0.024)<蛋白胨(0.405)<牛肉膏和胰蛋白胨混配(2.369)<牛肉膏和蛋白胨混配(2.384)<胰蛋白胨和酵母粉混配(2.466)<蛋白胨和酵母粉混配(2.534)<牛肉膏、酵母粉和蛋白胨混配(2.612)<牛肉膏和酵母粉混配(2.619),相比其他几种混配,OD600值在以牛肉膏和酵母粉混配为氮源的培养基中最大,在以尿素为氮源的培养基中最小,且菌体生长量在以牛肉膏和酵母粉混配为氮源时显著高于其他氮源(P<0.05),在以尿素为氮源时显著低于其他氮源(P<0.05)。

在不同氮源的培养液中,菌株MY1 发酵滤液对Pyricularia grisea 的抑制率也出现明显差异(图4);培养72 h 后,不同培养基中MY1 发酵滤液的抑菌率从小到大依次为尿素(4.22%)<蛋白胨(68.73%)<牛肉膏和胰蛋白胨混配(91.50%)<蛋白胨和酵母粉混配(93.59%)<牛肉膏和蛋白胨混配(99.79%)<牛肉膏、酵母粉混配(100%)=胰蛋白胨和酵母粉混配(100%)=牛肉膏、酵母粉和蛋白胨混配(100%),相比其他几种混配方式,发酵滤液的抑菌率在以牛肉膏、酵母粉混配,胰蛋白胨和酵母粉混配,牛肉膏、酵母粉和蛋白胨混配为氮源的培养液中最高,在以尿素为氮源的培养液中最小。因此,菌株MY1 的最优氮源为牛肉膏和酵母粉混配,且以牛肉膏和酵母粉混配、牛肉膏和蛋白胨混配、胰蛋白胨和酵母粉混配以及牛肉膏、酵母粉和蛋白胨混配为氮源的发酵滤液的抑菌率均显著高于其他氮源(P<0.05),在以尿素为氮源的发酵滤液的抑菌率显著低于其他氮源(P<0.05)。
2.1.5 菌株MY1 最佳发酵温度的筛选 从图5 可以看出,MY1 菌株在不同温度条件下生长量差异显著,随着时间的延长生长量整体呈增加状态;培养72 h 后,不同培养液中MY1 的生长量从小到大依次为30 ℃(2.659)<25 ℃(2.689)<35 ℃(2.724)<28 ℃(2.779),在28 ℃发酵的培养液中的菌体生长量(OD600)最大,且菌体生长量在温度为28 ℃时显著高于其他温度(P<0.05)。
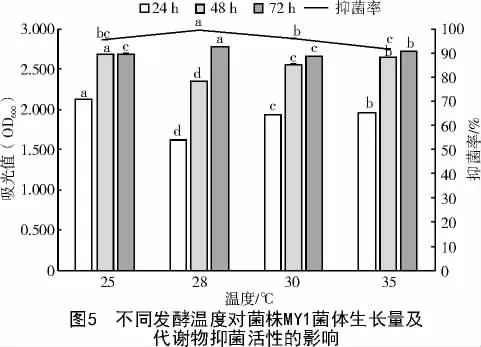
不同温度条件下培养的MY1 发酵滤液对Pyricularia grisea 的抑制率差异显著(图5),其中,28 ℃抑菌率最高,35 ℃抑菌率最低;培养72 h 后,菌株MY1 的抑菌率从小到大依次为35 ℃(91.76%)<25 ℃(95.44%)<30 ℃(95.83%)<28 ℃(99.50%),且发酵滤液的抑菌率在温度为28 ℃时显著高于其他温度条件(P<0.05)。综合判断,菌株MY1 的最佳发酵温度为28 ℃。
2.1.6 菌株MY1 发酵条件的优化 不同试验条件组合对MY1 菌株生长量影响的结果表明(表2),第5 组的OD600值最高,即第5 组的菌体生长量最好。根据极差分析可得,5 个设计因素中,pH(A)对MY1 生长量影响程度最大,接种量(C)的影响程度最小(表3)。因此,选择的最佳组合为A4B1C4D3E4,即pH 值9.0,装液量100 mL/500 mL,接种量5%,转速160 r/min,发酵时间96 h。

表2 MY1 菌株发酵条件优化正交试验分析(OD600)
正交试验中,不同试验条件组合对菌株MY1发酵滤液抑菌活性物质影响的结果表明,抑菌效果最好的试验组合是第5、9、11、14 组(表3)。根据极差分析可得,5 个设计因素中,pH(A)对菌株MY1发酵滤液对Pyricularia grisea 抑菌活性影响程度最大,装液量(B)最小。因此,选择的最佳组合为A4B1C2D2E2,即pH 9.0,装液量100 mL/500 mL,接种量2%,转速130 r/min,发酵时间48 h(表3)。

表3 MY1 菌株发酵条件优化正交试验分析(抑菌率)
综合成本和方差分析结果可知,最优的发酵条件为pH 值9.0,装液量100 mL/500 mL,接种量2%,转速160 r/min,发酵时间96 h。
2.2 内生细菌MY1 代谢物稳定性测定
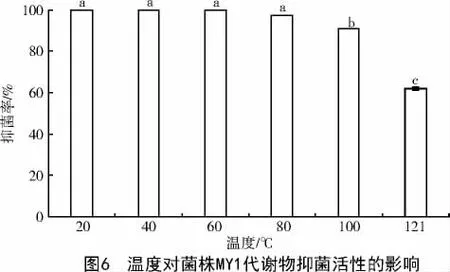
2.2.1 热稳定性测定 在20~60 ℃温度范围内处理30 min 后,菌株MY1 发酵滤液对Pyricularia grisea的抑菌活性趋于稳定;但当温度上升到60 ℃后,开始出现抑菌活性降低的现象;当温度处在80 ℃和100 ℃时,抑菌活性虽降低但较稳定,且发酵滤液的抑菌率在20~80 ℃时显著高于其他(P<0.05),当温度达到100、121 ℃时,虽出现明显差异但抑菌率仍较高。因此,说明菌株MY1 抑菌活性物质的热稳定性良好(图6)。
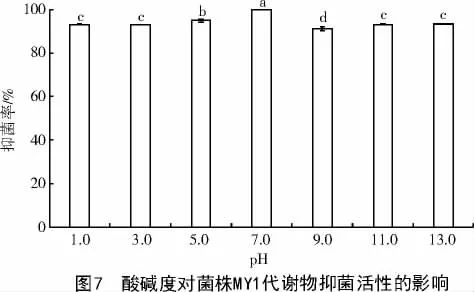
2.2.2 酸碱稳定性测定 从图7 可以看出,菌株MY1 发酵滤液的最佳抑菌活性是在中性(pH 值7.0)条件下,当发生酸碱性变化时,菌株MY1 的抑菌活性虽下降但仍然保持在90%,发酵滤液的抑菌率在pH 值为7.0 时显著高于其他(P<0.05)。因此,说明菌株MY1 抑菌活性物质具有较好的pH 稳定性。
2.2.3 紫外辐射稳定性测定 紫外灯照射延长到10 h 后,菌株MY1 发酵滤液对Pyricularia grisea 的抑制率与最佳抑菌率相比虽然有所降低,但差异不显著(P>0.05)(图8)。因此,证明菌株MY1 抑菌活性物质在紫外灯照射下稳定性较强,并无分解或改变。

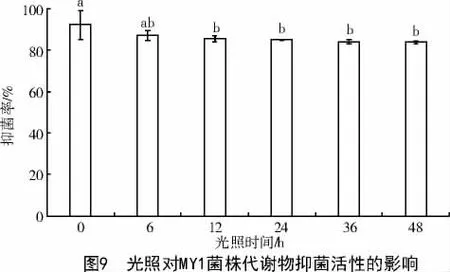
2.2.4 光稳定性测定 当自然光照射时间连续增加,菌株MY1 发酵滤液对Pyricularia grisea 的抑制活性虽然降低但维持稳定;在连续照射48 h 后抑制率仍处于较高水平,且与6 h 差异不显著(P>0.05)(图9)。因此,证明菌株MY1 在自然光照射下,抑菌活性物质稳定,并无分解或改变。
2.2.5 贮存稳定性测定 由图10 可知,在室温条件下,发酵滤液有较好的贮存稳定性,不同贮藏时间间差异不显著;在4 ℃冷藏条件下,随着贮存时间开始增加,菌株MY1 发酵滤液对Pyricularia grisea的抑菌活性逐渐降低,且60 d 与7d 间差异显著(P<0.05)。贮存时间为60 d 时,冷藏条件对Pyricularia grisea 的抑菌率虽降低,但抑菌率值仍较高,超过80%以上,与15 d 间差异不显著。因此,证明菌株MY1 抑菌活性物质稳定性强,可耐长期贮存。
3 结论与讨论
利用生防菌株代谢产生的抑菌活性物质防治植物病害,是生物防治中常用的方法。本试验通过设置MY1 菌株的不同发酵条件,结果筛选出BPY培养基是最佳基础培养基,乳糖是最优碳源,酵母粉和牛肉膏是最优氮源。菌株MY1 最适培养温度为28 ℃,发酵滤液菌体生长量在56 h 达到最高。选择pH、装液量、接种量、转速、发酵时间5 个因素对发酵条件进一步优化后,明确最佳发酵条件是转速160 r/min、发酵时间96 h、接种量2%、装液量100 mL/500 mL、pH 值9.0。
关于甲基营养型芽孢杆菌的报道,尹向田等[26]从水稻根系土壤中筛选出甲基营养型芽孢杆菌GSBM05,对发酵条件进行优化后,其最适发酵培养基为:2.0%可溶性淀粉,2.0%豆粕,3.0%酵母粉,0.3% NaCl,3% CaCO3,最佳发酵条件:培养温度30 ℃、转速150 r/min、装液量90 mL/250 mL、培养时间72 h、初始pH 值7.0。詹艺舒等[27]从空气中分离出抑菌效果良好的甲基营养型芽孢杆菌Z21,经对其发酵条件进行优化后,确定的最佳发酵培养基配方为:葡萄糖20.0 g/L,硝酸钠20.0 g/L,硫酸镁6 g/L,最适发酵条件:发酵温度35 ℃,发酵时间48 h。菌株来源不同或宿主所处的生存环境不同,都可能会造成最适发酵条件不同,其根本原因仍需今后深入探讨。对于发酵条件的优化和改进以及通过发酵罐放大试验来验证发酵参数和发酵条件等[28],正在进一步研究中。
在不同温度、pH、紫外线照射、自然光照射、室温和冷藏贮存处理后,菌株MY1 抑菌活性物质仍可保持良好的抑菌活性,说明MY1 产生的抑菌活性物质理化性质稳定。目前,甲基营养型芽孢杆菌代谢产物多样,主要有抗菌蛋白、抗菌肽、纤维素酶、β-1,3- 葡聚糖酶、嗜铁素等,但菌株MY1 抑菌成分还需进一步验证[20]。本研究通过对菌株MY1 发酵条件进行优化并对其抑菌物质的稳定性进行研究,结果有利于增加菌株MY1 抗菌活性物质的产量,可为下一步活性物质的分离提取和结构鉴定以及生防菌剂的制备提供理论依据,为微生物农药的开发和田间推广应用奠定基础。

