DNA-PK抑制剂联合溶瘤病毒增强对肝癌的抗肿瘤活性研究①
吴育民 杜端明 刘春霖 洪跃飞 江磊 昌罗伟 芝彭尧 JOHN Bell
(深圳市第二人民医院介入治疗科,深圳518000)
肝细胞癌(hepatocellular carcinoma,HCC)是男 性癌症相关死亡的第二大原因,每年在全球范围内夺走超过70万人的生命[1-2]。虽然手术切除、肝移植和消融治疗可以治愈早期疾病,但通常晚期疾病的最终和主要治疗方法是系统性药物治疗[3]。传统化疗在晚期肝癌患者中的应答率很低。索拉非尼已被公认为HCC患者的标准系统治疗方法,然而,肿瘤应答率并不令人满意[4]。因此,迫切需要新的策略来提高肝癌的治疗反应。
溶瘤病毒(oncolytic virus,OV)是一种自我扩增的癌症生物疗法,可以在不损害正常组织的情况下摧毁恶性肿瘤[5]。OV疗法是治疗肝癌的一种潜在的有吸引力的策略[6]。水泡性口炎病毒(vesicular stomatitis virus,VSV),在外周实体瘤模型中取得了强大的抗肿瘤效果,之前的研究已经产生了新型VSV突变体VSVΔ51,以努力提高VSV在OV治疗中的安全性[7-8]。这种病毒在VSV M蛋白的第51位有1个氨基酸缺失,通过阻止病毒阻断宿主细胞转录和核质运输,包括干扰素(IFN)的产生,巩固其治疗指数[9]。感染VSVΔ51后,IFN途径完整的非恶性细胞得到保护,而失去IFN反应能力的恶性细胞被裂解[10]。
尽管一些口服OV治疗癌症的临床前研究仍得到极大关注,但在临床试验中,OV的治疗效果达不到基于临床前模型的疗效预期[11]。因此,通过一些药物与OV联合或许可能是优化其肿瘤细胞杀伤的有效策略。在本研究中,筛选了多种通过不同机制抑制肿瘤生长的小分子药物与VSVΔ51进行联合,观察此组合对肿瘤的抑制活性。研究发现具有DNA-PK抑制能力的M3814可以显著提高VSVΔ51的溶瘤活性,并表明这种增效作用是通过增强肿瘤细胞的内质网应激实现的。实验结果表明,DNAPK抑制剂M3814联合VSVΔ51或许可以为肝癌的治疗提供一种新的思路。
1 材料与方法
1.1 材料
1.1.1 细胞系人肝癌细胞Huh-7及Vero细胞获取于美国模式菌种保藏库(ATCC)。均培养在添加10%FBS的DMEM培养基中,在37℃、5%CO2条件下生长。
1.1.2 主要试剂MTT及二甲基亚砜购自美国Sigma公司,组织裂解液购自美国Thermo Scientific公司,GAPDH购自上海优宁维生物科技有限公司,anti-p-JNK购自CST公司,anti-E1及anti-caspase 12购自Abcam公 司,anti-DNA-PKcs购自R&D公 司。LipofectamineTM2000转染试剂盒购自美国Thermo Scientific公司。特异性siRNA和对照siRNA均购自苏州金唯智生物科技有限公司。
1.2 方法
1.2.1 病毒的获取及滴度确定VSVΔ51是先前描述的印第安纳VSV血清型的重组衍生物。该病毒由JOHN Bell博士和DAVID Stojdl博士(渥太华健康研究所)提供。VSVΔ51在Vero细胞中增殖,并且通过Vero细胞上的标准空斑分析方法定量病毒滴度[12]。
1.2.2 RNA沉默Huh-7细胞汇合度达到80%时进行转染。采用LipofectamineTM2000转染试剂盒,分别将对照siRNA,特异性siRNA转染至Huh-7细胞,转染6 h后更换为含DMEM完全培养基继续培养48 h后进行后续实验。
1.2.3 靶细胞存活实验Huh-7细胞接种在96孔板中,5 000个/孔细胞,加入100 μl培养基。按照MOI值为0.01 PFU/个加入VSVΔ51,同时分别加入不同浓度的4种抗肿瘤机制不同的小分子化合物,DNA-PK抑制剂M3814,EGFR酪氨酸激酶抑制剂OSI-420,PI3K通路抑制剂ZSTK474以及c-Met抑制剂SGX523处理后,向细胞中加入MTT(终浓度1 mg/ml),在37℃继续培养4 h。去除含MTT的培养基,将MTT沉淀物溶解于100 μl DMSO中。使用酶标仪在570 nm处测定吸光度。细胞存活率=[OD570(实验组)/OD570(对照组)]×100%。
1.2.4 Western blot实验将各组肿瘤组织放在含有蛋白酶抑制剂的RIPA缓冲液中匀浆,提取蛋白并进行BCA定量。通过12%SDS-PAGE分离蛋白。电泳结束后,进行转膜,之后在5%脱脂奶粉溶液中封闭,并在4℃下与一抗(1∶1 500)孵育过夜。用TBST室温下洗涤3次后,将PVDF膜与HRP山羊抗兔或抗小鼠二抗(1∶20 000)在室温下孵育1.5 h。室温下TBST洗涤3次后进行曝光。使用Image J对条带的强度进行量化。GAPDH作为同型对照。
1.2.5 电 镜 实 验用M3814或/和VSVΔ51(0.001 PFU/个)处理Huh-7细胞24 h。室温下1 000 r/min离心5 min后收集细胞。然后将细胞颗粒重悬,用PBS洗涤1次,在1 500 r/min下离心5 min,并在含有2.5%戊二醛和2%多聚甲醛的0.1mol/L磷酸盐缓冲液(pH7.4)中冰上固定4 h。然后将样品进行标准透射电子显微镜超微结构分析。
1.2.6 体内实验本研究由深圳市第二人民医院动物伦理与福利委员会批准。对于皮下异种移植模型,将Huh-7(6×106个/只)细胞接种于4周龄雌性BALB/c-nu/nu小鼠的后侧皮下。6 d后,可触及的肿瘤形成后(50 mm3),小鼠随机分为4组。在6~8 d和12~14 d将VSVΔ51溶瘤病毒[2.5×107PFU/(kg·d)]尾静脉注射,M3814[2 mg/(kg·d)]腹腔注射共6次。每3 d测量肿瘤长度和宽度,按公式计算体积。体积=长×宽2/2实验结束后,剖出肿瘤组织拍照称重。
1.3 统计学分析所有实验数据采用SPSS19.0进行统计学处理。计量数据采用±s表示,组间样本比较采用t检验。P<0.05表示差异有统计学意义。
2 结果
2.1 不同的小分子抑制剂与VSVΔ51联合对肿瘤细胞生长的抑制加入4种小分子抑制剂M3814、OSI-420、ZSTK474、SGX523。选 择 极 低 剂 量 的VSVΔ51 OV(0.01 PFU/个),确保单独的OV对肿瘤细胞的毒性很小。不同药物与VSVΔ51的组合与Huh-7共孵育后检测细胞存活。结果表明,随着小分子药物剂量的提升,M3814与VSVΔ51的组合与M3814单药比较对肿瘤细胞的杀伤能力显著提高,而VSVΔ51与其他药物的组合较单药并无明显的增效作用。结果表明M3814可以协同增强VSVΔ51的肿瘤杀伤能力。见图1。
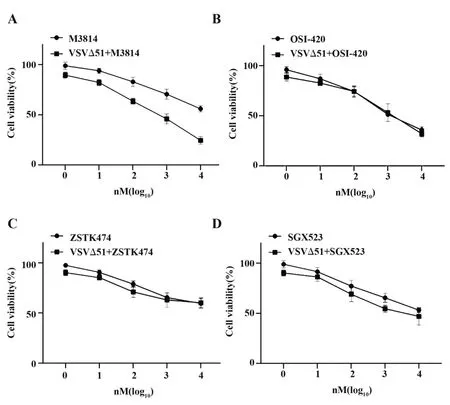
图1 VSVΔ51与抗肿瘤药物联合对靶细胞的细胞毒性Fig.1 Cytotoxicity of VSVΔ51 combined with anti-tumor drugs to target cells
2.2 敲低DNA-PK对溶瘤病毒抗肿瘤能力的影响实验表明DNA-PK抑制剂可以增强溶瘤病毒的肿瘤抑制能力,接下来探索了敲低Hun-7的DNAPK对溶瘤细胞抗肿瘤活性的影响。结果表明,设计的两种siRNA都能有效降低DNA-PKcs的表达。细胞存活实验表明,敲低DNA-PKcs可以有效增强VSVΔ51对肿瘤细胞的杀伤活性。见图2。这些结果表明,抑制DNA-PK的确可以增强VSVΔ51对肝癌细胞的杀伤活性。
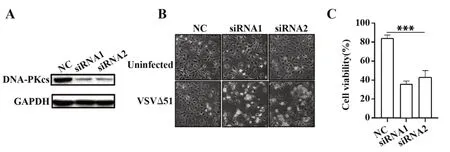
图2 VSVΔ51对siRNA转染细胞的细胞毒作用Fig.2 Cytotoxicity of VSVΔ51 to siRNA transfected cells
2.3 M3814联合VSVΔ51增强肿瘤细胞内质网应激OV裂解肿瘤细胞的一个主要机制是通过内质网应激诱导的细胞凋亡。因此检测了M3814是否通过该途径增强抗肿瘤活性。将M3814与VSVΔ51单独或联合与Huh-7共孵育,通过电镜观察内质网肿胀程度来反映内质网应激状态。结果表明,M3814与VSVΔ51联 合 给 药 组 较M3814单 用 或VSVΔ51单用而言,内质网的肿胀程度都显著增强。结果表明,M3814与VSVΔ51联合给药可以显著增强Huh-7细胞的内质网应激状态。见图3。
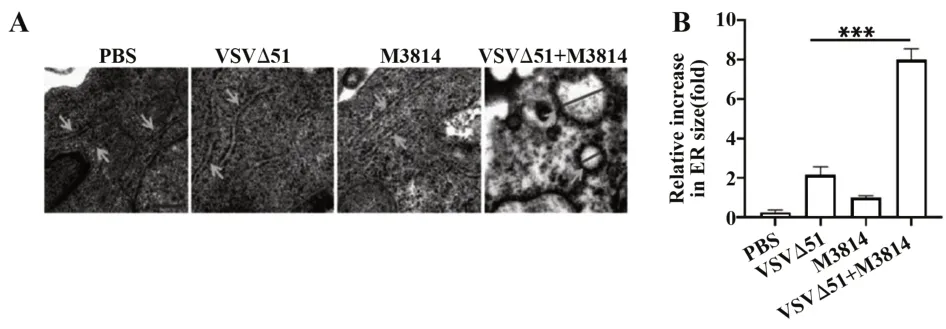
图3 DNA-PK抑制增强内质网应激Fig.3 DNA-PK inhibition enhances ER stress
2.4 M3814联合VSVΔ51增强肿瘤抑制活性建立裸鼠皮下移植瘤模型来验证M3814联合VSVΔ51的体内抗肿瘤活性。通过检测治疗后肿瘤体积的变化,结果表明,M3814联合VSVΔ51治疗组可以显著抑制肿瘤的生长,而M3814或VSVΔ51单独给药组肿瘤抑制能力明显弱于联合治疗组。实验结束后观察肿瘤大小及称量瘤重,结果表明,联合治疗组的肿瘤质量明显低于单独给药组。以上实验说明,M3814联合VSVΔ51可以抑制体内肿瘤的生长。见图4。
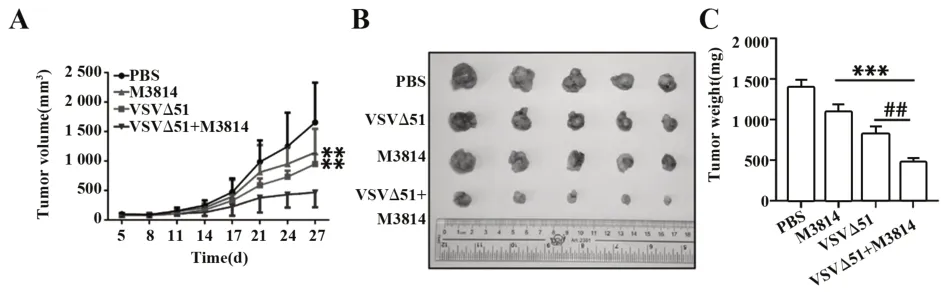
图4 体内抗肿瘤作用Fig.4 Anti-tumor effects in vivo
2.5 M3814联合VSVΔ51增强肿瘤细胞凋亡收集治疗后的肿瘤组织,进行Western blot分析,结果表明,VSVΔ51治疗组中病毒蛋白E1含量明显升高,说明VSVΔ51可以在肿瘤部位聚集。此外,较其他组别而言,p-JNK及c-caspase 12蛋白表达水平在联合治疗组中表达量显著提高,说明肿瘤细胞的凋亡增加。结果说明,M3814联合VSVΔ51可以有效增强肿瘤细胞凋亡,从而更好地发挥VSVΔ51的抗肿瘤功能。见图5。
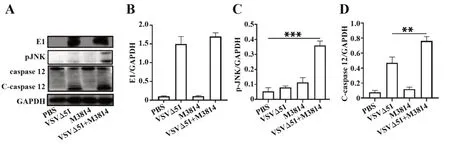
图5 肿瘤组织中凋亡相关蛋白的Western blot分析Fig.5 Western blot analysis of apoptosis-related proteins in tumor tissues
3 讨论
OV作为一种新型抗癌药物近年来发展迅速[13]。最著名的例子是美国食品和药品监督管理局(FDA)批准的用于治疗黑色素瘤的OV T-VEC[14]。然而,OV作为单一药物在患者中的治疗效果是有限的,因此有必要开发新的方案来最大限度地发挥OV治疗的潜力[15]。
VSVΔ51因其在肿瘤细胞中特异性复制、良好的体内稳定性和良好的人体安全性而成为一个极具吸引力的OV候选物。寻找与VSVΔ51协同作用的小分子可能是优化其肿瘤细胞杀伤的有效策略[16-17]。在这项研究中,通过基于不同信号通路的抗癌药物的筛选,发现DNA-PK抑制剂可以与VSVΔ 51发挥协同作用。通过抑制肿瘤细胞中DNA-PK的表达,发现肿瘤细胞对VSVΔ51的杀伤效果更加敏感,同时还探究了这种协同增效作用是因为DNAPK抑制剂加剧了VSVΔ51诱导的内质网应激,从而增强了肿瘤细胞的凋亡。体内实验中也证明这种联合疗法具有更强的肿瘤抑制能力。
靶向DNA-PK作为治疗人类恶性肿瘤的干预手段,特别是增强肿瘤细胞对化疗或放疗的敏感性,具有 临 床意义[18-20]。CC-122是 一 种DNA-PK抑制剂,处于Ⅰ期临床试验(NCT01421524),用于实体瘤、非霍奇金淋巴瘤和多发性骨髓瘤。CC-115是一种DNA-PK和mTOR的双重抑制剂,目前正处于治疗晚期实体瘤和血液恶性肿瘤的Ⅰ期试验(NCT-01353625)。目前正在进行结合放射治疗,DNA-PK抑制剂MSC2490484A治疗晚期实体肿瘤或慢性淋巴细胞白血病的Ⅰ期临床试验(NCT02516813和NCT02316197)。DNA-PK抑制剂VX-984联合化疗(NCT02644278)的安全性、耐受性和药代动力学/药效学研究已经完成。临床相关的DNA-PK抑制剂可能为OV的联合治疗提供很好的机会。
总体而言,研究表明,DNA-PK抑制剂与OV VSVΔ51联合治疗肝癌可以显著提高治疗效果,非常有希望在今后的临床上为肝癌的治疗提供新的方案。

