FGF-19联合IFABP对儿童重型创伤性脑损伤合并胃肠功能障碍的诊断价值
魏中南,孙 宁,马 骁,张庆江
(天津市儿童医院 天津大学儿童医院 神经外科,天津300074)
创伤性脑损伤(TBI)在儿童意外伤害中发生频繁,是儿童创伤意外所致死亡的主要因素[1]。急性胃肠功能损伤(AGI)是重型TBI后常见并发症,易引起肠道菌群异位,促进多器官功能衰竭的发生发展,加重病情,增加病死率[2]。因此,尽早发现、干预AGI对于改善重型TBI患儿预后有着重要意义。AGI症状及体征包括腹胀便秘、恶心呕吐、肠鸣音异常、胃残留量增多和胃黏膜损伤等。欧洲重症监护医学会(ESICM)于2012年发布了AGI分级标准,但其判断易受主观因素的影响[3],使得其临床应用受限。因此,寻找早期AGI诊断生物标志物至关重要。肠脂肪酸结合蛋白(IFABP)是一种肠黏膜损伤的早期敏感指标,已被发现与脓毒症、肺炎等患者胃肠功能障碍紧密关联[4-5]。成纤维细胞生长因子19(FGF-19)作为FGFs家族的重要成员,在胆汁酸合成过程中有着重要调节作用。研究发现,FGF-19与代谢性疾病密切相关,且可作为评价克罗恩病患者回肠功能的敏感指标[6]。目前,儿童重型TBI合并AGI尚缺乏有效早期诊断标志物。本研究通过观察重型TBI患儿血清IFABP、FGF-19水平,探讨血清IFABP、FGF-19水平与胃肠功能障碍的关系,供临床诊断参考。
1 对象与方法
1.1 研究对象
收集2018年1月-2020年12月入住天津市儿童医院神经外科重症病房(NICU)的重型TBI患儿56例为研究对象,按有无胃肠功能障碍分为TBI合并胃肠功能障碍组与TBI未合并胃肠功能障碍组。纳入标准:(1)有明确颅脑外伤史,并经影像学检查(CT、X线等)确诊为颅脑损伤;(2)年龄1个月-14岁;(3)格拉斯哥昏迷评分法(GCS)≤8分;(4)入住NICU>72 h。排除标准:(1)有消化系统基础疾病者;(2)有免疫缺陷疾病史者;(3)肿瘤患儿;(4)有长期抗生素、激素使用史者。TBI相关胃肠功能障碍参照2012年ESICM公布的AGI分级定义[3]。本研究符合《赫尔辛基宣言》伦理标准,所有患儿监护人均签署知情同意书。
1.2 血样采集
入NICU时,采集患儿外周静脉血,离心(3 000 r/min,10 min)分离血清,置于-80℃环境下备用。血清IFABP、FGF-19检测均采用酶联免疫吸附法进行,试剂盒分别为美国R&D公司、杭州联科生物技术股份有限公司产品。
1.3 观察指标
收集患儿一般情况,包括性别、年龄、CT检查结果、GCS评分。实验室指标:①血常规指标:包括白细胞计数(WBC)、C反应蛋白(CRP)、降钙素原(PCT);②反映器官功能的指标:包括总胆红素(TBIL)、白蛋白(ALB)、血尿素氮(BUN)、血肌酐(Scr)等;③凝血功能:活化部分凝血活酶时间(APTT)、纤维蛋白原(Fib)等。所有指标均于入住NICU 24 h内收集完成。结局指标为NICU病死率。
1.4 统计学方法

2 结果
2.1 一般情况
56例重型TBI患儿,中位年龄4岁,其中<1岁10例(17.86%),1-3岁16例(28.57%),3-14岁30例(53.57%);男32例(57.14%),女24例(42.86%);病死率为23.21%(13/56)。按有无胃肠功能障碍分为TBI合并胃肠功能障碍组(n=22)与TBI未合并胃肠功能障碍组(n=34)。两组年龄、性别、CT检查结果、GCS评分、入院时间均无统计学差异(P>0.05);此外,TBI合并胃肠功能障碍组病死率为27.27%,相比TBI未合并胃肠功能障碍组(20.59%)呈增高趋势,但差异无统计学意义(P>0.05)。见表1。
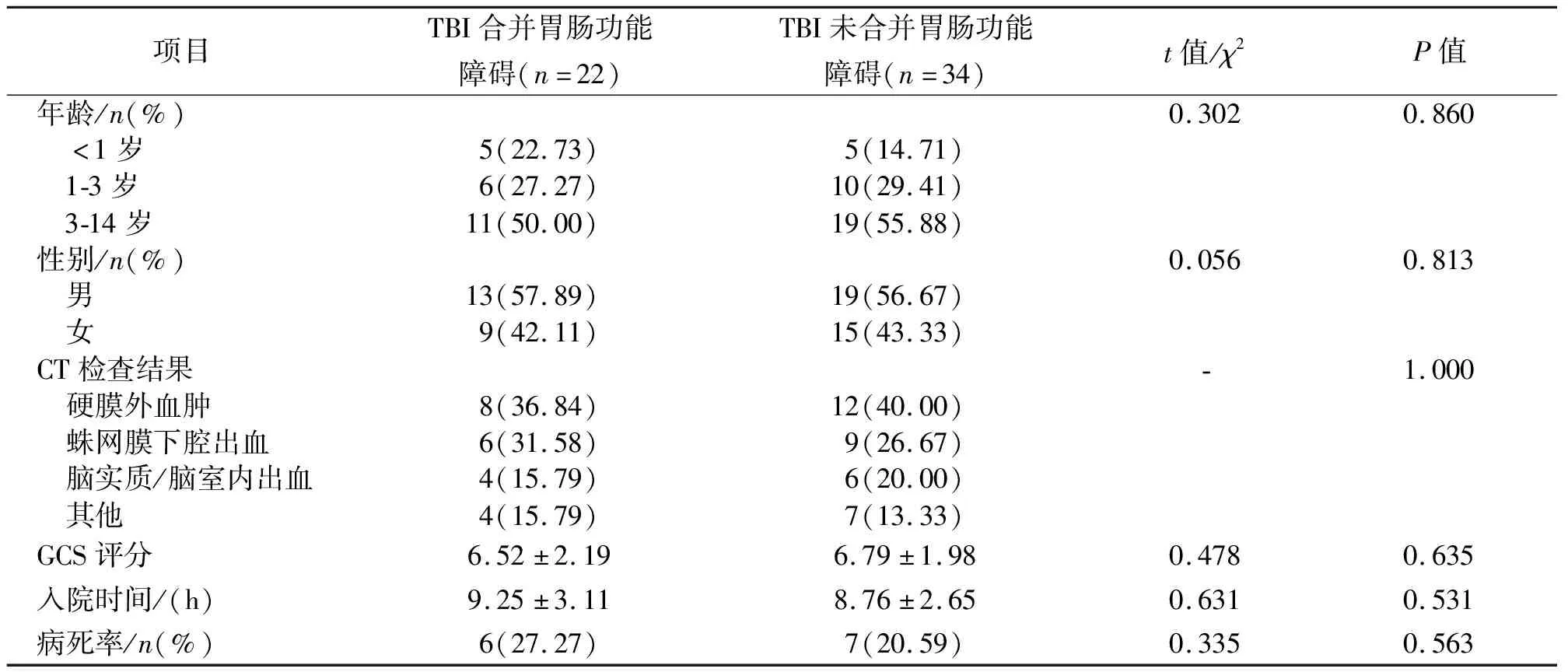
表1 TBI患儿一般情况
2.2 血清实验室指标与重型TBI合并胃肠功能障碍的关系
TBI合并胃肠功能障碍组入NICU时血清IFABP显著高于TBI未合并胃肠功能障碍组(P<0.05),FGF-19显著低于TBI未合并胃肠功能障碍组(P<0.05);此外,TBI合并胃肠功能障碍组ALB水平低于TBI未合并胃肠功能障碍组,差异有统计学意义(P<0.05)。两组其他实验室指标比较差异无统计学意义(P>0.05)。见表2。

表2 重型TBI患儿合并胃肠功能障碍与未合并胃肠功能障碍组实验室指标比较
2.3 Logistic回归分析
多因素Logistic回归分析显示,IFABP与重型TBI患儿并发胃肠功能障碍的OR值为1.129,95%CI为1.007-1.265;FGF-19与重型TBI患儿并发胃肠功能障碍的OR值为0.937,95%CI为0.887-0.990;因此,高IFABP水平及低FGF-19水平是儿童重型TBI合并胃肠功能障碍的独立危险因素。见表3。

表3 重型TBI患儿合并胃肠功能障碍的Logistic回归分析
2.4 血清IFABP、FGF-19预测重型TBI患儿合并胃肠功能障碍的ROC曲线
ROC曲线显示,IFABP预测儿童重型TBI合并胃肠功能障碍的曲线下面积为0.878(95%CI 0.763-0.950),FGF-19对应的曲线下面积为0.851(95%CI 0.730-0.932),两者效能比较差异无统计学意义(Z=0.353,P=0.724);二者联合的曲线下面积为0.975(95%CI 0.892-0.998),均高于单一IFABP或FGF-19,差异有统计学意义(Z=2.098、2.728,P=0.036、0.006)。见表4。

表4 血清IFABP、FGF-19及其联合对重型TBI患儿合并胃肠功能障碍的诊断效能
3 讨论
本研究探讨IFABP、FGF-19对于儿童TBI合并胃肠功能障碍的早期诊断价值。通过对56例重型TBI患儿入NICU时的血清IFABP、FGF-19与入住NICU期间有无胃肠功能障碍的相关性分析发现,血清IFABP、FGF-19均可作为预测儿童TBI合并胃肠功能障碍的敏感指标,其阈值分别为442.51 pg/ml和59.61 μg/ml。
研究表明[7],重症监护病房患者50%以上会出现≥1种胃肠道症状。本研究中,TBI患儿胃肠功能障碍发生率为39.29%(22/56)。胃肠功能障碍发生与危重症患者不良预后存在关联,会增加病死率[8-9]。本研究中,TBI合并胃肠功能障碍组病死率为27.27%,相比TBI未合并胃肠功能障碍组(20.59%)呈增高趋势。早期识别儿童重型TBI合并胃肠功能障碍并及时干预对改善预后至关重要,但目前尚缺乏有效的早期诊断标志物。
IFABP是一种低相对分子质量的蛋白物质,仅存于小肠黏膜微绒毛顶端,组织特异性强。当机体遭受创伤,引起胃黏膜受损时,黏膜通透性增加,IFABP会释放入血,使得血清IFABP表达增高,因此可作为早期反映胃肠功能损伤的敏感标志物[10-11]。研究发现[12],IFABP对胃肠缺血非常敏感,对于肠缺血性损害有着重要的诊断意义。Ademuyiwa等[13]研究表明,IFABP可区分肠坏死,血清IFABP水平随着肠坏死严重程度的增高而增高。范晓蕾等[14]研究显示,肺炎患儿血清IFABP表达水平随着AGI分级提高而增高,与危重评分呈现负相关关系。上述研究均提示血清IFABP对于危重症患者病情及胃肠功能损伤有诊断价值。本研究显示,IFABP与TBI患儿合并胃肠功能障碍显著相关,可作为儿童重型TBI合并胃肠功能障碍的早期诊断标志物,这与葛唱等[15]报道一致。
FGF-19是一种具有类激素作用的细胞因子,主要由远端小肠分泌,不仅能够调节糖代谢,还在胆汁酸合成过程中有着重要调节作用[16-17]。FGF-19不仅与代谢性疾病密切相关,且可作为评价克罗恩病患者回肠功能的敏感指标[18]。TBI早期肠上皮细胞出现损伤会对肠源性因子的分泌产生影响,这些因子的监测有助于早期识别胃肠功能障碍。FGF-19作为一种肠道分泌的蛋白物质,检测其表达可能对肠道病变有提示作用。本研究显示,TBI合并胃肠功能障碍组入NICU时的FGF-19水平显著低于TBI未合并胃肠功能障碍组,并且多因素Logistic回归分析显示,低FGF-19水平是儿童重型TBI合并胃肠功能障碍的危险因素,这充分表明FGF-19水平与儿童重型TBI合并胃肠功能障碍具有相关性;此外,血清FGF-19早期诊断儿童TBI合并胃肠功能障碍的ROC曲线下面积为0.851,截断值为61.76 μg/ml时,其敏感度为90.9%,特异度为73.5%。由此认为,血清FGF-19对儿童重型TBI合并胃肠功能障碍具有预测价值,可作为早期诊断标志物,其在胃肠功能障碍中的评估意义值得深入研究。
联合多项生物标志物,能够有效弥补单项标志物所存在的不足,从而提高诊断效能。本研究还显示,IFABP联合FGF-19诊断儿童重型TBI合并胃肠功能障碍的曲线下面积为0.975,均高于单一IFABP或FGF-19,表明二者联合检测可提高诊断效能。本研究存在不足,首先,样本量较小,所得结果难免存在统计偏差,有待通过大样本人群中进行验证;其次,未能对TBI合并胃肠功能障碍患儿的胃肠功能损伤程度进一步作亚组分析。尽管存在上述局限,但IFABP、FGF-19与TBI合并胃肠功能障碍之间的关系,为胃肠功能损伤的诊断研究提供了新的视角。
综上所述,高IFABP水平及低FGF-19水平是儿童重型TBI合并胃肠功能障碍的独立危险因素,血清IFABP、FGF-19均可作为预测重型TBI患儿合并胃肠功能障碍的新型生物标志物,且二者联合使用能够提高诊断效能。

