环介导等温扩增技术检测呼吸道病毒方法的建立及应用
池细俤,高世华,张忠源,叶桂云
(福建医科大学附属南平第一医院 检验科,福建 南平353000)
环介导等温扩增(LAMP)是近年兴起并逐步应用于临床的一种新颖的核酸检测技术,它已被成功应用于各种病原体[1]、寄生虫[2]、肿瘤基因[3]、农业水产等领域的快速检测。本文通过建立乙型流感病毒(FluB)、腺病毒(ADV)、呼吸道合胞病毒(RSV)的LAMP检测方法,并比较分析LAMP技术与直接免疫荧光技术(DFA)在检测急性呼吸道感染(ARTI)病毒时的诊断结果的一致性,以探索LAMP技术在ARTI病毒实验室诊断的应用价值。
1 资料与方法
1.1 一般资料
2019年3月-12月期间,收集福建医科大学附属南平第一医院门诊及住院具ARTI症状的患者鼻咽拭子共74份,患者:男性40例、女性34例;年龄1月-20岁。鼻咽拭子置-20℃冰箱保存。
1.2 仪器与试剂
1.2.1仪器 BX 53荧光显微镜(奥林巴斯公司);恒温扩增仪(上海星耀医学科技发展有限公司)。
1.2.2试剂 鼻咽拭子(Copan Flock Technologies S.R.L公司);呼吸道病毒DFA检测试剂(Diagnostic Hybrids.INC公司);LAMP相关试剂:LAMP引物(上海百力格生物技术有限公司);INNOGENX多引物恒温扩增缓冲液(上海创稷医疗科技有限公司);dNTPs(上海宏谊生物技术有限公司);逆转录酶(上海创稷医疗科技有限公司);Bst酶(上海创稷医疗科技有限公司);阴性质控品、阳性质控品(上海复星长征医学科学有限公司);核酸提取及纯化试剂(上海复星长征医学科学有限公司)。
LAMP引物设计:在Genebank上检索A、B、C型腺病毒;A、B亚型呼吸道合胞病毒;V、Y系乙型流感病毒的碱基序列,用MEGA5进行序列比对分析,分别获得不同病毒特异性保守序列,利用在线引物设计软件Primer Explorer V5,设计了LAMP反应所需的引物(包括内引物、外引物和环状引物各2个,每个病毒共6个引物),见表1。

表1 LAMP引物组序列
1.3 方法对74份鼻咽拭子样本分别进行DFA抗原检测和LAMP核酸检测。
1.3.1样本采集 将鼻咽拭子缓缓插入患者鼻咽管,至鼻咽部,旋转3-5周后,取出拭子放入装有无菌生理盐水的采集管中送检,不能及时送检者需放4℃冰箱但不宜超过24 h。
1.3.2DFA抗原检测 细胞片制备、DFA抗原检测、结果判断等操作严格按Diagnostic Hybrids.INC公司试剂盒说明书。
1.3.3LAMP核酸检测 ①核酸提取及纯化:鼻咽拭子复融后进行振荡混匀,离心后按说明书取40 μl混悬液加入10 μl核酸提取及纯化试剂,置金属浴煮沸裂解10 min,取出冷却离心备用,上清液即为待检模板。②LAMP反应体系配制:(1)引物+酶混合液:外引物3 μmol/L、内引物10 μmol/L、环状引物5 μmol/L、逆转录酶5 U/μL、Bst酶5 U/μL、UNG酶0.03 U/μL。(2)LAMP缓冲液:dNTPs 2 mmol/L、5×buffer。(3)每个反应体系总体积20 μl:引物+酶混合液2 μl、LAMP缓冲液13 μl、模板5 μl。③恒温扩增仪实验参数设置:实验时间45 min、实验温度63℃、熔解曲线“√”、终止温度64℃、温度步增0.3℃。④结果判读:观察扩增曲线并记录起峰点的Tt值,当有典型扩增曲线且Tt值≤20 min为阳性;无扩增曲线或Tt值>20 min为阴性。⑤质量控制:每个检测批次都包括阴性对照、阳性对照,质控品出现假阳性或假阴性则舍去本批实验结果,并进行复检。
1.4 统计学处理
两种方法检测结果比较采用McNemar检验(配对χ2检验),P<0.05为差异有统计学意义;方法学一致性检验采用Kappa检验(Kappa≥0.75两者一致性较好;0.75>Kappa≥0.4两者一致性一般;Kappa<0.4两者一致性较差。)
2 结果
2.1 乙型流感病毒检测结果比较
对74份标本进行乙型流感病毒感染标志物检测,两种检测方法共同测定阳性13例、共同测定阴性53例,见表2。检测荧光扩增曲线见图1。结果显示LAMP相对DFA的灵敏度(阳性符合率)为92.86%(13/14),特异度(阴性符合率)为88.33%(53/60),整体符合率为89.19%(66/74);用SPSS统计软件对结果进行分析,两种检测方法针对乙型流感病毒的诊断结果一致性一般(Kappa=0.697,P<0.001);LAMP法检出率为27.03%,高于DFA法(18.92%),但经McNemar检验差别无统计学意义(P=0.070>0.05)。
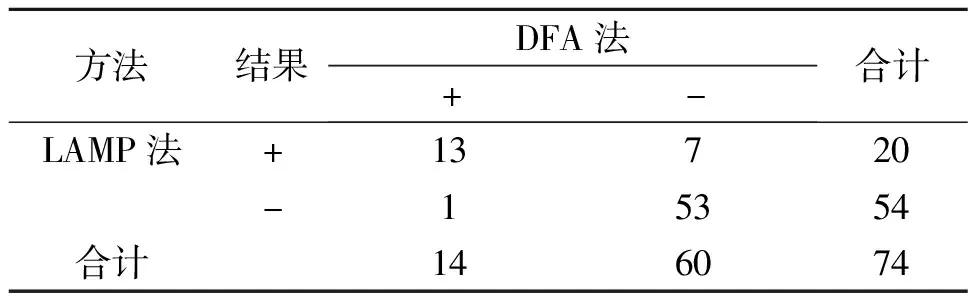
表2 乙型流感病毒LAMP和DFA的检测结果对比(n)
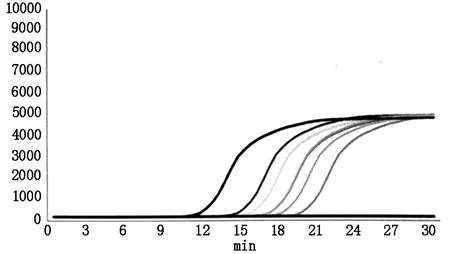
图1 乙型流感病毒LAMP检测荧光扩增曲线
2.2 腺病毒检测结果比较
对74份标本进行腺病毒感染标志物检测,两种检测方法共同测定阳性9例、共同测定阴性54例,见表3。LAMP相对DFA的灵敏度为52.95%(9/17),特异度为94.74%(54/57),整体符合率为85.14%(63/74);两种检测方法针对腺病毒的诊断结果一致性一般(Kappa=0.532,P<0.001);LAMP检出率为16.22%,低于DFA(22.97%),但经McNemar检验差别无统计学意义(P=0.227>0.05)。

表3 腺病毒LAMP和DFA的检测结果对比(n)
2.3 呼吸道合胞病毒检测结果比较
对74份标本进行呼吸道合胞病毒感染标志物检测,两种检测方法共同测定阳性4例、共同测定阴性68例,见表4。LAMP相对DFA的灵敏度为80.00%(4/5),特异度为98.55%(68/69),整体符合率为97.30%(72/74);两种检测方法针对呼吸道合胞病毒的诊断结果一致性较好(Kappa=0.786,P<0.001);LAMP检出率与DFA相同均为6.76%,经McNemar检验差别无统计学意义(P=1.000>0.05)。

表4 呼吸道合胞病毒LAMP和DFA的检测结果对比(n)
3 讨论
研究表明ARTI 近80%由病毒引起[4-5],至少涉及7个病毒科10多类共239个型别的病毒[6]。呼吸道病毒具有传染性强,传播速度快,潜伏期短等特点,且不同呼吸道病毒导致的临床症状相似,80%患者表现咳嗽症状,50%患者有发热症状[7],由于缺乏合适的病原学诊断,临床上对ARTI病人往往采取经验性治疗而非针对性治疗,结合今年我国成功控制COVID-19疫情的经验,及时准确的病原体检测不但可快速确诊ARTI患者,及时向其提供针对性治疗、避免滥用抗生素,而且对开展流行病学调查,控制病毒传播途径、对人群采用预防措施等均具有重要临床意义,因此研究快捷和准确的呼吸道病毒的检测方法已成为临床实验室的重要任务。
临床上针对呼吸道病毒病原的检测方法目前常用的有RT-PCR、DFA、间接免疫荧光、LAMP等[8]。上述方法中,RT-PCR、DFA和间接免疫荧光的检验质量易受实验条件、检验人员主观能力等影响。如RT-PCR对实验室条件及仪器设备配置要求较高,不利于基层医疗机构开展;间接免疫荧光可能受患者既往感染,体内的抗体未代谢完,出现假阳性率偏高[9],还可能因患者处在“窗口期”出现检测结果假阴性。DFA检测呼吸道上皮细胞内的病毒抗原,对标本来源、取材时机、采样质量要求较高[10],而且实验步骤较多、操作较复杂,在结果判断上存在一定主观性,但因其具有相对较高特异性和敏感性,目前仍是很多实验室呼吸道病毒检测的主流方法[11],因此本研究将其做为参考方法。LAMP技术具有灵敏度高、特异性强、操作简单、可根据Tt值客观判读结果等优势[8],还具有良好的仪器通用性,可在恒温扩增仪也可在荧光PCR仪上进行,临床应用前景较好。
LAMP 技术是Notomi等在2000年首先提出来的一种新的核酸扩增技术,其基本原理主要是根据靶基因3′和5′端的6个区域的序列设计4-6个特异性引物[12-13],在恒定温度条件下Bst DNA聚合酶对模板进行快速特异性扩增。本研究中LAMP 法检测呼吸道病毒的原理:通过逆转录酶将病毒RNA反转录成cDNA,而后在60-65℃恒定温度下,特异性引物与cDNA模板结合,在具有链置换功能的Bst DNA聚合酶作用下进行扩增,并最终形成双链DNA混合物;扩增产物与核酸染料结合后发出荧光信号,由仪器捕获荧光信号,并进行处理分析,形成扩增曲线;根据Tt值和扩增曲线形态判断检测结果。
本研究通过应用LAMP和DFA技术对74例疑似呼吸道感染患者咽拭子样本进行乙型流感病毒、呼吸道合胞病毒和腺病毒等3种呼吸道病毒的平行检测,结果显示LAMP相对DFA检测的灵敏度(阳性符合率)不低于52.95%,特异度(阴性符合率)不低于88.33%,整体符合率不低于85.14%,McNemar检验显示两者检出率差异无统计学意义(P>0.05),并经Kappa检验分析两种检测方法针对3种呼吸道病毒的诊断结果一致性较好(Kappa值分别为0.697、0.532、0.786)。相比于传统检测方法,LAMP是针对病原体靶基因的更为高特异性、高效的快速检测手段,在病原检测中具有更高的灵敏度[14]。但本实验检测腺病毒中LAMP的检出率略低于DFA,考虑与引物设计有关,可通过持续优化引物序列等实验条件予以改善。
LAMP检测周转时间(TAT)较短,其扩增过程耗时一般在20 min左右,较RT-PCR(120 min左右)短,而且针对不同靶基因的LAMP可设置相同的反应温度和实验参数,有利于采用基于微流控的芯片技术实现多通量的POCT检测[15]。但也存在一定不足,例如目前LAMP无法提供病原体定量检测结果,只能用于定性分析;每个恒温扩增检测均需要4-6条引物,且每条引物bp值较大,引物间可发生相互干扰,一般只能在1管中检测1种病原体,不能将多个靶基因引物简单混合,如果需要检测多病原体,则需要增加检测管数[16];LAMP扩增的终产物的浓度高,容易导致实验室污染,实验中应尽量实行闭管操作。
综上所述,针对呼吸道病毒的病原诊断LAMP与DFA具有较高的一致性,而LAMP因具有对实验条件要求较低、实验步骤少、操作简单、结果判读客观和TAT较短等优点。

