CD4+CD45RClowTreg在大鼠肝移植免疫耐受中的调节作用研究
周林 李瀚 赵阳 汪京 贾亚男 张欣雪 李先亮 郎韧 贺强
调节性T细胞(regulatory T cell,Treg)是一种具有负向免疫调节功能的细胞亚群,在移植术后免疫耐受的形成过程中发挥重要作用[1-2]。目前,大多数关于Treg的研究主要集中在经典的CD4+CD25+Treg亚群,但越来越多的证据表明CD8+Treg在维持机体免疫平衡以及诱导免疫耐受方面也扮演关键的角色[3-4]。首都医科大学附属北京朝阳医院肝胆胰脾外科团队通过长期研究,证实CD8+CD45RClowTreg是促使肝移植免疫耐受发生的关键细胞亚群[5-8]。在研究过程中我们发现以CD45RC为分类标准的CD4+T细胞的亚群即CD4+T细胞受体(T cell receptor,TCR)αβ+CD45RClowT细胞(CD4+CD45RClowTreg)在不同肝移植模型中表达差异显著,且与Treg、浆细胞样树突状细胞(plasmacytoid dendritic cell,pDC)的表达具有相关性。关于CD4+CD45RClowTreg研究早在20世纪90年代就开始,但是研究一直处于落后状态,且多数研究集中于心脏移植与肾移植[9-11],关于肝移植方面的报道较少[12]。因而,本文旨在通过对肝移植免疫耐受与急性排斥反应(acute rejection,AR)大鼠中不同免疫细胞亚群的变化进行分析,结合组织病理学检测,探讨CD4+CD45RClowTreg作为免疫调节细胞的潜能及其在免疫耐受发生中的作用,为丰富Treg亚群网络奠定基础。
1 材料与方法
1.1 实验动物
雄性无特定病原体(specific pathogen free,SPF)级Brown Norway(BN)大鼠与Lewis大鼠各15只,体质量200~220 g,均购于北京维通利华实验动物技术有限公司,许可证:SCXK-(京)2016-0006。
1.2 实验试剂
荧光素标记的单克隆抗体异硫氰酸苯酯(phenylisothiocyanate,PITC)/brilliant violet(BV)-421-CD3、别藻蓝蛋白(allophycocyanin,APC)-CD4、异硫氰酸荧光素( fluorescein isothiocyanate,FITC)/藻红蛋白(phycoerythrin,PE)-CD8、多甲藻黄素-叶绿素-蛋白质复合物(peridinin-chlorophyll-protein complex,PerCP)-TCR-αβ、PE-CD45RC、PE-CD103、APC-主要组织相容性复合体(major histocompatibility complex,MHC) Ⅱ及同型对照抗体购自美国BD公司,Lysing buffer 购自美国Thermo 公司,FACS Canto Ⅱ流式细胞仪购自美国BD公司,免疫组织化学(免疫组化)CD4、CD45RC与CD103单克隆抗体购自英国Abcam公司和美国CST公司,二抗试剂盒PV-9000购自美国OriGene公司,3,3'-二氨基联苯胺(3,3'-diaminobenzidine,DAB)显色试剂盒购自北京中杉金桥公司。
1.3 模型构建与标本收集
根据文献报道,以BN大鼠为供体,Lewis大鼠为受体的肝移植可以自发产生免疫耐受;而以Lewis大鼠为供体,BN大鼠为受体肝移植会发生明显的AR[13]。本研究采用“双袖套法”建立BN→Lewis的大鼠肝移植耐受模型(耐受组,n=6)和Lewis→BN的大鼠肝移植AR模型(AR组,n=6),同时设置假手术组(对照组,n=6)作为对照,BN大鼠与Lewis大鼠各3只。术后7 d采集AR组大鼠外周血和组织标本,术后100 d采集耐受组大鼠外周血和组织标本,分别用于T细胞亚群分析和组织病理学分析。
1.4 检测指标及方法
1.4.1 肝组织病理学检测 提取各组大鼠的肝组织,甲醛固定、脱水、包埋,切片后进行苏木素-伊红(hematoxylin-eosin,HE)染色,光学显微镜下观察组织细胞形态并收集图像。
1.4.2 大鼠外周血T细胞亚群和pDC分析 分别取100 μL外周血检测T细胞亚群(加入5 μL PITC/BV-421-CD3、APC-CD4、FITC/PE-CD8)、CD4+Treg与 CD8+Treg(加入 5 μ L APC-CD4、FITC/PE-CD8、Percp-TCR-αβ、PE-CD45RC)、pDC(加入 5 μ L PE-CD103、APC-MHC Ⅱ),加入相应的抗体后充分混匀,室温暗室孵育15 min,加入1×Lysing继续孵育15 min,加入磷酸盐缓冲液(phosphate buffer saline,PBS),180×g离心6 min,弃上清,采用流式细胞仪进行检测。
1.4.3 移植肝和脾脏T细胞亚群和pDC分析 将脾脏与肝脏组织分别充分研磨,以200目筛网过滤,以Ficoll法4 ℃、180×g离心35 min,提取单个核细胞,加入PBS吹打混匀,180×g离心6 min,弃上清,加入PBS,分别取100 μL检测CD4+Treg、CD8+Treg、pDC,抗体染色同外周血,孵育结束后,加入PBS,180×g离心6 min,弃上清,采用流式细胞仪进行检测。
1.4.4 pDC与CD4+CD45RClowTreg相关性分析 在上述流式检测结果的基础上,采用Pearson检验对外周血、移植肝及脾脏中pDC与CD4+CD45RClowTreg的表达进行整体分析。
1.4.5 移植肝和脾脏CD4、CD45RC、CD103表达情况 移植肝组织、脾脏组织石蜡切片后常规二甲苯脱蜡、水洗;3%过氧化氢灭活后抗原修复;自然冷却后5%羊血清封闭30 min;一抗4 ℃湿盒孵育过夜;相应二抗室温孵育30 min;DAB显色,显微镜下观察并采集图像,阳性细胞核或细胞质染色呈棕褐色。
1.5 统计学方法
采用SPSS 19.0软件进行统计学分析。计量资料以均数±标准差表示,组间比较采用t检验或单因素方差分析,组间两两比较采用LSD-t检验;相关性分析采用Pearson检验。P<0.05为差异有统计学意义。
2 结 果
2.1 各组大鼠移植肝组织病理学检查结果
以BN为供体,Lewis为受体的耐受组大鼠70%~80%可以产生耐受,存活时间超过100 d,以Lewis为供体,BN为受体的AR组大鼠术后产生明显的AR,存活时间7~14 d,病理学主要表现为移植肝炎症细胞浸润和组织结构紊乱(图1)。

图1 各组大鼠肝组织病理学染色结果(HE,×200)Figure 1 Pathological staining results of liver tissues of rats in each group
2.2 各组大鼠外周血T细胞亚群表达情况
各组大鼠外周血T细胞亚群的流式细胞图见图2。与对照组大鼠比较,耐受组和AR组大鼠CD4+T细胞亚群的表达水平均升高(41.7±1.9比65.6±7.7、82.0±3.5,均为P<0.05);与对照组比较,AR组大鼠CD8+T细胞亚群的表达水平下降(21.2±1.8比 14.2±1.3,P<0.05)。AR组大鼠CD4+/CD8+T细胞比值较对照组大鼠升高(5.4±0.9比2.0±0.2,P<0.05),耐受组大鼠与对照组大鼠比较,差异无统计学意义(P>0.05)。与AR组大鼠比较,耐受组大鼠的CD4+CD25+Treg、CD8+Treg表达水平均升高(均为P<0.05),且CD4+CD25+Treg与CD8+Treg表达水平呈正相关(r=0.742,P=0.022)。
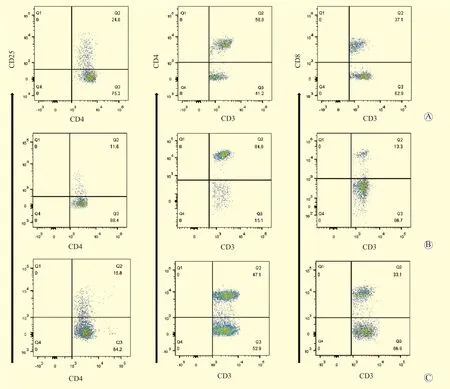
图2 各组大鼠外周血T细胞亚群的流式细胞图Figure 2 Flow cytometry of T cell subsets in peripheral blood of rats in each group
2.3 各组大鼠外周血、移植肝、脾脏CD4+CD45RClow Treg和CD8+CD45RClowTreg表达情况
AR组大鼠外周血CD4+CD45RChighT细胞水平高于耐受组大鼠和对照组大鼠(44.6±15.6比21.0±9.0、16.8±1.2,均为P<0.05);耐受组大鼠与对照组大鼠比较,差异无统计学意义(P>0.05)。
与对照组大鼠比较,AR组与耐受组大鼠移植肝、脾脏CD4+CD45RClowTreg表达水平均升高(均为P<0.05);与AR组大鼠比较,耐受组大鼠脾脏CD4+CD45RClowTreg表达水平升高(P<0.05,图3A)。与对照组大鼠比较,耐受组外周血CD8+CD45RClowTreg表达水平升高(P<0.05);与AR组大鼠比较,耐受组大鼠外周血、移植肝、脾脏CD8+CD45RClowTreg表达水平均升高(均为P<0.05,图3B)。
与对照组大鼠比较,耐受组大鼠外周血CD4+CD45RClowTreg/CD4+T比值变化差异无统计学意义(P>0.05),AR组大鼠外周血CD4+CD45RClowTreg/CD4+T比值下降(P<0.05);与AR组大鼠比较,耐受组外周血CD4+CD45RClowTreg/CD4+T比值升高(P<0.05,图3C)。与对照组和AR组大鼠比较,耐受组大鼠外周血CD8+CD45RClowTreg/CD8+T比值升高(均为P<0.05,图3C);AR组大鼠与对照组大鼠比较差异无统计学意义(P>0.05)。

图3 各组大鼠CD4+CD45RClowTreg、CD8+CD45RClowTreg分析结果Figure 3 Analysis results of CD4+CD45RClowTreg and CD8+CD45RClowTreg of rats in each group
2.4 各组大鼠外周血、移植肝、脾脏pDC的表达及其与CD4+CD45RClowTreg的相关性分析
与对照组和AR组大鼠比较,耐受组大鼠外周血、移植肝、脾脏中pDC的表达水平均升高(均为P<0.05,图4A~C,E);AR组大鼠与对照组大鼠比较,差异均无统计学意义(均为P>0.05)。对外周血、移植肝与脾脏中CD4+CD45RClowTreg与pDC的表达水平进行整体相关性分析结果显示,CD4+CD45RClowTreg与pDC表达水平的变化呈正相关(r=0.506,P=0.016,图4D)。
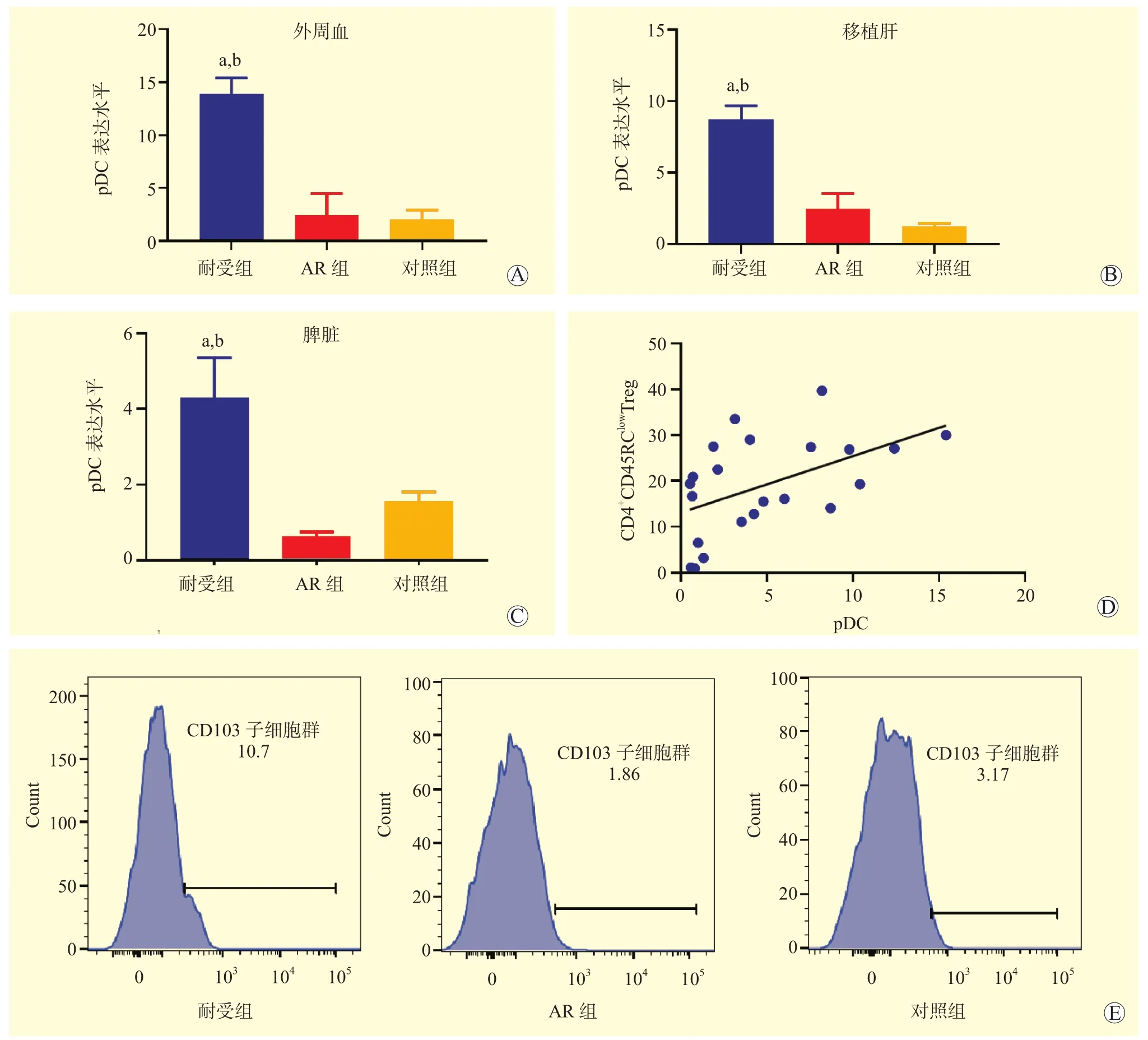
图4 各组大鼠pDC表达的差异性分析Figure 4 Differential analysis of pDC expression of rats in each group
2.5 大鼠移植肝和脾脏CD4、CD45RC、CD103的表达情况
耐受组大鼠移植肝和脾脏CD4、CD45RC、CD103的表达均增多,主要集中在汇管区与生发中心;而AR组大鼠移植肝CD4、CD45RC的表达虽增多,但肝组织结构紊乱、小叶结构消失,且CD103表达降低 ;AR组大鼠脾脏CD4、CD45RC、CD103表达均降低,且生发中心结构紊乱(图5)。
3 讨 论
Treg是一种具有负向免疫调节功能的细胞亚群,在器官移植术后免疫耐受的形成过程中发挥重要作用[2,14-15]。通过药物、细胞因子或者纳米修饰技术制备Treg过继回输是诱导免疫耐受发生的常用手段,研究主要集中在CD4+CD25+Treg。近年来,关于CD8+CD45RClowTreg的研究逐步被重视,其在移植免疫耐受中的调节作用有望成为突破免疫耐受诱导的新方向[5-6,16-17]。与CD4+CD25+Treg分类不同,依据CD45RC分子是否表达作为区分T细胞是否激活的标准,能精确筛选出负向调节效应的CD8+Treg,因为Foxp3缺失或表达阴性的T细胞亚群中能并不能排除CD8+Treg的存在[18]。
西班牙学者于1994年报道CD45RC低表达为T细胞分化和激活的表面标志物[19],随后不断有研究证实CD45RC可以作为区分大鼠CD8+Treg的表面标志物[20];我中心在大鼠同种异体原位肝移植、心脏免疫耐受诱导中证实,CD45RClowTreg显著升高,并聚集移植物局部[5-8]。因而,目前CD45RC-/low被认为是鉴定CD8+Treg的主要表面标志物。基于以上的理论和基础,我们设想按照CD8+Treg的划分标准,是否以CD45RC-/low区分的TCRαβ+CD4+T细胞同样具有Treg的调节作用?其变化趋势如何?有待进一步探讨。
关于CD4+CD45RClow/highT细胞的研究最早可以追溯到20世纪90年代[12],有研究认为CD4+CD45RClowTreg具有辅助性T细胞(helper T cell,Th)2的活性,可促进移植心脏存活,而CD4+CD45RChighT细胞产生的白细胞介素(interleukin,IL)-2与干扰素(interferon,IFN)-γ可诱导移植物抗宿主病(graft-versus-host disease,GVHD)[9]。本研究发现AR组大鼠CD4+CD45highT细胞的水平显著升高,与文献报道一致。在骨髓移植GVHD的研究中证实同种反应性CD4+T细胞中CD45RChighT细胞促进急、慢性GVHD的发生,而选择性回输CD45RClowTreg可以明显改善移植后免疫重建,无诱导GVHD的风险[10-11],过继回输供体特异性输血(donor-specific blood transfusion,DST)处理的CD45RClowT细胞可以延长移植肝的存活[12],这些均提示CD4+CD45RClowTreg具有负向免疫调节作用。然而过去20年间,关于CD4+CD45RClowTreg的研究进展依旧缓慢,相关文献报道少。新近研究认为,移植前CD4+CD45RChighT细胞和CD8+CD45RChighT细胞表达水平与肾移植术后AR相关[11,21],而关于CD4+CD45RClowTreg亚群在肝移植中的作用目前很少报道。
表达低水平CD45RC的T细胞优先分泌调节性细胞因子,并含有Treg亚群[22-23],目前已证实,CD8+T细胞高表达CD45RC与排斥反应有关,低表达与诱导免疫耐受有关[17]。本研究发现耐受组大鼠外周血CD8+Treg的水平显著升高,且与经典的CD4+CD25+Treg变化呈正相关。为了进一步明确CD45RClowCD4+T细胞亚群的情况,我们分析了CD4+/CD8+T细胞的表达情况,CD4+和CD8+T细胞在排斥反应中起关键作用,前者分泌Th1介导或诱导排斥反应发生,后者以攻击、破坏组织为主[19,24-25],结果发现,虽然耐受组大鼠CD4+和CD8+T细胞均升高,但CD4+/CD8+T细胞比值与正常大鼠一致,而AR组大鼠因为CD8+T细胞的显著减少,CD4+/CD8+T细胞比值升高。因此,我们认为维持T细胞亚群的平衡是保护移植物生存的关键,CD8+T细胞的减少,可从侧面反应CD8+Treg处于低表达状态。
我们分析发现,耐受组CD4+CD45RClowTreg/CD4+T比值高于AR组,与CD8+Treg的变化一致,提示CD4+CD45RClowTreg所占的比例高低是影响免疫耐受与排斥反应发生的关键,而非单纯的表达水平高低。我们进一步发现,CD4+CD45RClowTreg除与CD8+Treg的变化一致,同时与耐受组大鼠pDC的变化一致,相关性分析提示两者呈正相关,pDC是目前认为具有诱导耐受潜能的树突状细胞亚群,CD103是可以用来区分pDC的表面标记,其可以诱导Treg的分化与产生[26-27],CD4+CD45RClowTreg与pDC变化关系,还体现在免疫组化染色中CD4、CD45RC、CD103变化的一致性,提示其在肝移植免疫耐受的诱导中发挥重要作用。
综上所述,CD45RC区分的CD4+CD45RClowTreg与CD8+Treg类似,是一群具有负向免疫调节功能参与肝移植免疫耐受诱导的CD4+Treg亚群,该细胞与CD8+CD5RClowTreg及pDC等构成免疫耐受诱导的调节性细胞网络,共同发挥免疫负向调节作用。本研究仅是组织细胞水平的变化结果,关于CD4+CD45RClowTreg参与调节免疫耐受的分子机制以及其对效应性T细胞亚群尤其是CD4+T细胞增殖的抑制效应是我们下一步研究的方向和内容。

