含色氨酸系列抗菌肽对多药耐药粪肠球菌的抗菌作用
尚德静, 赵 蕾*, 王 野*, 姜凤全,2
(1.辽宁师范大学 生命科学学院,辽宁 大连 116081; 2.大连医科大学 附属第一医院 检验科,辽宁 大连 116011)
粪肠球菌(Enterococcusfaecalis)作为一种条件致病菌,容易形成保护性生物被膜,引起多种慢性感染,例如:感染性心内膜炎、尿路感染、伤口感染等,是引起医院内获得性感染的主要病原菌之一[1-2].随着抗生素的广泛使用,粪肠球菌对临床上常用的多种抗生素,如帕拉西林、四环素、左氧氟沙星、阿奇霉素等都产生了耐药性,粪肠球菌耐药性的产生给医学界带来了重大挑战[3].生物被膜主要由胞外蛋白、胞外DNA(eDNA)和胞外多糖(EPS)等组成,保护细菌免受洗涤剂、抗菌剂和环境压力的影响,使细菌对抗生素治疗的抗药性提高10~1 000倍.美国国立卫生研究院(National Institutes of Health)估计,多达80%的细菌感染与生物被膜有关,这极大地增加了发病率和死亡率[4-5].目前认为粪肠球菌生物被膜的形成受其群体感应系统(Quorum sensing,QS)的调控[6].QS是细菌间一种通信系统,即细菌通过可扩散的小分子信号感知细胞群体的密度,从而导致细菌群体中某些特定基因的协同表达[7-8].目前研究发现粪肠球菌QS中fsr毒力因子调节系统可通过调节明胶酶(gelE)等毒力因子的表达调节生物被膜的形成和发展[9].Fsr信号系统编码基因(fsrA、fsrB、fsrC和fsrD)位于gelE的上游,其中,fsrA、fsrB、fsrC与gelE的生成有直接关系.有研究人员将DNA片段整合到粪肠球菌V583的衍生突变体的fsr位点上,发现可以抑制gelE的活性,并阻止了生物被膜的形成[10-12].抗菌肽(Antimicrobial peptides, AMPs)是生物体先天免疫的主要成分之一,由10~50个氨基酸构成,具有分子量小、带3~5个正电荷、广谱抗菌等特点[13],多数阳离子抗菌肽在膜环境中能形成两亲性的α-螺旋结构[14-15].细菌细胞膜中含有带负电荷的磷脂,因此带正电荷的抗菌肽可以通过静电作用与带负电荷的细菌细胞膜结合,并通过其特有的两亲性α-螺旋结构插入膜的疏水区域,引起膜的脂质和蛋白质位置的变化,进而破坏了细胞膜的完整性和稳定性,内容物流出,造成细菌死亡[16-18].抗菌肽这种独特的靶向细菌膜系统的杀菌机制也使得细菌不易产生耐药性[19-20],使其最有希望成为取代抗生素的新型抗菌药物[21-22].本实验室前期从中国林蛙(Ranachensinensis)皮肤分泌物中分离纯化了天然抗菌肽Temporin-1CEb,并以此为模板,通过氨基酸替换、增加等方式,设计合成了抗菌肽LK-6.并在LK-6的基础上,将不同位置上的亮氨酸(Leu)和异亮氨酸(Ile)替换成色氨酸(Trp),合成了含色氨酸系列抗菌肽(Trp-containing antimicrobial peptides).Trp的疏水性较强,与其他抗菌肽相比,含Trp的抗菌肽更容易插入磷脂双分子层中,使含色氨酸系列抗菌肽的抗菌活性显著增强[23].本文旨在研究含色氨酸系列抗菌肽对多药耐药粪肠球菌(Multiple-drug resistantEnterococcusfaecalis, MREF)的抗菌活性,并从细菌内外膜系统、QS调控的生物被膜(Biofilm)和毒性因子等方面对抗菌肽的作用机制进行了研究,为研发新型抗菌药物提供理论依据.
1 材料和方法
1.1 材料
含色氨酸系列抗菌肽由宁波康贝生化有限公司(宁波,浙江)用标准多肽Fmoc固相合成法合成,多肽的纯度大于95%,经反相高效液相色谱(RT-HPLC)和MALDI-TOF质谱检测其分子量和纯度;多药耐药粪肠球菌MREF0321株是从临床样本中分离鉴定的菌株,由大连医科大学附属第一医院中心实验室提供;2.5%(体积分数)戊二醛、无水乙醇、PBS缓冲液、牛肉膏、蛋白胨和氯化钠等实验室常用试剂购于Aobox Biotechnology公司(北京);培养皿、滤膜、注射器、涂布棒、酒精灯、移液枪、96孔板等实验室常用材料购于上海玉博生物科技有限公司 (上海);cDNA反转录试剂盒和qPCR试剂盒购于宝生物工程有限公司(大连);NPN(N-phenyl-1-naphthylamine)购于Sigma公司(上海);DiSC3-5购于Solarbio公司(北京).
1.2 实验方法
1.2.1 最小抑菌浓度(MIC)测定
细菌37 ℃过夜培养至对数生长期,稀释到2×105CFU/mL.取50 μL菌悬液加入96孔板中,加入50 μL不同浓度的抗菌肽在37 ℃孵育18 h,用酶标仪测定OD600值.无菌水和LB液体培养基作为空白对照,菌悬液和无菌水作为阴性对照,抗菌肽和LB液体培养基作为阳性对照,根据公式计算细菌的存活率:
存活率(%)=OD600{(菌+肽)-(LB+肽)}/{(菌+水)-(LB+水)}×100%.
MIC定义为存活率<5%时的抗菌肽浓度.
1.2.2 杀菌动力学(Time-killcurve)
对数生长期细菌(1×105CFU/mL)中分别加入终浓度为1×MIC、4×MIC、8×MIC和16×MIC的抗菌肽,37 ℃震荡培养.分别在培养10、30、60、90、120、180和240 min时,取培养物离心(4 000 r/min)10 min.洗去药物,将样品稀释到适当的浓度后,取1 mL稀释液涂在LB琼脂培养基上,37 ℃过夜培养,次日记录平板上的细菌菌落数.菌悬液和无菌水作为对照.
1.2.3 扫描电子显微镜观察细菌形态
500 μL对数生长期细菌(1×105CFU/mL)中分别加入500 μL终浓度为1×MIC和2×MIC的抗菌肽,37 ℃震荡培养1 h后,用PBS缓冲液洗涤细菌培养物2次,再用2.5%(体积分数)戊二醛4 ℃固定12 h.固定后用30%、50%、70%、80%、90%和100%(体积分数)乙醇依次进行梯度脱水,每次15 min,自然干燥,喷金后,利用扫描电子显微镜观察.菌悬液和无菌水作为对照.
1.2.4 激光共聚焦显微镜观察细菌细胞膜完整性
对数生长期细菌(1×105CFU/mL)中分别加入终浓度为1×MIC、4×MIC的抗菌肽,37 ℃震荡培养1 h后,离心10 min,用PBS清洗3次,每次10 min,得到样品.将染料PI与SYTO9等比例混合,制成染色液.取1 mL染色液加入样品中,37 ℃避光染色0.5 h后离心,并用PBS清洗3次后,滴在载玻片上,用防淬灭液固定后,用透明指甲油封片,最后用激光共聚焦显微镜观察(SYTO9激发/发射波长为485/530 nm,PI激发/发射波长为485/630 nm).菌悬液和无菌水作为阴性对照,多黏菌素B(polyB)作为阳性对照.
1.2.5 Zeta电势检测细菌表面的膜电位
取对数生长期菌悬液离心(3 000 r/min)10 min,用PBS缓冲液将细菌进行重悬,并稀释到1×105CFU/mL备用.1 mL菌稀释液中分别加入10 μL不同浓度的抗菌肽,混匀,37 ℃培养5 min.取60 μL混合培养物用Zeta电位分析仪测定细菌表面膜电位.菌悬液和无菌水作为阴性对照,polyB作为阳性对照.
1.2.6 细菌外膜渗透性测定
取对数生长期菌悬液离心(3 000 r/min)10 min,用缓冲液(5 mM HEPES, 1 mM NaN3)清洗2次后重悬细菌,并稀释到1×105CFU/mL备用.染料NPN用甲醇配成浓度为10 μM的溶液.在96孔板中加入90 μL菌液和20 μL NPN溶液,混匀,加入10 μL不同浓度的抗菌肽,37 ℃培养1 h,用荧光酶标仪检测荧光强度的变化(激发波长350 nm,发射波长420 nm).菌悬液和无菌水作为阴性对照,polyB作为阳性对照.
1.2.7 细菌内膜去极化测定
取对数生长期菌悬液离心(3 000 r/min)10 min,用缓冲液A(5 mM HEPES,20 mM葡萄糖)清洗2次.用缓冲液B(5 mM HEPES,20 mM葡萄糖,100 mM KCl, pH=7.4)重悬细菌,并稀释到1×105CFU/mL备用.在96孔板中加入90 μL菌悬液和10 μL终浓度为4 μM的 DiSC3-5荧光染料,用荧光酶标仪检测荧光强度(激发波长622 nm, 发射波长670 nm),直到DiSC3-5达到最大吸收,分别加入终浓度为1×MIC、2×MIC、4×MIC的抗菌肽,用荧光酶标仪检测荧光强度(激发波长622 nm, 发射波长670 nm).菌悬液和无菌水作为阴性对照,polyB作为阳性对照.
1.2.8 细菌生物被膜形成的测定
取50 μL对数生长期菌悬液(2×105CFU/mL)加入96孔板中,加入50 μL不同浓度的抗菌肽,在37 ℃孵育24 h后,轻轻除去上清液,并用PBS清洗2次,加入甲醇作用15 min,用0.1% (质量分数)结晶紫染色5 min,用清水洗净,再在每个孔中加入100 μL 95%(体积分数)乙醇,振荡30 min后,用酶标仪测OD590.对照组是菌悬液和无菌水.
生物被膜生成量计算公式:
生物被膜生物量=OD590(加药)/OD590(对照).
MBIC50被定义为50%的生物被膜被抑制时的抗菌肽浓度,将浓度转换成log值作为X值,抑制率作为Y值,带入graphpad prism 软件计算.
1.2.9 细菌生物被膜分解的测定
取50 μL对数生长期菌悬液(2×105CFU/mL)加入96孔板中,加入50 μL LB培养基,37 ℃孵育24 h后,将上清液倒掉,分别加入50 μL不同浓度的抗菌肽,继续培养24 h,轻轻去掉上清液,用PBS洗后加入甲醇静置15 min,然后用0.1%(质量分数)结晶紫染色5 min,用清水洗净加入100 μL 95%(体积分数)乙醇,振荡培养30 min,用酶标仪测OD590.对照组是菌悬液和无菌水.
生物被膜生成量计算公式:
生物被膜生物量=OD590(加药)/OD590(对照).
MBRC50被定义为50%的生物被膜被分解时的抗菌肽浓度,将浓度转换成log值作为X值,分解率作为Y值,带入graphpad prism 软件计算.
1.2.10 细菌生物被膜组分EPS含量的测定
取50 μL对数生长期菌悬液(2×105CFU/mL)加入96孔板中,加入50 μL不同浓度的抗菌肽,37 ℃孵育24 h后离心(10 000 r/min)15 min,然后将沉淀重悬于高盐缓冲液,再次离心(10 000 r/min)30 min,取上清液与三体积的冷乙醇混合,4 ℃温育过夜后加入提前预冷的苯酚和H2SO4混合物中,用酶标仪测OD490.对照组是菌悬液和无菌水.
1.2.11 细菌生物被膜组分eDNA含量的测定
取50 μL对数生长期菌悬液(2×105CFU/mL)加入Ep管中,加入50 μL不同浓度的抗菌肽,37 ℃孵育24 h后通过孔径为0.22 μm的滤膜进行过滤去除细菌.取90 μL滤液加入96孔板中,用酶标仪测OD260.对照组是菌悬液和无菌水.
1.2.12 RT-qPCR检测明胶酶相关基因表达
取1 mL对数生长期菌悬液(1×105CFU/mL)加入Ep管中,分别加入终浓度为1/4×MIC、1/2×MIC的抗菌肽,37 ℃孵育24 h后离心(10 000 r/min)15 min,在沉淀中加入20 μL 10 mg/mL的溶菌酶,37 ℃水浴锅静置45 min后,提取细菌总RNA,并反转录成cDNA,进行RT-qPCR实验. RT-qPCR反应体系为20 μL,包括10 μL 2×SYBR Premix Ex TaqⅡ,0.8 μL正反向引物,2 μL样品,6.4 μL ddH2O.反应条件为:94 ℃预变性30 s,94 ℃5 s,55 ℃15 s,72 ℃10 s,循环40次,延伸30 s.对照组是菌悬液和无菌水.16SrRNA用作内参,基因定量通过内参基因归一化表示.RT-qPCR的结果用比较循环阈值(Cycle threshold,Ct)表示,Ct值计算公式:
ΔCt=Ct目的基因-Ct内参基因,
ΔΔCt=ΔCt-Ctcontrol,n=2-ΔΔCt.
引物16SrRNA、fsrA、fsrB、fsrC、gelE基因由上海生工生物工程公司合成,其序列如表1所示.
2012—2015年宝清县节水增粮行动旱田项目区由35个片区组成,总面积 15.10万亩 (15亩=1 hm2,下同),其中中心支轴式喷灌面积7.49万亩,绞盘式喷灌面积3.91万亩,滴灌面积3.70万亩。总用水量为849.46万m3/a,全部为地下水。项目区共新建水源机井558眼,根据项目区水文地质条件的差异,确定设计成井深度为60~80 m,单井设计出水量为30~80 m3/h,静水位埋深 4~32 m。 布井间距 300~400 m,井径 300 mm。

表1 引物序列
1.2.13 检测细菌明胶酶活性
取50 μL对数生长期菌悬液(2×105CFU/mL)加入Ep管中,加入50 μL不同浓度的抗菌肽,37 ℃孵育24 h后离心(10 000 r/min)15 min,上清即为测试样品.配置浓度为2%(体积分数)的偶氮骨胶原溶液,将上清液和偶氮骨胶原溶液加入96孔板中,37 ℃培养1 h后,用酶标仪测OD540.对照组是菌悬液和无菌水.明胶酶活性定义为在单位时间内分解偶氮骨胶原的量,计算公式:
U=ΔOD540/(0.01×t).
其中,U代表酶活力,ΔOD540代表反应时间内样品吸光度值变化量,t代表反应时间.
1.2.14 检测细菌自溶素活性
取50 μL对数生长期菌悬液(2×105CFU/mL)加入Ep管中,加入50 μL不同浓度的抗菌肽,37 ℃孵育24 h后离心(10 000 r/min)15 min,上清即为测试样品.配置肽聚糖底物,将上清液和肽聚糖底物加入96孔板中,37 ℃培养1 h后,用酶标仪测OD450.对照组是菌悬液和无菌水.自溶素活性定义为在单位时间内分解肽聚糖的量,计算公式:
U=ΔOD450/(0.01×t).
其中,U代表酶活力,ΔOD450代表反应时间内样品吸光度值变化量,t代表反应时间.
2 结果与分析
2.1 含色氨酸系列抗菌肽对MRFE0321具有高的抗菌活性
含色氨酸系列抗菌肽的相对分子质量、理化性质和抗菌活性如表2.从表中可以看出,5个抗菌肽(I1W、I4W、L5W、L11W和L12W)氨基酸组成相同,都含有1个Trp残基,但Trp分别位于氨基端的1、4、5、11和12位点,分子量相同,两亲性和疏水值相似.2个抗菌肽含有2个Trp残基,分子量相同,两亲性和疏水值相似.7种含色氨酸系列抗菌肽对MREF0321均有较强的抗菌活性,MIC值为1.56~6.25 μM.
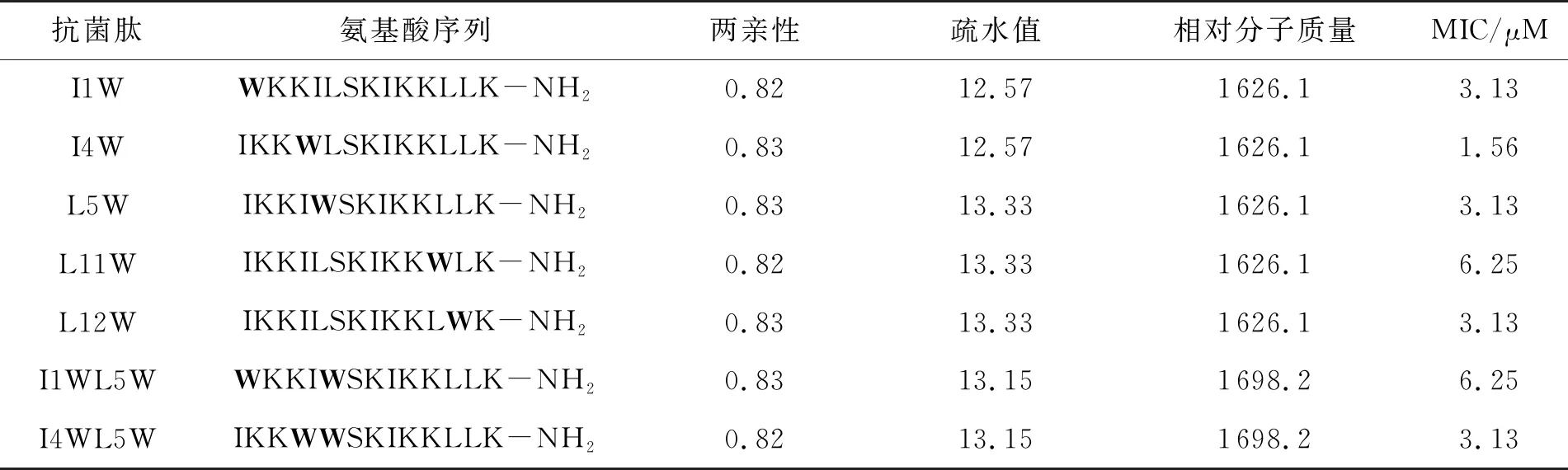
表2 含色氨酸系列抗菌肽的生物学性质和抗菌活性
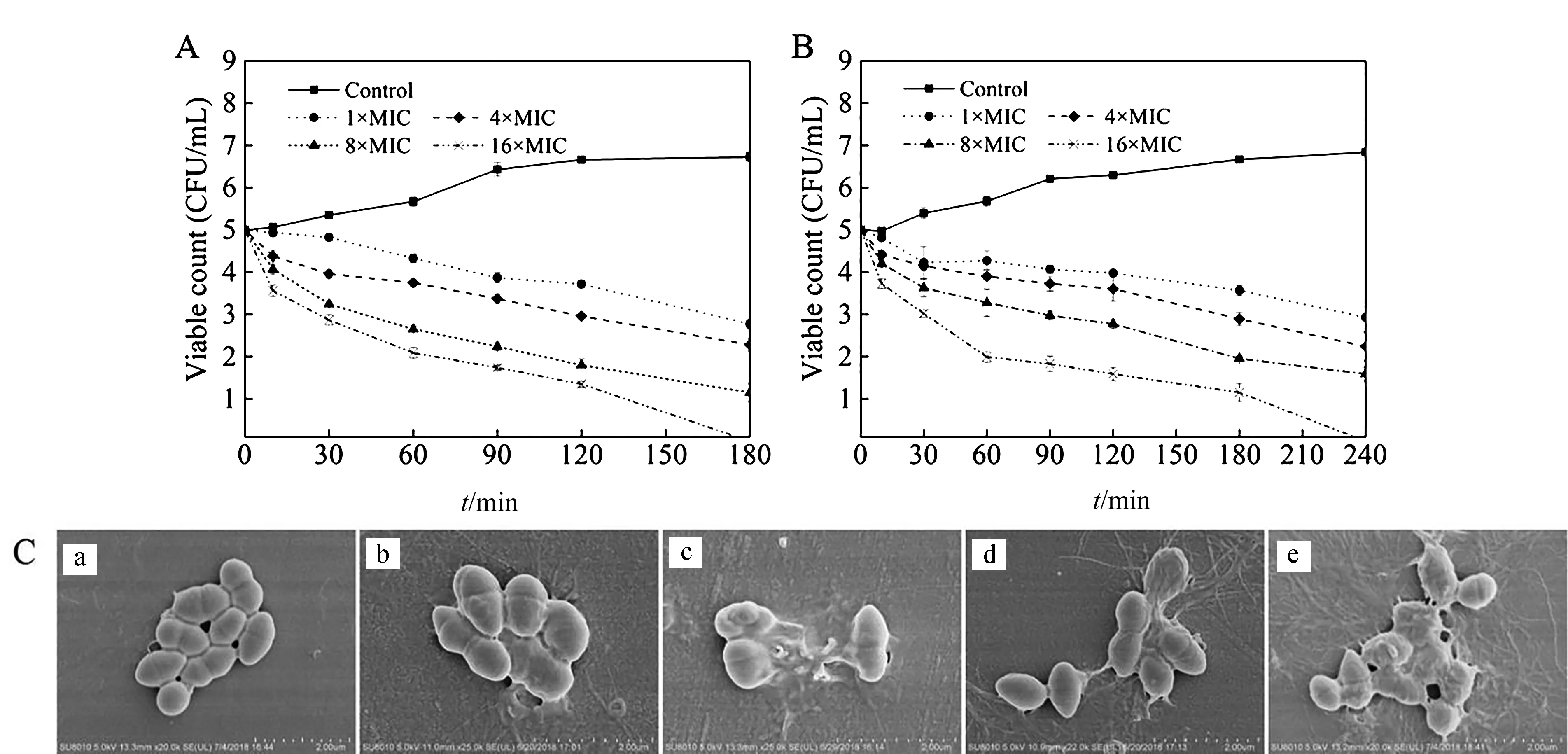
图1 含色氨酸系列抗菌肽对MREF0321的杀菌活性
2.2 含色氨酸系列抗菌肽I4W和L5W对MREF0321外膜和内膜的影响
SYTO9与PI是检测细胞膜完整性的两种染料:SYTO9能够进入具有完整细胞膜的细菌内,将细菌染成绿色;而PI无法通过完整的细胞膜,只有当细胞膜被破坏时,才能够进入细菌细胞内,与细胞核DNA结合呈红色荧光.因此,可以通过细菌中红色或绿色荧光强度的比例判断细菌细胞膜的破坏程度.结果如图2所示,对照组是未处理的正常MREF0321细胞,均呈绿色荧光.加入I4W或L5W后红色荧光明显增多,绿色明显减少,并且随着肽浓度的增加,红色荧光也逐渐增加,绿色荧光逐渐减少,其作用效果与阳性对照polyB的相似.提示I4W和L5W能够利用破坏MREF0321菌株细胞膜杀死细菌.
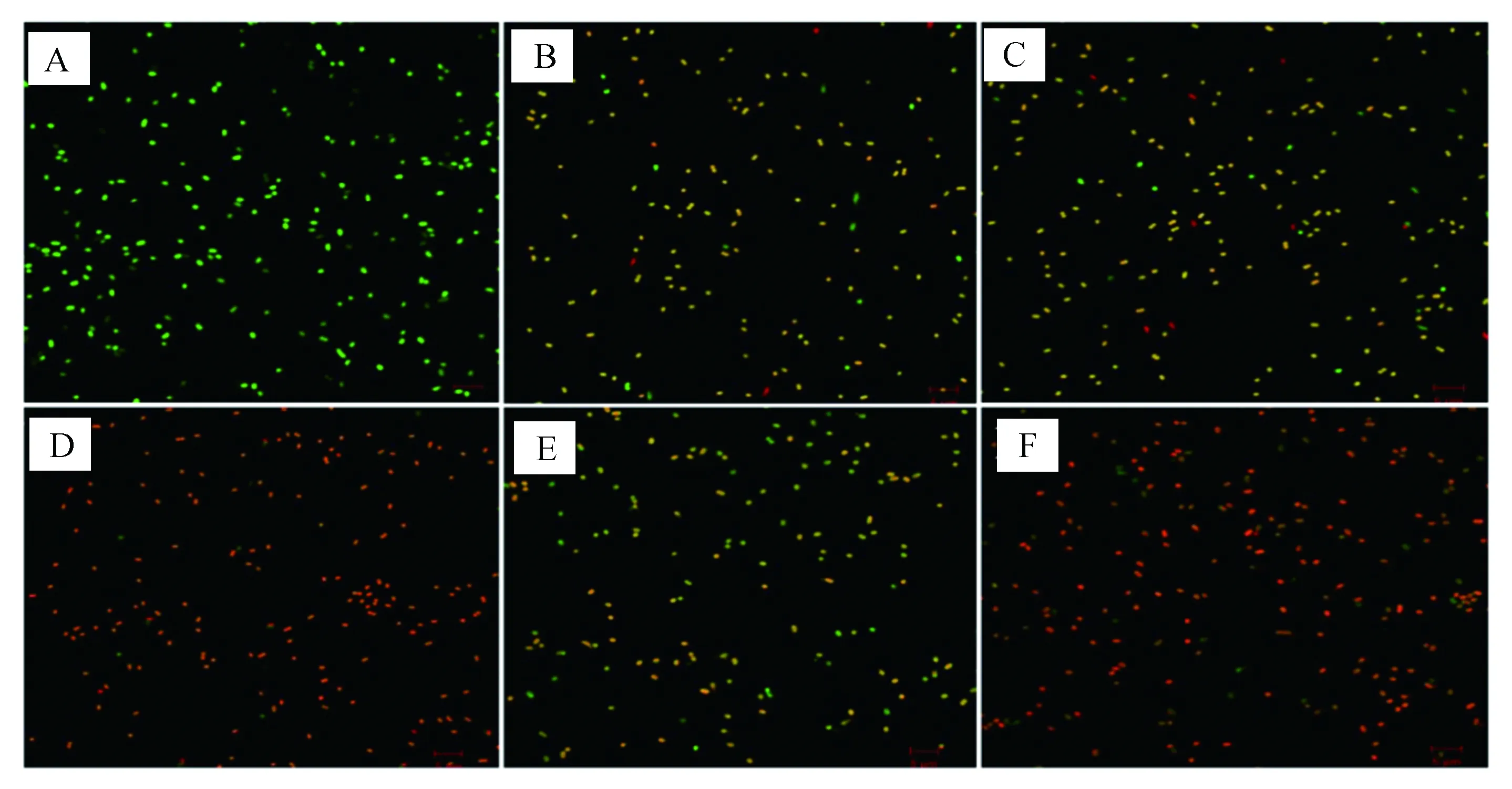
图2 激光共聚焦显微镜观察含色氨酸系列抗菌肽对MREF0321的影响
细菌表面带负电荷,抗菌肽带正电荷,可以通过Zeta电势实验检测细菌表面的电位变化,说明抗菌肽与细菌的结合.实验结果如图3A所示,加入I4W或L5W后,MREF0321表面电位从负值逐渐变成0,进一步增加到正电势,表明MREF0321表面的负电荷逐渐被I4W或L5W所带的正电荷中和,而且随着肽浓度增加,呈正电势.I4W和L5W分别在浓度为3.13 μM和6.25 μM时能够将MREF0321细胞表面的负电荷完全中和,阳性对照polyB与I4W相似.NPN是一种疏水性的荧光探针,在疏水的条件下会产生强烈的荧光,而在水溶液条件下则会发生荧光淬灭.当细菌外膜受到破坏时,NPN荧光染料就会进入外膜的疏水区域而产生荧光.可以通过检测NPN荧光强度判断抗菌肽对细菌外膜的渗透能力.如图3B所示,加入I4W或L5W后,细菌细胞荧光值明显升高,而且随着肽浓度增大,荧光值增加,表明I4W和L5W 能增加MREF0321细胞外膜渗透性,且呈浓度依赖性.DiSC3-5是一种检测细菌细胞膜通透性的荧光探针,如果细胞膜稳定性或通透性被破坏,亲脂性分子就会与DiSC3-5紧密结合,荧光强度随之上升.荧光值越大说明细胞膜被破坏的程度越大.如图3C和3D所示,DiSC3-5加入MREF0321溶液后,荧光值开始下降,6 min后荧光值不再下降,表明荧光染料达到最大吸收;第10 min加入I4W和L5W以及阳性对照polyB,1 min后,DiSC3-5荧光迅速释放,并且肽浓度越大,荧光释放量越多;在作用6 min时,I4W和L5W组达到最大荧光释放量,说明I4W和L5W能够使细胞膜发生去极化,并且具有浓度依赖性.
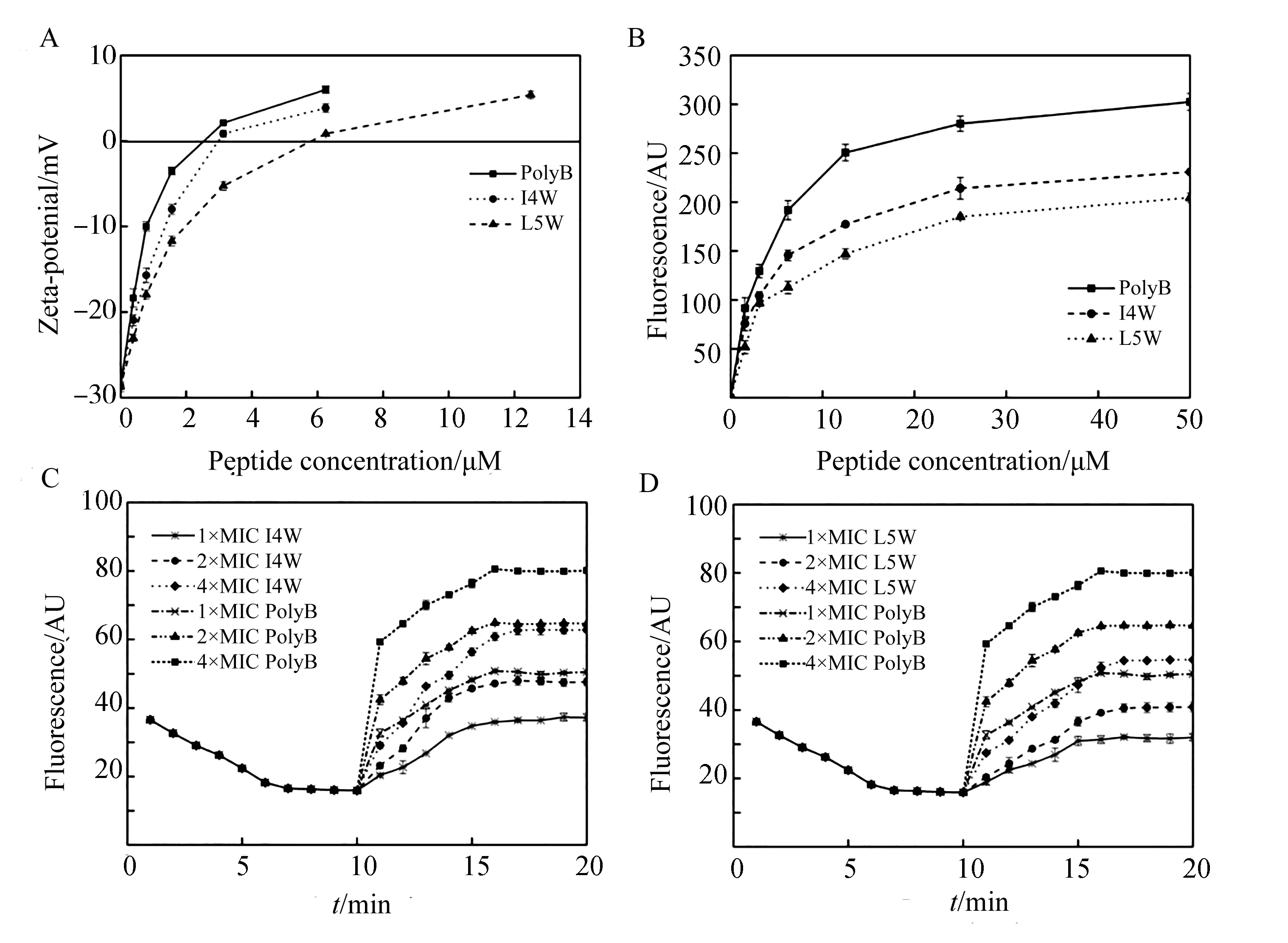
图3 含色氨酸系列抗菌肽对MREF0321细胞外膜和内膜的影响
2.3 含色氨酸系列抗菌肽I4W和L5W对MREF0321生物被膜的影响
用结晶紫染色法测定含色氨酸系列抗菌肽对MRFE0321生物被膜的形成和分解的影响.如图4A所示,I4W和L5W明显抑制MRFE0321生物被膜的形成,并且随着肽浓度的增大,抑制增加.两个肽与polyB的作用效果相似.I4W和L5W的MBIC50值都是5 μM左右,是其MIC值的2~3倍(表3),表明I4W和L5W能够抑制 MRFE0321生物被膜的形成,但其在低于MIC浓度时,抑制效果较差.含色氨酸系列抗菌肽还可以分解已经形成1 d的MREF0321生物被膜.如图4B所示,低浓度的I4W和L5W 对MREF0321生物被膜的分解较差,当肽浓度增加到4×MIC及以上时,对MREF0321生物被膜的分解效率明显提高,分解效果与polyB相似;I4W和L5W的MBRC50值分别是8.65和10.72 μM,是其MIC值的5.5倍和3.4倍(表3),表明I4W和L5W对已经形成1 d的MREF0321的分解能力低于其对生物被膜形成的抑制能力.EPS和eDNA是生物被膜的重要组分,在生物被膜形成过程中发挥重要的作用.如图4C和4D所示,加入I4W或L5W后,MREF0321生物被膜中EPS和eDNA的生成量均显著降低,而且肽浓度越高,二者生成量越少,与阳性对照polyB的作用效果相似.
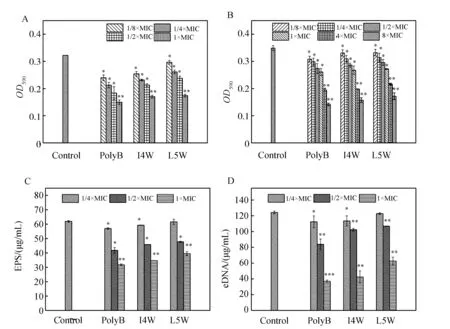
图4 含色氨酸系列抗菌肽对MREF0321生物被膜的影响
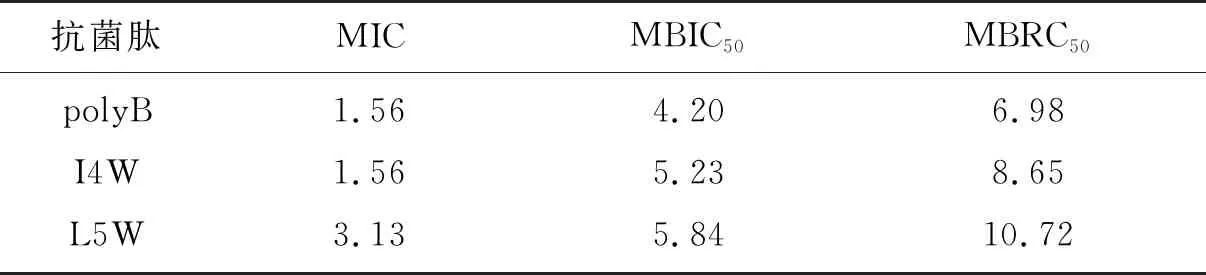
表3 含色氨酸系列抗菌肽对MREF0321生物被膜的MBIC50和MBRC50值
2.4 抗菌肽I4W和L5W调节MREF0321 毒性因子的表达
GelE是粪肠球菌分泌的一种重要毒性因子,其表达受fsr系统中fsrA、fsrB和fsrC等基因调节,可以从转录水平上检测含色氨酸系列抗菌肽对fsr系统中fsrA、fsrB、fsrC及gelE基因表达的影响.结果如图5A所示,对照组4个基因表达量稳定,而加入I4W和L5W后,fsrA、fsrB、fsrC和gelE的表达均低于对照组,与阳性对照polyB的作用效果相似.表明I4W和L5W能够抑制gelE及相关基因fsrA、fsrB和fsrC的表达,并且具有浓度依赖性.gelE能够分解胶原,当与偶氮相连的骨胶原被分解后,偶氮染料释放进入溶液中,荧光值即OD540就会升高,OD540越高,表示gelE活性越强.结果如图5B所示,对照组的酶活力为0.96 U,加入I4W或L5W后,酶活力明显降低,并且肽浓度越高,降低得越多,与阳性对照polyB的作用效果相似,表明I4W和L5W能够抑制gelE活性,且具有浓度依赖性.GelE还能激活细菌分泌另一种毒性因子——自溶素,自溶素可以分解肽聚糖.当肽聚糖被分解后,吸光值OD450就会降低,OD450越低,表示自溶素的活性越强.结果如图5C所示,对照组的酶活力为0.54 U,加入I4W或L5W后,自溶素活性明显降低,并且肽浓度越高,降低得越多,与阳性对照polyB的作用效果相似,表明I4W和L5W能够抑制自溶素活性,且具有浓度依赖性.
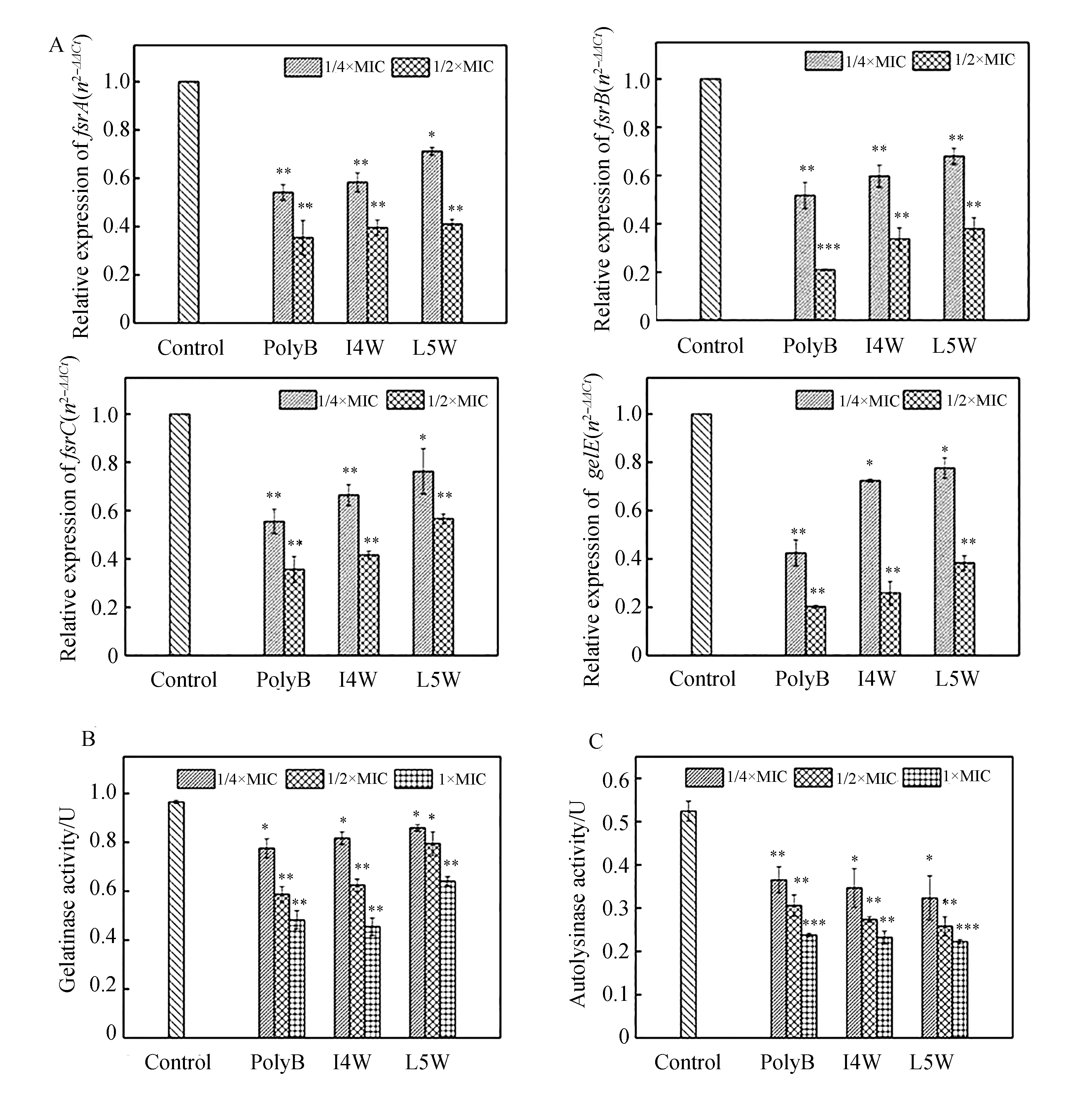
图5 含色氨酸系列抗菌肽对MREF0123毒性因子的影响
3 讨 论
粪肠球菌作为临床感染中最常见的致病菌,由于其固有性耐药和获得性耐药,已经对多种传统的抗生素产生了耐药性,因此迫切需要代替抗生素的新型药物.随着人们对抗菌肽的深入研究以及抗菌肽表现出的诸多优点,抗菌肽受到越来越多的关注[24].目前为止,国内外学者提出了关于抗菌肽机制的多种可能性,但普遍认为带正电荷的阳离子抗菌肽首先通过静电作用与细菌细胞膜上带负电荷的磷脂双分子层相互作用.随后抗菌肽的疏水区域插入疏水的细胞膜磷脂双分子层,改变细胞膜的通透性,细胞内容物外泄,导致细菌死亡[25].本实验室从中国林蛙皮肤分泌物中提取出天然抗菌肽Temporin-1CEb,并对其进行改造.前期研究发现含色氨酸系列抗菌肽具有较强的疏水性,其特有的侧链基团有助于抗菌肽插入细胞膜中,对铜绿假单胞菌、表皮葡萄球菌等都有良好的抗菌活性.本次研究发现含色氨酸系列抗菌肽对MRFF0321具有良好的抗菌活性,且具有浓度依赖和时间依赖性,其中,抗菌肽I4W的杀菌活性好于L5W.两者对细菌的作用靶点位于膜上,可以通过静电作用与细胞膜结合改变细胞外膜和内膜的通透性,并扰乱膜稳定性,使细胞内容物泄漏,导致细胞死亡.粪肠球菌在临床上最常引起的疾病是尿路感染,留置导尿管表面易于细菌的定植和生物被膜的生成,其通过植入各种人造装置侵入人体,在这个过程中会发生一些表型变化,从而获得对抗菌药物顽强的抵抗力[26-27].造成这种现象的主要原因就是细菌在这些人造材料表面形成了难以清除的生物被膜,生物被膜是其主要毒力及致病因素[28-29].此次研究还发现抗菌肽I4W和L5W能够通过抑制fsr群体感应系统中明胶酶相关基因fsrA、fsrB、fsrC、gelE的表达,抑制毒性因子自溶素和明胶酶的生成,最终抑制生物被膜及生物被膜组分EPS和eDNA的生成.国内外的研究进展表明,除了大量膜活性抗菌肽外,许多抗菌肽可以干扰或抑制细胞内生物合成过程,如抗菌肽buforinⅡ和PR39穿过细菌的细胞膜后与核酸作用,最终杀死致病菌[30].另一方面,有其他研究人员发现,抗菌肽还能够抑制对宿主有损伤的炎症反应,抵制而不直接杀死病原体,维持组织体内平衡,为治疗传染病提供了新途径,因此,抗菌肽具有作为新一代抗生素的发展潜力.迄今为止,在市场上有超过100种基于肽的药物用于治疗各种疾病,而在临床试验中几乎有500~600种候选药物,其中,许多都是合成型抗菌肽[31].已经在临床使用合成肽的实例包括用于局部应用的多黏菌素[32],作为局部软膏和滴眼剂的短杆菌肽[33],充当食品防腐剂的乳链菌肽[31].此外,米卡芬净和阿尼芬净作为临床批准的抗真菌药物,达托霉素较早用于皮肤感染,现在最大限度地以注射形式用作抗甲氧西林抗性金黄色葡萄球菌的备用杀菌药物[34].因此,深入研究合成肽对病原微生物的杀伤机制,能有效评估抗菌肽在临床应用的潜在价值,同时为新药研发提供新思路.

