基于网络药理学及分子对接探讨骨碎补-补骨脂药对治疗骨转移癌痛的作用机制
赖桂花 王菲 周芳 向婷婷 文玲 伍卓珺 曹建雄
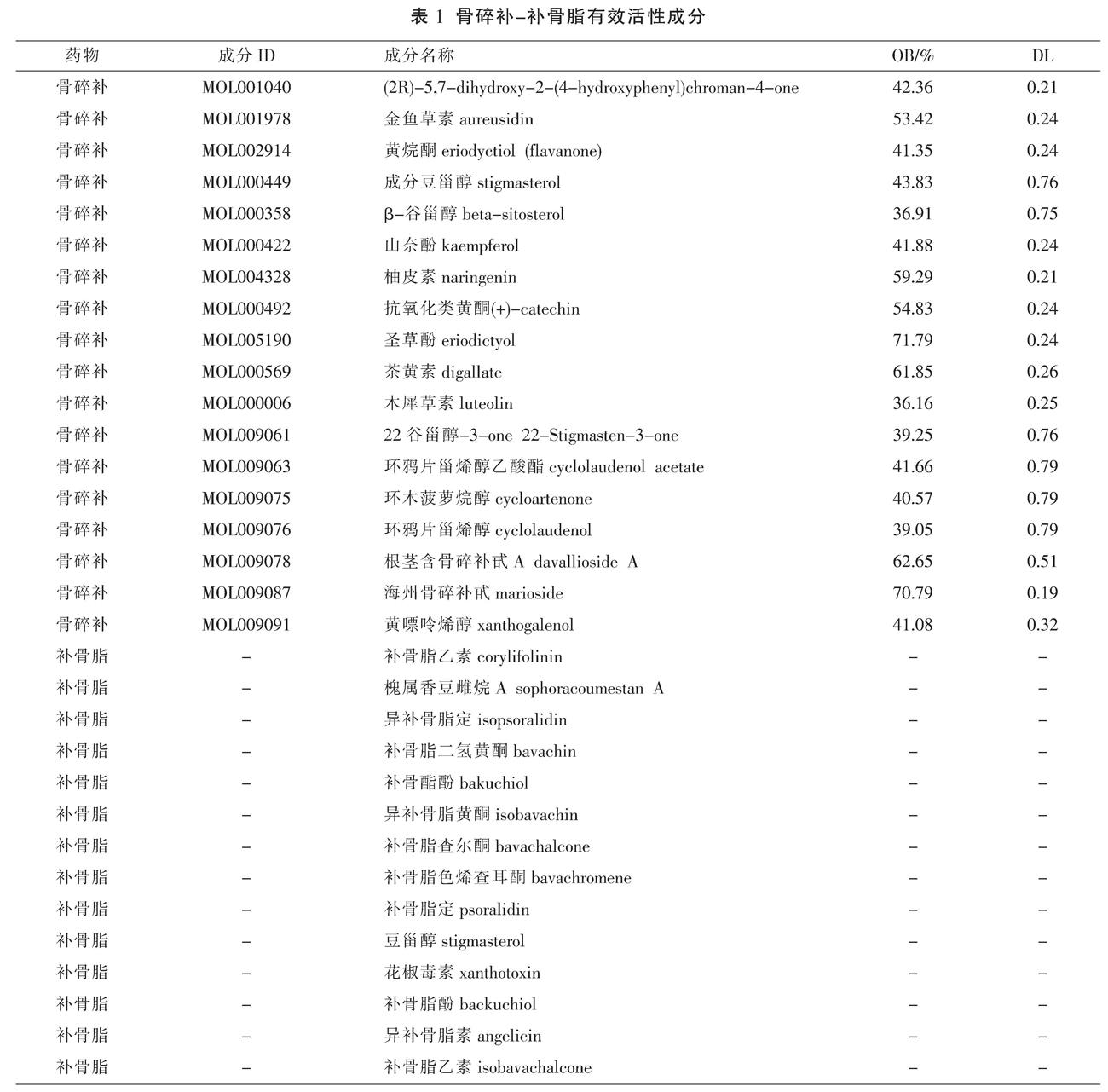


〔摘要〕 目的 采用網络药理学及分子对接技术探讨骨碎补-补骨脂治疗骨转移癌痛的作用机制。方法 通过文献查找、TCMSP 数据库及BATMAN-TCM数据库获取骨碎补-补骨脂的活性成分及其对应的靶点,通过GeneCards数据库获得骨转移癌痛相关的靶点,利用Venn在线软件获取“化合物-疾病”共同靶点,运用Cytoscape 3.7.1软件构建“中药-化合物-靶点-疾病”网络图,使用STRING数据库绘制核心靶点PPI网络,利用DAVID对核心靶点进行GO功能及KEGG通路富集分析,最后使用Auto Dockt Vina对骨碎补-补骨脂关键化学成分与核心靶点进行分子对接验证。结果 骨碎补-补骨脂关键化合物为豆甾醇、异补骨脂素、补骨脂酚、山柰酚、β-谷甾醇、木犀草素等,核心作用靶点涉及AKT1、TP53、IL-6等;GO生物学过程分析表明骨碎补-补骨脂活性成分的基因功能主要表现在RNA 聚合酶Ⅱ启动子的正调控、信号转导、细胞增殖的正调控等过程,KEGG结果表明骨碎补-补骨脂主要作用与AKT1、TP53、IL-6等核心靶点和癌症通路等信号通路有关。分子对接结果表明豆甾醇、异补骨脂素、补骨脂酚、山柰酚、β-谷甾醇、木犀草素与AKT1、TP53、IL-6有很好的结合能力。结论 骨碎补-补骨脂活性成分豆甾醇、异补骨脂素、补骨脂酚、山柰酚、β-谷甾醇、木犀草素可能通过癌症通路等信号通路作用于AKT1、TP53、IL-6等关键靶点而发挥治疗骨转移癌痛的功效。
〔关键词〕 骨转移癌痛;骨碎补;补骨脂;网络药理学;分子对接
〔中图分类号〕R285 〔文献标志码〕A 〔文章编号〕doi:10.3969/j.issn.1674-070X.2021.09.011
Mechanism of Gusuibu (Drynariae Rhizoma)-Buguzhi (Psoraleae Fructus) Drug Pair on Treatment of Bone Metastasis Cancer Pain Based on Network Pharmacology and Molecular Docking
LAI Guihua1, WANG Fei1, ZHOU Fang1, XIANG Tingting1, WEN Ling1, WU Zhuojun1, CAO Jianxiong1,2*
(1. Hunan University of Chinese Medicine, Changsha, Hunan 410208, China; 2. The First Affiliated Hospital of
Hunan University of Chinese Medicine, Changsha, Hunan 410007, China)
〔Abstract〕 Objective To use network pharmacology and molecular docking technology to explore the mechanism of Gusuibu (Drynariae Rhizoma)-Buguzhi (Psoraleae Fructus) for the treatment of bone metastasis cancer pain. Methods Through literature search, TCMSP database and BATMAN-TCM database, the active ingredients of Gusuibu (Drynariae Rhizoma)-Buguzhi (Psoraleae Fructus) and their corresponding targets were obtained, the targets related to bone metastasis cancer pain were obtained through GeneCards database, and the "compound-disease" common targets were obtained by using Venn online software. Cytoscape 3.7.1 software was used to construct “Chinese medicine-compound-target-disease” network diagram, STRING database was used to draw core target PPI network, DAVID was used to perform GO function and KEGG pathway enrichment of core target. Auto Dockt Vina was used to verify the molecular docking between the key chemical components of Gusuibu (Drynariae Rhizoma)-Buguzhi (Psoraleae Fructus) and their core target. Results The key compounds of Gusuibu (Drynariae Rhizoma)-Buguzhi (Psoraleae Fructus) were stigmasterol, isopsoralen, bakuchiol, kaempferol, β-sitosterol, luteolin, etc. The core targets involved AKT1, TP53, IL-6, etc. GO biological process analysis showed that the gene function of the active ingredients of Gusuibu (Drynariae Rhizoma)-Buguzhi (Psoraleae Fructus) was mainly manifested in the positive regulation of RNA polymerase II promoter, signal transduction, and positive regulation of cell proliferation. The results of KEGG showed the main role of Gusuibu (Drynariae Rhizoma)-Buguzhi (Psoraleae Fructus) was related to AKT1, TP53, IL-6 and other core targets and cancer signaling pathways. The molecular docking results showed that stigmasterol, isopsoralen, bakuchiol, kaempferol, β-sitosterol, luteolin had good binding ability with AKT1, TP53, and IL-6. Conclusion Active ingredients stigmasterol, isopsoralen, bakuchiol, kaempferol, β-sitosterol, luteolin of Gusuibu (Drynariae Rhizoma)-Buguzhi (Psoraleae Fructus) may act on AKT1, TP53, IL-6 and other key targets through signaling pathways such as cancer pathway to treat bone metastasis cancer pain.
〔Keywords〕 bone metastasis cancer pain; Gusuibu (Drynariae Rhizoma); Buguzhi (Psoraleae Fructus); network pharmacology; molecular docking
骨转移癌痛(bone cancer pain, BCP)是恶性肿瘤转移到骨引起的疼痛,严重影响患者的生活质量,发病机制复杂,其主要机制是由于肿瘤细胞的侵犯使骨稳态失衡,骨质得到破坏,引发BCP[1]。现代医学治疗主要以病因治疗和对症治疗为主,对症治疗以止痛药物为主,止痛效果明确,但由于耐药、药物副作用、心理因素和个体差异等多方面的原因,临床治疗效果并不满意,同样抗肿瘤等病因治疗也未能取得理想的长期治疗效果[2-4]。如何对BCP进行有效合理的治疗,是当今临床亟需解决的问题。临床及现代药理研究[5-7]证实,中医药治疗BCP是有效、安全的,且在协同增效、降低西药毒性等方面发挥重要的作用。笔者前期基于数据挖掘对中医内服方剂治疗BCP文献中的医案及临床研究进行分析和研究,发现骨碎补-补骨脂是中医治疗BCP方剂中频率出现最高的组合[8],其中骨碎补补肾强骨,补骨脂属补肾壮阳之要药,两者配伍治疗BCP,可在补益肝肾精血的同时又温化肾阳,阴阳双补从而起到壮骨强筋之用。现代药理学研究[9]表明,两药合用能促进成骨细胞的增殖,拮抗破骨细胞的过度激活,对BCP具有良好的止痛作用。实验研究[10]表明,骨碎补、补骨脂具有类似雌激素作用,补骨脂具有抑制破骨细胞生成活性及减少溶骨性活动的功能;而骨碎补则在增加成骨细胞生成方面作用更为明显,两者在方剂中配伍使用可协同增效、相互兼治,从微结构改善骨组织、增加骨密度及增强骨质量。网络药理学是一门综合了生物学、药理学、计算机等多个学科的新兴交叉学科,从整体水平、分子层面及多靶点、多通路深入探索药物与疾病的关系,适应中药复方多靶点的特性,体现了中药组方的系统性,有助于阐明中药的药理作用[11]。近年来,运用网络药理学对中药治疗复杂性疾病的作用机制研究得到了中医药研究者的认可和应用[12]。因此,本文通过网络药理学方法,收集和分析疾病、药物信息,从生物信息学角度探讨骨碎补-补骨脂治疗BCP的可能作用机制,并采用分子对接对关键化合物和核心靶点进行初步验证,为进一步实验研究提供参考依据。
1 材料与方法
1.1 骨碎补-补骨脂的化学成分筛选及靶点预测
在TCMSP数据库(http://lsp.nwsuaf.edu.cn/tcmsp.php)收集骨碎补的化学成分,根据药物动力学(absorption、distribution、metabolism、excretion, ADME)的特点将口服利用度(OB)≥30%,类药性(DL)≥0.18作为筛选条件获得主要活性成分[13],并基于TCMSP数据库获取骨碎补中筛选出活性成分的潜在作用靶点。由于TCMSP中未收集补骨脂相关信息,在BATMAN-TCM数据库(http://bionet.ncpsb.org/batman-tcm/)中以“Bu Gu Zhi”(补骨脂)为检索词,“Herb”(草药)为输入格式,检索Score Cutoff设置为20,以P<0.05为有效靶点预测置信区间,检索获得补骨脂的活性成分及其作用靶点信息。并根据文献检索增加骨碎补、补骨脂中有明确药理活性的主要成分,将检索所得各个主要成分于TCMSP 数据库、ETCM数据库中检索相关靶点。最后通过Uniprot数据库(https//www.uniprot.org/)将两者药物的靶点名称统一标准化处理,标准化命名为基因名称。
1.2 骨碎补-补骨脂中活性化合物治疗BCP的靶点映射
利用Genecards数据库(https://www.genecards.org/)以“bone cancer pain”为关键词筛选疾病BCP相关靶点基因。利用网络在线绘图软件Venny2.1(https://bioinfogp.cnb.csic.es/tools/venny/)绘制韦恩图,将筛选出的骨碎补-补骨脂的作用靶点与获取的BCP疾病靶点进行映射,获得骨碎补-补骨脂治疗BCP的关键作用靶点。
1.3 构建“中药-化合物-靶点-疾病”网络
将相关数据输入到Cytoscape(Version 3.7.1)中,构建“中药-化合物-靶点-疾病”网络。本研究通过自由度(degree)的大小来分析网络中的节点,节点的degree值越大则其在网络中的地位越重要,说明其参与的生物功能越多,生物学重要性越强[14]。
1.4 构建交集靶点“蛋白与蛋白相互作用”网络
采用在线STRING数据库(http://string-db.org/cgi/input.pl)构建骨碎补-补骨脂作用于BCP的靶点蛋白相互作用(PPI)网络。并将该PPI导入Cytoscape
3.7.1的软件中,利用该软件的插件cytohubba,根据网络拓扑结构筛选关键靶基因。
1.5 GO富集分析与KEGG通路分析
将获得的骨碎补-补骨脂作用于BCP的预测靶基因导入在线的DAVID数据库中(https://david.ncifcrf. Gov),选择“functional annotation”模块进行GO功能富集分析以了解靶点主要作用过程,KEGG通路分析观察靶點在通路中的分布情况。GO富集分析由生物过程(biological process, BP)、细胞组分(cellular component, CC)和分子功能(molecular function, MF)3个部分组成,本研究中GO分析和KEGG分析均以P<0.05、FDR<0.05作为筛选标准[15]。
1.6 主要潜在活性成分-靶点分子对接
为了验证靶点预测结果的可靠性,从“骨碎补-补骨脂”治疗BCP作用靶点的PPI中选取核心活性化合物和核心靶点进行分子对接。通过 PubChem 数据库(https://pubchem.ncbi.nlm.nih.gov/)下载核心活性化合物2D结构的SDF格式文件,并借助 ChemDraw软件绘其化学结构式。使用Pymol软件对原PDB文件进行去除水和原配体处理,AutoDockTools 软件为靶蛋白受体分子加极性氢,通过AutoDock Vina和Python脚本实现分子对接[16]。
2 结果
2.1 骨碎补-补骨脂活性成分与相应靶点
在TCMSP数据库中查找出骨碎补的活性成分71个,以OB≥30%,DL≥0.18作为限定条件筛选出活性成分18个(见表1),靶点105个;在BATMAN-TCM数据库中获得补骨脂化合物14个,靶点268个。经文献检索出苦参黄素为骨碎补的主要活性成分[17],另外黄芪苷、亚油酸、花翠素、补骨脂宁为补骨脂主要活性成分[18];但根据药物ADME对文献来源的有效化合物进行筛选,因OB与DL值过小未符合筛选条件,故不将其纳入。
2.2 成分和疾病共同靶点的获取
通过GeenCards数据库得到BCP相关靶点8 935个,使用Venny2.1软件将骨碎补-补骨脂的活性化合物对应的353个药物靶点与BCP对8 935个疾病靶点取交集,通过Venn图的形式得到296个共同靶点。见图1。
2.3 “中药-化合物-靶点-疾病”网络分析
在Cytoscape 3.7.1软件中导入骨碎补-补骨脂的活性成分、靶点及BCP相关靶标,构建“药物-疾病-成分-靶标”的可视化网络图,图中可知网络中共包括节点397个,边1 105条。其中代表疾病的节点1个,代表药物的节点2个,代表化合物的节点30个,代表疾病-药物交集的靶点296个。见图2。
2.4 PPI网络分析
将中药-疾病映射靶点导入STRING数据库中,建立“骨碎补-补骨脂—BCP”靶点的PPI网络,共得到296个节点,3 376条边,平均节点度为 22.9;再将该结果以TSV格式导出,通过Cytoscape 3.7.1软件对该网络进行拓扑分析,以degree值≥46(根据degree平均值的倍数)为筛选标准,并删除与骨转移癌痛无关的靶点,得到24个核心靶点,处于核心位置的靶点(排名前10)有丝氨酸/苏氨酸蛋白激酶1(AKT1)、抑癌基因TP53、白细胞介素-6(IL-6)、丝裂原活化蛋白激酶(MAPK1)、表皮生长因子受体(EGFR)、血管内皮生长因子A(VEGFA)、雌激素受体(ESR1)、丝裂原活化蛋白激酶14(MAPK14)、原癌基因JUN、肿瘤坏死因子(TNF),提示这些靶点蛋白在PPI网络中发挥着关键作用。见图3。
2.5 GO富集分析与KEGG通路富集分析
DAVID数据库中GO富集分析表明,骨碎补-补骨脂治疗BCP共涉及到395个BP,57个CC以及96个MF,BP中主要是对RNA聚合酶Ⅱ启动子的正调控(positive regulation of transcription from RNA polymerase II promoter)、信号转导(signal transduction)、细胞增殖的正调控(positive regulation of cell proliferation)等生物过程进行调节。CC中主要是对质膜(plasma membrane)、细胞核(nucleus)、细胞质(cytosol)等细胞组分有显著作用。MF中主要是对蛋白结合(protein binding)、ATP结合(ATP binding)、锌离子结合(zincion binding)等分子功能有显著作用。本研究分别依据P值大小筛选排名前20位的 BP结果绘制气泡图,见图4。
KEGG 通路富集分析表明,骨碎补-补骨脂治疗BCP共涉及134条通路。富集靶基因最多的10条通路依次为癌症(pathways in cancer)、神经活性配体-受体相互作用(neuroactive ligand-receptor interaction)、钙信号通路(calcium signaling pathway)、cAMP信号通路(cAMP signaling pathway)、乙型肝炎(hepatitis B)、非酒精性脂肪肝病(non-alcoholic fatty liver disease)、cGMP-PKG信号通路(cGMP-PKG signaling pathway3)、HIF-1信号通路(HIF-1 signaling pathway)、多巴胺能突触(dopaminergic synapse)、恰加斯病(Chagas disease)、心肌细胞的肾上腺素信号传导(adrenergic signaling in cardiomyocytes)。见图5。
2.6 核心活性成分-靶点分子对接分析
将关键化合物为豆甾醇、异补骨脂素、补骨脂酚、山柰酚、β-谷甾醇、木犀草素与靶点AKT1、TP53、IL-6进行分子对接(见表2)。结果表明6个化合物与3个核心靶点均有有较好的结合能力,其中stigmasterol与AKT1的对接效果最好。见图6。
3 讨论
从本研究可知骨碎补-补骨脂中不同的靶标可对应相同的活性成分,同一靶标也可与不同的活性成分相对应,且30个活性化合物中每个化合物都至少与2个疾病靶点相互作用,可见骨碎补-补骨脂治疗BCP具有多成分、多靶标的特点。该药对治疗BCP主要是木犀草素、山柰酚等黄酮类化合物及其苷类化合物,豆甾醇和β-谷甾醇等甾体类化合物以及异补骨脂素、补骨脂酚等香豆素类化合物。研究[19]表明木犀草素和山柰酚不仅具有抗炎、抗氧化、抗肿瘤等药理活性,而且还具有较好的保护骨的作用。木犀草素可潜在抑制RANLRP3炎性小体过表达、进一步降低Caspase-1、RANKL、VEGF和HIF-1α蛋白表达,并增强OPG蛋白表达起到骨关节保护作用[20]。山柰酚可通过mTORC1信号通路促进牵张力下小鼠骨髓间充质细胞成骨分化[21]。豆甾醇和β-谷甾醇等甾体类化合物在多种肿瘤中发挥重要作用[22],实验研究[23]发现其在小鼠的多种急、慢性疼痛模型表现出有效的镇痛作用,因此,甾体类化合物对于BCP可能具有良好的治疗作用。补骨脂素近年来被广泛应用于骨科疾病的治疗,不仅能够促进骨髓间充质干细胞向骨细胞分化且能够抑制破骨细胞分化[24-25],从而起到防治骨科疾病的作用,对于骨癌痛中骨组织的破坏有重要的保护和修复作用。补骨脂酚是补骨脂的主要有效成分,现代医学研究表明补骨脂酚具有良好的促进骨骼再生与重建的作用[26]。分子对接结果验证了骨碎补-补骨脂中核心活性成分与AKT1、TP53、IL-6結合后均展现出良好的亲和力,其结合能越低代表受体与配体的亲和力越好,一般认为结合能小于-4.25 kcal/mol 提示配体与受体有一定的结合活性,小于-5.0 kcal/mol有较好的结合活性,小于-7.0 kcal/mol有强烈的结合活性[27],说明骨碎补和补骨脂的活性成分与核心靶点均具有较好的结合性。因此,本研究从一定程度上揭示了骨碎补-补骨脂治疗BCP的主要活性成分,为其治疗BCP提供了一定的依据。
从拓扑出的关键节点来看,AKT1、TP53、IL-6、MAPK1、EGFR、VEGFA、ESR1、MAPK14、JUN、TNF等靶点蛋白在PPI网络中发挥着关键作用,既是骨碎补-补骨脂的药物作用靶点,又是BCP的疾病靶点,提示这些靶点可能是骨碎补-补骨脂作用于BCP的直接作用靶点。结合GO分析及KEGG分析结果,骨碎补-补骨脂治疗BCP的可能作用机制与以下四个方面有关:(1)BCP的主要病理是骨组织的破坏,成骨细胞与破骨细胞的增殖与分化参与骨发育和骨代谢的生物学过程[28],从KEGG通路結果可知富集基因数最多的通路是癌症通路,其中癌症相关通路包括经典的Wnt信号通路,该通路对调控成骨细胞与破骨细胞的平衡起着重要的作用[29-30];骨碎补与补骨脂为临床补肾强骨要药,文献[31-32]表明骨碎补与补骨脂可通过多种代谢途径保护骨组织,不仅可以促进骨髓间充质干细胞的成骨性分化及成骨细胞的增殖,还能抑制破骨细胞的的骨吸收。因此,骨碎补-补骨脂治疗BCP可能通过调节成骨细胞与破骨细胞的平衡从而起到保护和修复骨的作用。(2)近年来,研究[33]发现小胶质细胞与BCP的产生具有紧密的联系,当各种伤害性刺激引起外周敏化时,初级传入神经末梢释放P物质,特异性与小胶质细胞受体结合,小胶质细胞明显增生肥大,并可以释放大量的促炎性因子,参与并维持BCP的发生。从PPI网络中的核心靶点可知,TNF与IL-6作为促炎细胞因子在BCP的发生和维持中起关键作用[34]。侯公瑾等[35]人通过建立BCP大鼠模型,发现蟾龙镇痛膏可降低血清中TNF-α、IL-6,表明蟾龙镇痛膏对BCP大鼠有镇痛作用,其机制可能与抑制炎性因子释放有关。另外MAPK被证实与小胶质细胞的活化相关,核心靶点中MAPK1与MAPK14均属于MAPK,抑制MAPK信号通路可以显著降低炎症反应[36]。因此,骨碎补-补骨脂可能通过抑制小胶质细胞的活化衍生的促炎细胞因子和激活相关信号通路,有效缓解BCP。(3)神经病理性性疼痛是BCP的病理机制之一,从结果可知多个靶点和通路直接或间接参与神经病理性疼痛。研究[37-38]表明cAMP-PKA信号通路通过介导炎症介质引起的外周痛觉敏化和神经病理性疼痛在大鼠BCP的产生和发展中起着重要的作用。此外,钙的水平及其通道活动有助于疼痛的神经病理过程,因此,钙信号通路的激活在BCP中有重要的作用[39]。HIF-1α是低氧适应性反应过程中的关键转录因子,HIF-1α通过上调SDF1-CXCR4信号进而参与神经性病理性疼痛的发生与维持[40]。因此,骨碎补-补骨脂可能通过抑制异常的神经元反应从而达到缓解BCP的目的。(4)BCP的主要病因是肿瘤自身引起,因此,抗肿瘤也是治疗BCP的主要治疗方法之一,骨碎补-补骨脂治疗BCP的核心靶点和通路中包括多个肿瘤相关的靶基因,其作用机制可能是通过作用于肿瘤相关靶点直接或间接起到抗BCP的作用。一项VEGF家族在癌性疼痛中的外周感官神经元的功能作用的研究[41]表明BCP受肿瘤细胞-血管和神经之间的相互作用调节。EGFR在多种肿瘤中表达上调,相关研究[42]表明EGFR参与并维持神经病变及炎症性疼痛,在多种疼痛动物模型中抑制EGFR可起到镇痛作用。JUN基因属于原癌基因之一,有研究[43]表明JUN是缓解神经病理性疼痛的关键上调基因之一。PI3K-AKT信号转导通路为重要的抗肿瘤通路之一,研究[44-45]表明该通路可通过中枢敏化参与乳腺癌骨转移大鼠BCP脊髓水平的调节,在大鼠BCP发生发展过程中起着重要作用。
综上所述,本研究运用网络药理学、分子对接等手段,从直观的角度对药对骨碎补-补骨脂治疗BCP进行了整体的认识,并说明骨碎补-补骨脂可通过直接或间接靶点介导的多个主流信号通路网络多靶点、多层次作用于BCP,为进一步深入研中药干预BCP提供了重要参考,相比于传统药理学研究呈现出了一定的优势。受限于本研究仅单纯的考虑到中药、活性化合物、靶点三者之间的数量关系,尚未兼顾到活性化合物与靶点产生的药效强度因素,因此,药物在体内的作用机制还需要通过进一步实验验证。
参考文献
[1] 赖桂花,袁 晶,闫钰婷,等.骨转移癌痛的中西医治疗进展[J].湖南中医药大学学报,2019,39(9):1166-1170.
[2] KIM M H, OH J E, PARK S, et al. Tramadol use is associated with enhanced postoperative outcomes in breast cancer patients: A retrospective clinical study with in vitro confirmation[J]. British Journal of Anaesthesia, 2019, 123(6): 865-876.
[3] 闫晓倩,赵君慧,王淼舟.癌痛规范化诊治的研究现状及影响因素分析[J].中国现代医药杂志,2015,17(10):104-106.
[4] DERRY S, WIFFEN P J, MOORE R A, et al. Oral nonsteroidal anti-inflammatory drugs (NSAIDs) for cancer pain in adults[J]. The Cochrane Database of Systematic Reviews, 2017, 7: CD012638.
[5] YANG B, ZHANG Z, YANG Z, et al. Chanling Gao attenuates bone cancer pain in rats by the IKKβ/NF-κB signaling pathway[J]. Frontiers in Pharmacology, 2020, 11: 525.
[6] 刘 丹,焦良波,陈 涛,等.基于对骨癌痛大鼠脊髓TAK1/JNK/c-Jun信号通路的调控探讨华蟾素镇痛机制[J].中国药学杂志,2021,56(2):108-114.
[7] 焦良波,刘 丹,陈 涛,等.华蟾素对骨癌痛大鼠镇痛机制探讨[J].中草药,2020,51(14):3734-3741.
[8] 赖桂花,向婷婷,王 菲,等.基于数据挖掘对中医内服方剂治疗骨转移癌痛证治规律的分析[J].湖南中醫药大学学报,2021,41(4): 586-592.
[9] 姚 暄,贾立群,谭煌英,等.补肾壮骨中药对大鼠乳腺癌骨转移模型骨痛及骨质破坏的影响[J].中医药学报,2012,40(2):14-16.
[10] 蔡 浩.单味骨碎补、补骨脂及双味联合防治去势大鼠骨丢失的实验研究[D].合肥: 安徽中医药大学,2015.
[11] MA C, WANG X, XU T, et al. An integrative pharmacology-based analysis of refined qingkailing injection against cerebral ischemic stroke: A novel combination of baicalin, geniposide, cholic acid, and hyodeoxycholic acid[J]. Frontiers in Pharmacology, 2020, 11: 519.
[12] HUANG S Q, ZHANG Z Y, LI W Q, et al. Network pharmacology-based prediction and verification of the active ingredients and potential targets of zuojinwan for treating colorectal cancer[J]. Drug Design, Development and Therapy, 2020, 14: 2725-2740.
[13] SHEN M Y, TIAN S, LI Y Y, et al. Drug-likeness analysis of traditional Chinese medicines: 1. property distributions of drug-like compounds, non-drug-like compounds and natural compounds from traditional Chinese medicines[J]. Journal of Cheminformatics, 2012, 4(1): 1-13.
[14] DONCHEVA N T, MORRIS J H, GORODKIN J, et al. Cytoscape StringApp: Network analysis and visualization of proteomics data[J]. Journal of Proteome Research, 2019, 18(2): 623-632.
[15] HUANG D W, SHERMAN B T, TAN Q N, et al. DAVID Bioinformatics Resources: Expanded annotation database and novel algorithms to better extract biology from large gene lists[J]. Nucleic Acids Research, 2007, 35(suppl_2): W169-W175.
[16] GAILLARD T. Evaluation of AutoDock and AutoDock vina on the CASF-2013 benchmark[J]. Journal of Chemical Information and Modeling, 2018, 58(8): 1697-1706.
[17] 于大鹏,孙卫强.骨碎补及其提取物应用于骨科疾病的药理作用研究概况[J].环球中医药,2021,14(4):761-766.
[18] 鲁亚奇,张 晓,王金金,等.补骨脂化学成分及药理作用研究进展[J].中国实验方剂学杂志,2019,25(3):180-189.
[19] BAEK Y, LEE M N, WU D, et al. Luteolin reduces adipose tissue macrophage inflammation and insulin resistance in postmenopausal obese mice[J]. The Journal of Nutritional Biochemistry, 2019, 71: 72-81.
[20] 刘 杨,吕冰清,吴玉梅,等.木犀草素抑制类风湿关节炎大鼠NLRP3炎性小体活化增强关节骨保护作用研究[J].中华中医药杂志,2021,36(1):513-516.
[21] 崔琳娜,蒋校文,黄华庆,等.山奈酚通过mTORC1信号促进牵张力下小鼠骨髓间充质细胞成骨分化机制研究[J].口腔疾病防治,2021,29(4):234-240.
[22] 程杏安,周晓武,张淑明,等.植物甾醇对黑色素瘤细胞的生长抑制及凋亡诱导作用[J].广东农业科学,2014,41(10):94-97,4.
[23] WALKER C I B, OLIVEIRA S M, TONELLO R, et al. Anti-nociceptive effect of stigmasterol in mouse models of acute and chronic pain[J]. Naunyn-Schmiedeberg's Archives of Pharmacology, 2017, 390(11): 1163-1172.
[24] 李洪波,魏云鹏,杨 芳,等. 补骨脂素对大鼠骨髓间充质干细胞成骨分化的影响[J].解剖科学进展,2020,26(1):18-21,26.
[25] 李劲平,谢保平,章文娟,等.补骨脂素通过调控CD4+T细胞分化抑制RAW264.7向破骨细胞分化和骨吸收[J].中国中药杂志,2018,
43(6):1228-1234.
[26] 杨胜杰,钟少达,杨进平,等.补骨脂酚的提取纯化工艺优选及其对骨质疏松症的治疗作用分析[J].中国实验方剂学杂志,2017,23(22):43-47.
[27] ISTYASTONO E P, RADIFAR M, YUNIARTI N, et al. PyPLIF HIPPOS: A molecular interaction fingerprinting tool for docking results of AutoDock vina and PLANTS[J]. Journal of Chemical Information and Modeling, 2020, 60(8): 3697-3702.
[28] ZAJ?CZKOWSKA R, KOCOT-K?PSKA M, LEPPERT W, et al. Bone pain in cancer patients: Mechanisms and current treatment[J]. International Journal of Molecular Sciences, 2019, 20(23): 6047.
[29] CHEN Y, ALMAN B A. Wnt pathway, an essential role in bone regeneration[J]. Journal of Cellular Biochemistry, 2009, 106(3): 353-362.
[30] ALBERS J, KELLER J, BARANOWSKY A, et al. Canonical Wnt signaling inhibits osteoclastogenesis independent of osteoprotegerin[J]. The Journal of Cell Biology, 2013, 200(4): 537-549.
[31] SHEN Z, CHEN Z H, LI Z G, et al. Total flavonoids of rhizoma drynariae enhances angiogenic-osteogenic coupling during
distraction osteogenesis by promoting type H vessel formation through PDGF-BB/PDGFR-β instead of HIF-1α / VEGF axis[J]. Frontiers in Pharmacology, 2020, 11: 503524.
[32] 李啸群,徐凯航,纪 方.补骨脂异黄酮抑制破骨细胞分化缓解小鼠去卵巢骨质疏松[J].中国组织工程研究,2021,25(2):186-190.
[33] DEMIR I E, TIEFTRUNK E, SCHORN S, et al. Activated Schwann cells in pancreatic cancer are linked to analgesia via suppression of spinal astroglia and microglia[J]. Gut, 2016, 65(6): 1001-1014.
[34] 李秋月,許海玉,杨洪军.促炎因子TNF-α,IL-1β,IL-6在神经病理性疼痛中的研究进展[J].中国中药杂志,2017,42(19):3709-3712.
[35] 侯公瑾,柏正平,曾普华,等.蟾龙镇痛膏对骨转移性癌痛模型大鼠疼痛阈值及血清PGE2、TNF-α、IL-6、β-EP的影响[J].中药新药与临床药理,2019,30(10):1222-1227.
[36] HU X M, LIU Y N, ZHANG H L, et al. CXCL12/CXCR4 chemokine signaling in spinal Glia induces pain hypersensitivity through MAPKs-mediated neuroinflammation in bone cancer rats[J]. Journal of Neurochemistry, 2015, 132(4): 452-463.
[37] DUTRA R C, BICCA M A, SEGAT G C, et al. The antinociceptive effects of the tetracyclic triterpene euphol in inflammatory and neuropathic pain models: The potential role of PKCε[J]. Neuroscience, 2015, 303: 126-137.
[38] 贺端端,郭向阳.cAMP-PKA信号通路介导大鼠骨癌痛的产生和维持[J].中国疼痛医学杂志,2015,21(1):10-14.
[39] BOURINET E, ALTIER C, HILDEBRAND M E, et al. Calcium-permeable ion channels in pain signaling[J]. Physiological Reviews, 2014, 94(1): 81-140.
[40] YANG F, LUO W J, SUN W, et al. SDF1-CXCR4 signaling
maintains central post-stroke pain through mediation of glial-neur?
onal interactions[J]. Frontiers in Molecular Neuroscience, 2017, 10: 226.
[41] SELVARAJ D, GANGADHARAN V, MICHALSKI C W, et al. A functional role for VEGFR1 expressed in peripheral sensory neurons in cancer pain[J]. Cancer Cell, 2015, 27(6): 780-796.
[42] WANG S, LIU S Y, XU L P, et al. The upregulation of EGFR in the dorsal root ganglion contributes to chronic compression of dorsal root ganglions-induced neuropathic pain in rats[J]. Molecular Pain, 2019, 15: 174480691985729.
[43] YAN X T, XU Y, CHENG X L, et al. SP1, MYC, CTNNB1, CREB1, JUN genes as potential therapy targets for neuropathic pain of brain[J]. Journal of Cellular Physiology, 2019, 234(5): 6688-6695.
[44] JIN D, YANG J P, HU J H, et al. MCP-1 stimulates spinal
microglia via PI3K/Akt pathway in bone cancer pain[J]. Brain Research, 2015, 1599: 158-167.
[45] 袁翠堂,丁 罡,廖志軍,等.大鼠乳腺癌骨转移模型中PI3K/Akt信号通路参与诱导疼痛[J].实用癌症杂志,2016,31(3):349-352,358.

