七氟烷暴露促发Caspase-8/GSDME细胞焦亡诱导海马神经元损伤的形态和蛋白变化特征
雷华娟 丁振东 税林辉 周宁博 陈梦 冯渝 李美静 刘柏炎
〔摘要〕 目的 观察七氟烷干预下海马神经元焦亡过程的形态学变化及神经元相关蛋白表达特征。方法 海马神经元随机分为对照组和七氟烷组(6、12、24、48 h组)。对照组暴露于21% O2、5% CO2 3 h,七氟烷组暴露于4.1%七氟烷、21% O2、5% CO2 3 h,七氟烷4个亚组根据七氟烷暴露3 h后的4个不同观察时间点进行分组。应用显微镜观察神经元形态变化,用尼氏染色检测对照组及48 h组海马神经元细胞内尼氏体个数和突触变化,采用Western blot法检测各组Caspase-8、Caspase-3、功能蛋白D(gasdermin D, GSDMD)、功能蛋白E(gasdermin E, GSDME)和α-氨基-3-羟基-5-甲基-4-异恶唑丙酸受体1(α-amino-3-hydroxy-5-methyl-4-isoxazolepropionic acid receptor, AMPAR1)的表达水平。结果 普通显微镜下观察到,6 h组细胞变化不明显;12 h组细胞疏松、水肿和孔洞形成;24 h组见细胞量降低、突触减少、部分细胞膜破裂;48 h组细胞量明显减少并出现大量的凋亡。尼氏染色显示,48 h组大鼠海马神经元排列散乱、神经元数量明显减少、细胞皱缩、胞体缩小、部分树突消失、轴突延长,尼氏体数量较对照组减少,差异有统计学意义(P<0.05)。Western blot法检测显示:Caspase-3表达活性在6、12、24 h组明显高于对照组(P<0.05);Caspase-8表达活性在七氟烷4个组都增加,其中12、24、48 h组与对照组比较,差异有统计学意义(P<0.05);GSDME表达活性在七氟烷4个组都增加,12、24、48 h组与对照组以及6 h组比较,差异均有统计学意义(P<0.05);与对照组比较,GSDMD表达活性在 6 h组下降(P<0.05),12 h组增加,24、48 h组恢复正常值,但差异均无统计学意义(P>0.05);与对照组比较,AMPAR1表达活性在24 h组下降至最低,48 h组回升但未恢复至正常水平,差异均有统计学意义(P<0.05)。結论 正常的海马神经元表达炎性因子Caspase-3和GSDMD,七氟烷暴露使Caspase-8激活,导致GSDME介导神经元焦亡,并改变海马神经元突触的可塑性。
〔关键词〕 海马神经元;焦亡;突触可塑性;七氟烷;GSDMD;GSDME
〔中图分类号〕R614 〔文献标志码〕A 〔文章编号〕doi:10.3969/j.issn.1674-070X.2021.09.002
Characteristics of Morphology and Protein Changes in the Process of Caspase-8/GSDME Induced Hippocampus Neuron Pyroptosis After Sevoflurane Exposure
LEI Huajuan1,2, DING Zhendong1, SHUI Linghui1, ZHOU Ningbo1, CHEN Meng1, FENG Yu2, LI Meijing2, LIU Boyan2*
(1. Department of Anesthesiology of The First Affiliated Hospital of Hunan University of Chinese Medicine, Changsha, Hunan 410007, China; 2. Hunan University of Chinese Medicine, Changsha, Hunan 410208, China)
〔Abstract〕 Objective To observe the morphological changes of hippocampal neurons and the expression characteristics of neuron-relatedproteins under the intervention of sevoflurane induced pyroptosis. Methods Hippocampal neurons were random
divided into control group and sevoflurane group(6 h, 12 h, 24 h, 48 h group). Control group exposed to 21% O2, and 5% CO2 for 3 hours. Sevoflurane group exposed to 4.1% sevoflurane, 21% O2, and 5% CO2 for 3 hours, sevoflurane group was divided into 4 subgroups according to 4 different times after sevoflurane exposure for 3 hours. The morphological changes of neurons were observed under a microscope, and Nissl staining was used to check the number of Nissl bodies and synaptic changes in the cells on 48 h group and control group. Western blot was used to detect the expression levels of Caspase-8, Caspase-3, GSDMD, GSDME and AMPAR1 receptor. Results We observed with common microscope and discovered that there were not significant morphological changes on 6 h group; on 12 h group, the cells were loose, edema and holes were formed; on 24 h group, the number of cells and synapses decreased, partial cell membrane ruptured were observed; on 48 h group, the number of neurons was significantly reduced and a large number of cells apoptosis appeared. Nissl staining showed that the hippocampal neurons on 48 h group were disorderly arranged, the number of neurons was significantly reduced, cell shrinkage, the cell body was shrunk, some dendrites disappeared, and axons prolonged, compared with control group, the number of Nissl bodies on 48 h group decreased, difference has statistically significant (P<0.05). Western blot analysis showed that compared with control group, the expression activity of Caspase-3 increased significantly on 6, 12, 24 h group (P<0.05). The expression activity of Caspase-8 increased on sevoflurane 4 groups. Compared with control group, the difference of Caspase-8 was statistically significant on 12, 24, 48 h group (P<0.05). GSDME expression increased on sevoflurane 4 groups, the difference of GSDME was statistically significant on 12, 24, 48 h group compared with 6 h group and control group. GSDMD expression activity decreased on 6 h group, increased on 12 h group, then returned to normal on 24, 48 h group, but there was not statistically different from the control group (P>0.05). The expression of AMPAR1 receptor declined to the lowest level on 24 h group, and gradually restored on 48 h group, there were statistically differences from the control group (P<0.05). Conclusion Normal hippocampal neurons express inflammatory factors Caspase-3 and GSDMD. Sevoflurane exposure activates Caspase-8, leading GSDME mediated neuron pyroptosis and changes the synaptic plasticity of hippocampal neurons.
〔Keywords〕 hippocampal neurons; pyroptosis; synaptic plasticity; sevoflurane; GSDMD; GSDME
海马是学习、记忆等认知功能的高级中枢,海马神经元也是中枢神经系统执行任务的主体。吸入麻醉药七氟烷暴露后对海马神经元认知功能的损伤已经在全球范围内受到广泛的重视。但是,目前七氟烷暴露导致海马认知功能损伤的作用机制尚未研究清楚。炎症[1]、钙超载[2]、凋亡[3]、铁死亡[4]等是七氟烷致海马损伤的可能机制。目前,最新的研究[5]证明,凋亡抑制剂并不能抑制七氟烷对海马神经元的损伤作用。有报导[6]称Caspase-1和Caspase-3触发的焦亡可以损伤七氟烷暴露后海马神经元,因此,焦亡可能是七氟烷暴露导致海马损伤的可能机制之一。焦亡是依赖Caspase家族启动炎性的程序性细胞死亡,表现为成熟的半胍氨酸作用于功能蛋白 D (gasdermin D, GSDMD)或者功能蛋白 E(gasdermin E, GSDME),可以在细胞膜上打孔,导致细胞内外离子梯度消失,释放炎症因子以诱发神经元焦亡[7]。目前,尚未有Caspase-8/GSDME信号通路诱导七氟烷暴露促发细胞焦亡而损伤海马神经元可塑性的相关报道。本实验提出假说,Caspase-8/GSDME焦亡通路介导七氟烷暴露后海马神经元损伤,导致海马神经元突触形态和功能的可塑性改变,并探索非经典Caspase-8/GSDME焦亡通路在七氟烷暴露致海马神经元损伤中的作用,为临床更好地防治七氟烷类麻醉剂暴露所致脑损伤提供实验依据。
1 材料与方法
1.1 细胞系
H19-7海马神经元(深圳豪地华拓生物公司,批号:HTX4064)饲养于湖南中医药大学诊断实验室。
1.2 试剂与仪器
七氟烷(江苏恒瑞医药有限公司,批号:16043031); 兔抗大鼠Anti-Caspase 8多克隆抗体(批号: ab25901);兔抗大鼠Anti-Caspase 3多克隆抗体(批号:ab25901)、兔抗大鼠Anti-GSDME多克隆抗体(批号:ab215191)、兔抗大鼠Anti-GSDMD多克隆抗体(批号:ab219800)、兔抗大鼠Anti-AMPAR1多克隆抗体(批号:ab109182)均购自英国艾碧康公司。
5415R型小型冷冻离心机(德国Eppendorf公司);TG22-WS台式高速离心机(长沙湘锐离心机有限公司);DSX100光学显微镜(日本奥林巴斯公司);GNP-9080型培养箱:隔水式恒温培养箱(长沙湘锐离心机有限公司);Eppendorf型CO2培养箱(上海艾本德中国有限公司);自制麻醉箱。
1.3 海马神经元培养
生长旺盛的海马神经元种植于含有89% DMEM、10% FBS、4×104 U/L青霉素和0.1 g/L链霉素的细胞培养基中,置于湿度为80%、含5% CO2的培养箱内培养。根据细胞生长速度,每1~2 d更换培养液,对培养瓶中细胞传代培养,并在2~3周内使用。需要进行形态学观察及Western blot检测的细胞在使用前转移到10 cm×10 cm大小的培养皿中,待细胞长满70%,然后均放到麻醉箱用4.1%七氟烷培养6、12、24、48 h。
1.4 显微镜下观察七氟烷干预下海马神经元的细胞形态学
将H19-7神经元种植到6孔板内培养1 d以及包被聚乙烯亚胺的盖玻片上培养2 d,待神经元生长到70%后开始进行干预,取出种植于6孔板中的海马神经元细胞,随机分为对照组、七氟烷组(6、12、24、48 h组[8])。对照组在21% O2、5% CO2条件下处理3 h;七氟烷组(6、12、24、48 h组)在4.1%七氟烷、21% O2、5% CO2条件下处理3 h。干预3 h后,分别将各组海马神经元细胞放入CytationTM 5细胞成像多功能检测系统和显微镜内,观察细胞形态并拍照。
1.5 尼氏染色分析七氟烷暴露下的海马神经元
种植于6孔板中的对照组、48 h组的海马神经元用4%多聚甲醛固定10 min,蒸馏水洗涤2 min,换用新鲜的蒸馏水,再洗涤2 min。尼氏染色液染色10 min,蒸馏水洗涤2次。95%乙醇脱水约5 s,用70%乙醇脱水2次,最后用95%乙醇脱水1次,二甲苯透明,用中性树胶封片,在显微镜下观察细胞尼氏小体和神经元树突。
1.6 Western blot检测七氟烷暴露下的海马神经元蛋白变化
处理结束后6、12、24、48 h分别收集各组海马神经元细胞,用细胞刮刀把海马神经元细胞从培养皿中刮下,然后PBS清洗,加入RIPA细胞裂解液,冰上裂解细胞30 min,提取总蛋白,应用Bradford比色法测定蛋白含量。取20 μg蛋白上样,进行电泳、转膜、封闭、孵抗体、显影,采用Western blot检测GAPHD、Caspase-3、Caspase-8、GSDMD、GSDME和APMPAR1的表达情况。目的蛋白相对表达量=目的蛋白/GAPHD,实验重复3次。
1.7 統计学处理
采用SPSS 18.0统计软件进行数据统计分析。计量资料用“x±s”表示,方差不齐者采用秩和检验,多组方差齐者,组间比较采用单因素方差分析,两两比较采用LSD法。P<0.05表示差异有统计学意义。
2 结果
2.1 海马神经元形态特征的动态变化情况
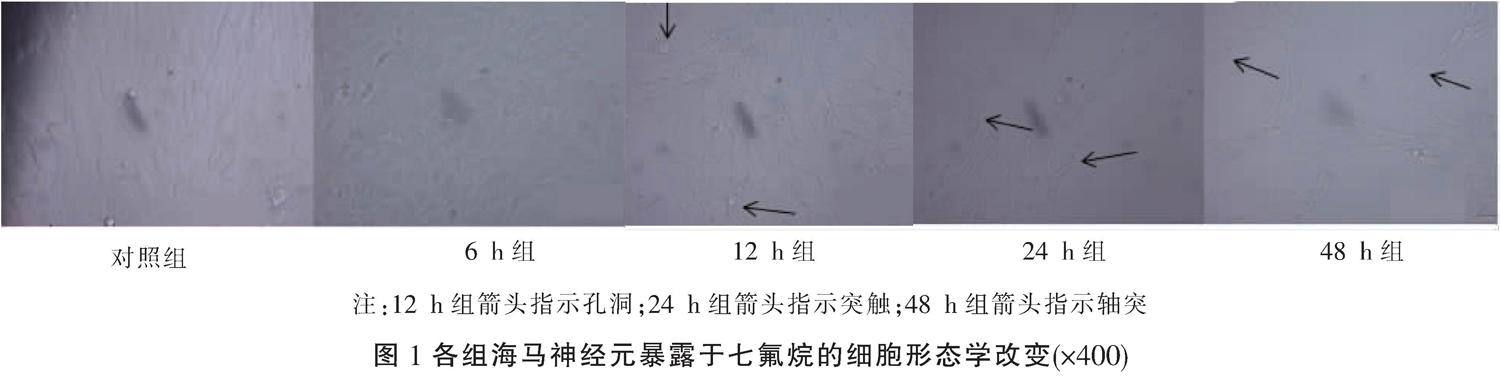
对照组海马神经元细胞核和细胞体较小,细胞突触细长,细胞量多,连接紧密;6 h组细胞形态变化不大,细长的突触仍然很明显;12 h组细胞数量变化不大,表现为细胞核、细胞体比对照组大,细胞连接疏松,细胞内水分增多,部分细胞孔洞形成(箭头处);24 h组细胞数量减少,细胞核和细胞体明显变大,细胞膜破裂,突触变宽变短,突触明显减少(箭头处);48 h组细胞数量减少,细胞核和细胞体小,细胞突触更少、变得更短,细胞膜皱缩,轴突延长(箭头处)。见图1。
2.2 海马神经元尼氏染色结果
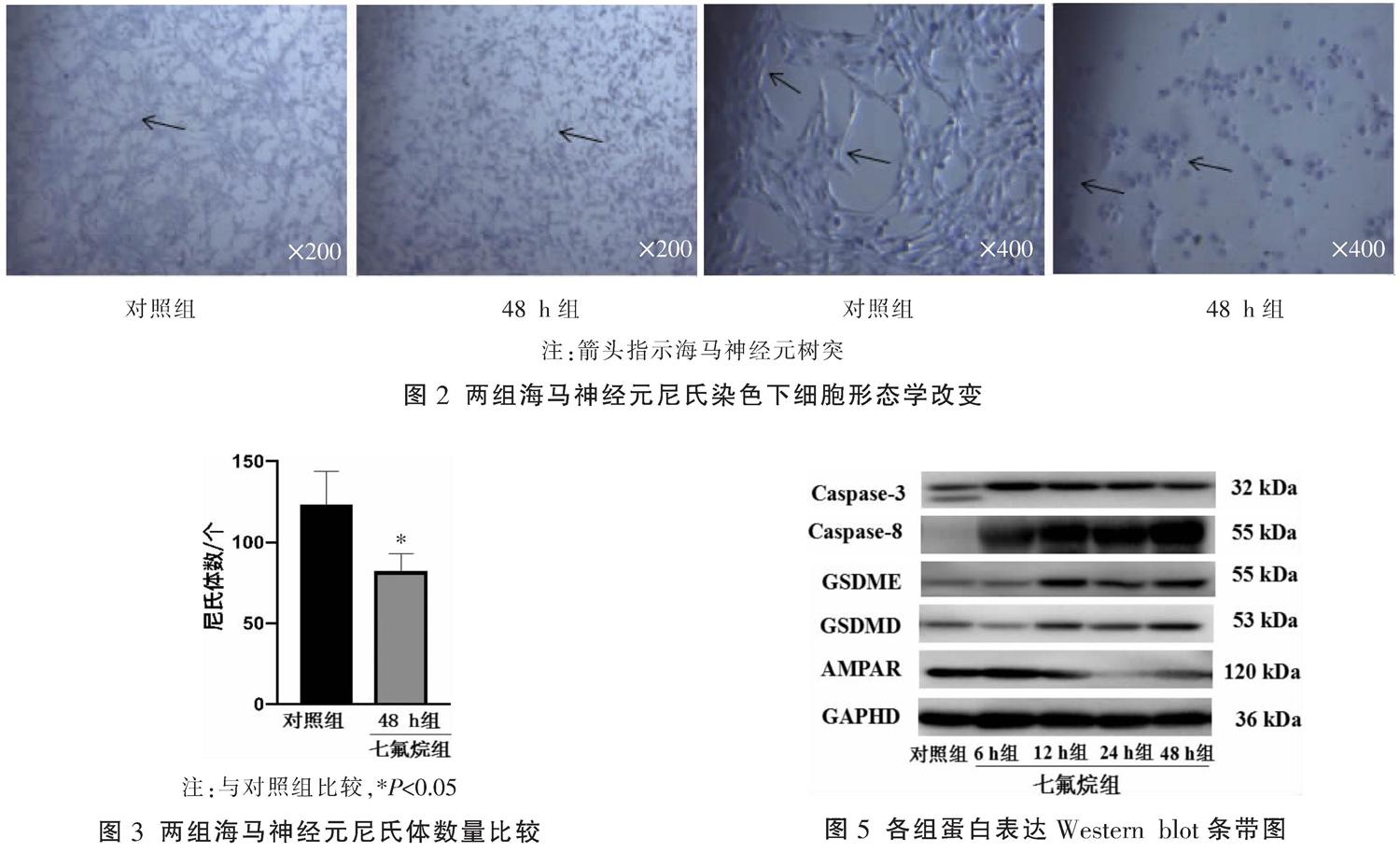
48 h组细胞出现大面积的皱缩,细胞核浓缩,神经元变小,突触减少或者消失,海马神经元排列散乱,数量明显减少,细胞间距增大,胞体缩小,细胞皱缩,核固缩严重,部分树突消失,轴突延长。与对照组比较,48 h组尼氏体数量明显减少,差异有统计学意义(P<0.05)。见图2-3。
2.3 海马神经元蛋白表达结果
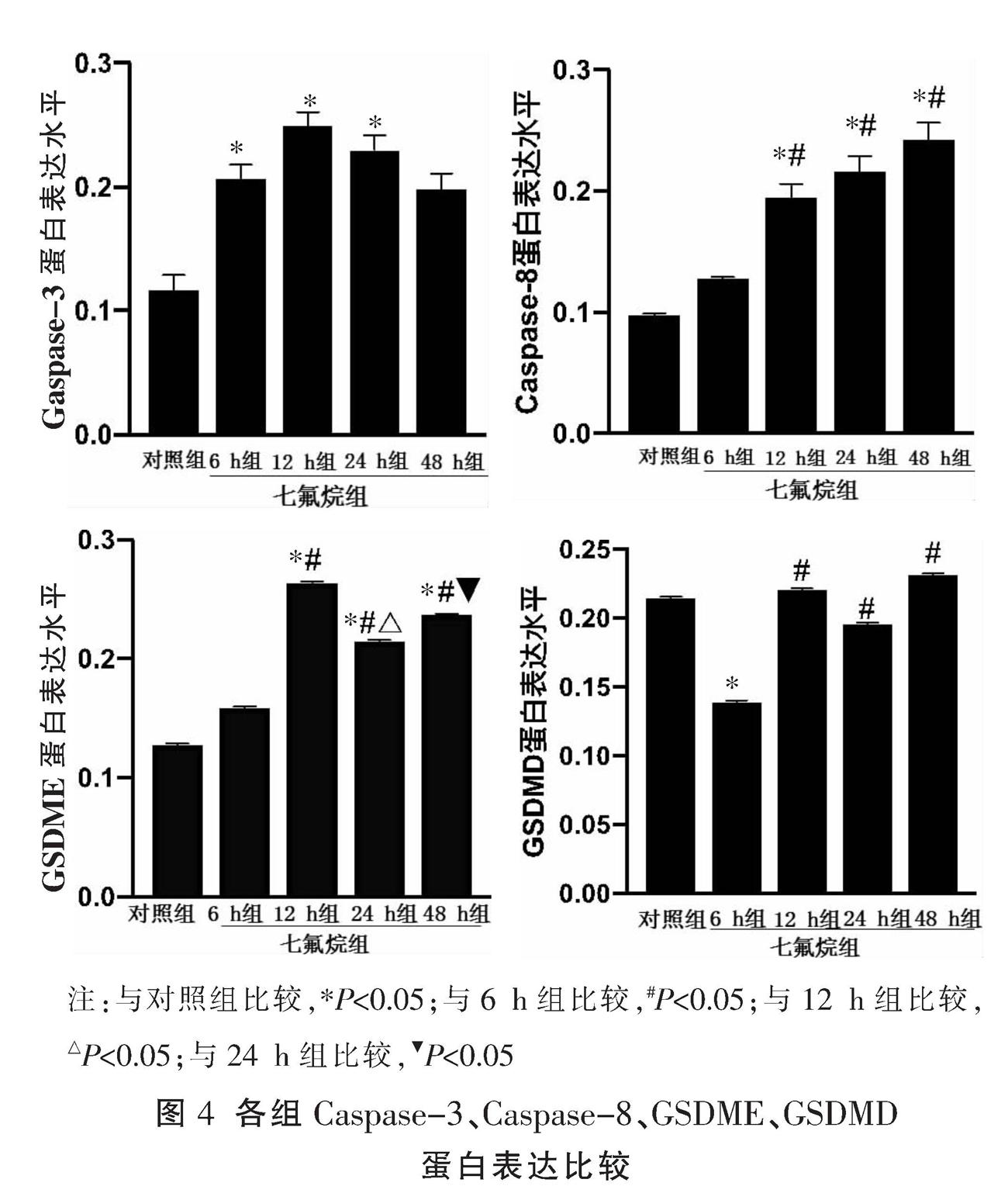
2.3.1 焦亡相关蛋白表达情况 七氟烷4组的Caspase-3表达均较对照组增高,6、12、24 h组差异有统计学意义(P<0.05)。七氟烷4组的Caspase-8表达且呈上升趋势,其中12、24、48 h组与对照组及6 h组比较,差异均有统计学意义(P<0.05)。与对照组比较,七氟烷4组的GSDME表达均增加,12、24、48 h组与对照组及6 h组比较,差异均有统计学意义(P<0.05)。6 h组的GSDMD表达明显低于对照组,差异有统计学意义(P<0.05),12、24、48 h组表达高于6 h组,差异有统计学意义(P<0.05)。见图4-5。
2.3.2 突触蛋白表达情况 与对照组比较,6 h组的AMPAR1表达增加,12 h组表达下降,但差异均无统计学意义(P>0.05),24 h组AMPAR1蛋白表达较对照组及6、12 h组急剧下降,差异有统计学意义(P<0.05),48 h表达回升,但未恢复到正常水平,与对照组、6 h组比较,差异有统计学意义(P<0.05)。见图5-6。
3 讨论
焦亡是炎性小体促发的、依赖Caspase蛋白激活的另外一种程序性细胞死亡方式[9]。当机体感受到病原体相关的分子模式(pathogen-associated
molecular patterns, PAMPs)或损伤相关模式(damage associated molecular patterns, DAMPs)刺激后,PAMPs或DAMPs激活NOD样受体蛋白(nucleotide-binding oligomerization domain-like receptor, NLRP)炎性小体,包括NLRC4、NLRP1、NLRC4,或Pyrin炎性蛋白和黑色素瘤2(melanoma 2, AMA2)炎性小体,通过接头蛋白ASC将Caspase蛋白前体加工后产生活性Caspase蛋白[9]。活性Caspase蛋白激活GSDMD或者GSDME以诱发焦磷酸化而切割GSDMD或者GSDME,被切割的GSDMD或者GSDME释放其活性N端结构域,在细胞膜上打孔促发细胞焦亡,表现为细胞内水分渗透,最终导致细胞肿胀、破裂坏死[10-13],活性Caspase蛋白可以促进IL-1β、IL-18成熟并通过破裂的细胞膜释放到细胞外,募集更多的炎症因子产生炎症放大效应[13]。因此,焦亡除了限制和破坏细胞内感染因素外,还在清除内源性危险信号中发挥重要的作用[9]。经典的焦亡途径依托Caspase-1,而非经典焦亡途径依托Caspase-4/5/8/9/11[11]。
Caspase-1蛋白是诱发焦亡的经典核心因子,参与包括眼科[14]和多种中枢系统疾病的产生,受胞内多蛋白复合物炎性小体,特别是NLRP炎性小体家族、AMA2和Pyrin炎性蛋白调控充当支架以募集Caspase家族,并促进炎症因子产生[15]。Caspase-8与胍天蛋白募集区(caspase recruitment domain, CARD)特异性结合发挥重要作用[16]。本实验结果表明:可能是Caspase-8/GSDME促发了焦亡而不是凋亡诱导七氟烷暴露后的海马神经元损伤。Caspase-8既往在肿瘤发生中倍受关注[17],而其在中枢神经系统中的研究相对较少。本研究发现七氟烷暴露后,海马神经元感受到氧化应激的刺激,Caspase-8被活化,并激活和裂解GSDME,裂解GSDME释放其活性N端结构域在细胞膜上打孔,表现为七氟烷暴露12 h时,细胞体变大、细胞连接疏松、细胞内水分增多;海马神经元七氟烷暴露24 h时,细胞核和细胞体明显变大、细胞膜破裂,且发生海马神经元树突突触变短、轴突延长等可塑性变化。
细胞焦亡触发的炎症反应可损伤神经元的可塑性。最新研究[18]发现,Aβ诱导激活NLRP3/Caspase-1/GSDMD通路介导海马和皮质神经元焦亡,产生ROS及大量炎症诱导阿尔茨海默病发生,导致神经元突触减少或者消失,神经元轴索损伤,最终导致神经元的死亡;基因敲除Caspase-1的大鼠通过沉默Caspase-1表达抑制的焦亡,减少海马、皮质神经元损伤,增加神经元突触可塑性而改善认知功能[19]。在链霉素诱导的痴呆模型中发现类似的结果,NLRC4炎性小体介导Caspase-1损伤海马神经元突触可塑性[17]。研究[20]发现,脂肪因子Chemerin注射的妊娠期糖尿病模型,母鼠通过NLRP3/Caspase-1/GSDMD通路介导的巨噬细胞焦亡,大量释放IL-1、IL-6和TNF-α因子和产生炎症聚集效应,导致子代胎儿海馬神经元丢失,损害神经元的可塑性。本研究的细胞实验发现同样的结果,七氟烷暴露诱导神经元焦亡,抑制突触蛋白AMPAR1表达,导致受损神经元的树突变短、突触面积减少,而损伤突触可塑性。目前,有研究[21]报导,七氟烷激活Caspase-3引发炎症反应而诱导海马神经元的凋亡是七氟烷暴露后神经元损伤的主要机制,但是抗凋亡并不能缓解七氟烷暴露后的海马神经元损伤,而且凋亡也不会表现为细胞膜穿孔和破裂,说明七氟烷暴露后海马神经元焦亡的发生早于凋亡,焦亡是七氟烷暴露海马神经元损伤的重要机制之一。
综上所述,海马神经元Caspase-8/GSDME通路诱导神经元焦亡并改变神经元突触可塑性是七氟烷暴露海马神经元损伤的分子机制,Caspase-8具有焦亡和炎症的双重作用,值得进一步探讨,七氟烷暴露后诱导Caspase-8/GSDME通路触发海马神经元焦亡为临床合理使用和防治七氟烷所致的脑损伤提供实验基础。
参考文献
[1] YE J S, CHEN L, LU Y Y, et al. Honokiol-mediated mitophagy ameliorates postoperative cognitive impairment induced by surgery/sevoflurane via inhibiting the activation of NLRP3 inflammasome in the Hippocampus[J]. Oxidative Medicine and Cellular Longevity, 2019, 2019: 8639618.
[2] ZHU X Q, YAO Y Y, GUO M Y, et al. Sevoflurane increases intracellular calcium to induce mitochondrial injury and neuroapo?
ptosis[J]. Toxicology Letters, 2021, 336: 11-20.
[3] OZER A B, CERIBASI S, CERIBASI A O, et al. Effects of sevoflurane on apoptosis, BDNF and cognitive functions in neonatal rats[J]. Bratislavske Lekarske Listy, 2017, 118(2): 80-84.
[4] WU J, YANG J J, CAO Y, et al. Iron overload contributes to general anaesthesia-induced neurotoxicity and cognitive deficits[J]. Journal of Neuroinflammation, 2020, 17(1): 110.
[5] LIAO Z, LI J, MIAO L, et al. Inhibition of RhoA activity does not rescue synaptic development abnormalities and long-term cognitive impairment after sevoflurane exposure[J]. Neurochemical Research, 2021, 46(3): 468-481.
[6] BERGSBAKEN T, FINK S L, COOKSON B T. Pyroptosis: host cell death and inflammation[J]. Nature Reviews Microbiology, 2009, 7(2): 99-109.
[7] XIA S Y, HOLLINGSWORTH L R IV, WU H. Mechanism and regulation of gasdermin-mediated cell death[J]. Cold Spring Harbor Perspectives in Biology, 2020, 12(3): a036400.
[8] 吕静静.七氟烷对大鼠胚胎神经干细胞的活性、增殖、分化的影响及其可能机制研究[D].合肥: 安徽医科大学,2016:1-51.
[9] SAGULENKO V, VITAK N, VAJJHALA P R, et al. Caspase-1 is an apical caspase leading to caspase-3 cleavage in the AIM2 inflammasome response, independent of caspase-8[J]. Journal of Molecular Biology, 2018, 430(2): 238-247.
[10] SHI J J, ZHAO Y, WANG K, et al. Cleavage of GSDMD by inflammatory caspases determines pyroptotic cell death[J]. Nature, 2015, 526(7575): 660-665.
[11] SBORGI L, R?HL S, MULVIHILL E, et al. GSDMD membrane pore formation constitutes the mechanism of pyroptotic cell death[J]. The EMBO Journal, 2016, 35(16): 1766-1778.
[12] AGLIETTI R A, ESTEVEZ A, GUPTA A, et al. GsdmD p30 elicited by caspase-11 during pyroptosis forms pores in membranes[J]. Proceedings of the National Academy of Sciences of the United States of America, 2016, 113(28): 7858-7863.
[13] LIU X, ZHANG Z B, RUAN J B, et al. Inflammasome-activated gasdermin D causes pyroptosis by forming membrane pores[J]. Nature, 2016, 535(7610): 153-158.
[14] 李 翔,覃艮艳,彭 俊,等.密蒙花颗粒剂对去势雄兔泪腺组织细胞Caspase-1和IL-18的影响[J].湖南中医药大学学报,2019, 39(12):1440-1443.
[15] MAN S M, KANNEGANTI T D. Converging roles of caspases in inflammasome activation, cell death and innate immunity[J]. Nature Reviews Immunology, 2016, 16(1): 7-21.
[16] PARK H H, LO Y C, LIN S C, et al. The death domain superfamily in intracellular signaling of apoptosis and inflammation[J]. Annual Review of Immunology, 2007, 25: 561-586.
[17] MANDAL R, BARRN J C, KOSTOVA I, et al. Caspase-8: The double-edged sword[J]. Biochimica et Biophysica Acta Reviews on Cancer, 2020, 1873(2): 188357.
[18] HAN C Y, YANG Y, GUAN Q B, et al. New mechanism of nerve injury in Alzheimers disease: β-amyloid-induced neuronal pyroptosis[J]. Journal of Cellular and Molecular Medicine, 2020, 24(14): 8078-8090.
[19] SAADI M, KARKHAH A, POURABDOLHOSSEIN F, et al. Involvement of NLRC4 inflammasome through caspase-1 and IL-1β augments neuroinflammation and contributes to memory impairment in an experimental model of Alzheimer's like disease[J]. Brain Research Bulletin, 2020, 154: 81-90.
[20] LIANG Z X, HAN L Y, SUN D, et al. Chemerin-induced
macrophages pyroptosis in fetal brain tissue leads to cognitive disorder in offspring of diabetic dams[J]. Journal of Neuroinflammation, 2019, 16(1): 226.
[21] WU X Y, ZHANG Y L, XIA H L, et al. LIMK1 attenuates sevoflurane-induced neurodevelopmental toxicity through caspase-3 / cofilin/PARP-1 pathway[J]. Journal of Biological Regulators and Homeostatic Agents, 2020, 34(5): 1923-1928.

