3种抗心血管病中成药对大鼠肝微粒体CYP4504种亚型的体外活性影响研究
黄茹润 杨娇 刘姗 母育成 赖泳

【摘 要】 目的:評价参松养心胶囊、芪苈强心胶囊和通脉养心丸3种抗心血管疾病的中成药对大鼠肝微粒体CYP450酶4种亚型CYP1A2、CYP2C11、CYP2D1和CYP3A1的体外活性影响。方法:选取15.04 μmol·L-1咖啡因、4.98 μmol·L-1奥美拉唑、7.81 μmol·L-1美托洛尔和6 μmol·L-1咪达唑仑分别为CYP1A2、CYP2C11、CYP2D1和CYP3A1特异性探针底物,三种抗心血管疾病的中成药分别与4种CYP450酶亚型的混合探针底物在大鼠肝微粒体中共孵育,HPLC测定大鼠肝微粒体孵育体系中探针底物剩余量,求出相应酶活性抑制百分数并计算IC50值。结果:与空白组比较,随着三药浓度增高各亚酶活性呈降低趋势(P<0.05);三药对大鼠肝微粒体CYP1A2、CYP2C11、CYP2D1、CYP3A1的IC50值分别为:参松养心胶囊1.896、31.97、12.37、1.357 μmol·L-1;芪苈强心胶囊 >100、1.513、35.2、6.669 μmol·L-1;通脉养心丸 >100、33.970、0.566、14.380 μmol·L-1。结论:参松养心胶囊对CYP1A2、CYP3A1有中度抑制作用,芪苈强心胶囊对CYP2C11、CYP3A1有中度抑制作用,通脉养心丸对CYP2D1有强抑制作用,其余作用不明显。
【关键词】 大鼠肝微粒体;参松养心胶囊;芪苈强心胶囊;通脉养心丸;CYP450酶
【中图分类号】R965 【文献标志码】 A 【文章编号】1007-8517(2021)17-0030-08
Effects of three Chinese Patent Medicines Against Cardiovascular Disease on the in Vitro Activity of four Subtypes of Liver Microsomal Cytochrome P450 in Rats
HUANG Rurun YANG Jiao LIU Shan MU Yucheng LAI Long*
Department of Pharmacology,College of Pharmacy,Dali University,Dali 671000,China
Abstract:Objectives To evaluate the effects of Shensong Yangxin capsule,Qili Qiangxin capsule and Tongmai Yangxin Pill on the in vitro activities of four subtypes of liver microsomal CYP450 enzyme CYP1A2,CYP2C11,CYP2D1 and CYP3A1 in rats. Methods 15.04 μmol·L-1Caffeine,4 .98 μmol·L-1omeprazole,7.81 μmol·L-1metoprolol and 6 μmol·L-1midazolam were selected as CYP1A2,CYP2C11,CYP2D1 and CYP3A1 specific probe substrates,respectively. The residual probe substrates in rat liver microsome incubation system were determined by HPLC,the corresponding enzyme activity percentage was calculated and IC50value was calculated,and then the effects of the three drugs on the activity of rat liver microsomal subenzymes in vitro were evaluated.Results The results showed that the IC50values of Shensong yangxin capsules on rat liver microsomes CYP1A2,CYP2C11,CYP2D1 and CYP3A1 were 1.896,12.37,31.97 and 1.357 μmol·L-1. The IC50values of Qili Qiangxin capsules on rat liver microsomes CYP2C11,CYP3A1,and CYP2D1 were 1.513,6.669,and 35.2 μmol·L-1,respectively,and IC50values of CYP1A2 were greater than 100 μmol·L-1. The IC50values of Tongmai Yangxin pill for CYP2C11,CYP2D1,and CYP3A1 were 33.970,0.566,and 14.380 μmol·L-1,respectively,and IC50values for CYP1A2 were greater than 100 μmol·L-1. Conclusion Shensong Yangxin capsule had moderate inhibitory effect on CYP1A2 and CYP3A1,but no obvious inhibitory effect on CYP2C11 and CYP2D1,Qili Qiangxin capsule had moderate inhibitory effect on CYP2C11 and CYP3A1,but had no obvious effect on CYP1A2 and CYP2D1,Tongmai Yangxin Pill had strong inhibitory effect on CYP2D1 and had no obvious effect on CYP1A2,CYP2C11 and CYP3A1.
Keywords:Rat liver microsome; Shensong yangxin capsules; Qili qiangxin capsules; Tongmai yangxin pills; CYP450
随着人们膳食结构的改变,加之社会人口老龄化,心血管系统疾病的发病率和死亡率已明显增多,严重威胁着人类的健康,目前主要以化学药治疗心血管疾病,但化学药的不良反应会限制其使用,如噻嗪类利尿药可能导致低血钾、高尿酸、高血糖;肾素-血管紧张素转化酶抑制剂类药物易产生干咳;钙拮抗剂可能引起外周水肿、便秘、心悸、面部潮红;β受体阻滞药可能使糖尿病病人产生低血糖、乏力;硝酸酯类药可能导致头痛、心率放射性加快、低血压;抗血小板药物可能引起肝脏损害和肌病等[1],而中药和中药制剂因其温和、持久的治疗作用,以及多途径、多靶点的治疗特点,使其在抗心血管疾病中得到广泛使用[2]。由中药-中药、中药-西药联合用药引起CYP450酶(CYPs)的诱导/抑制,产生的药物相互作用明显增加[3],因此评价临床常见中成药对CYPs的体外活性影响,对于临床安全用药、降低药-药相互作用的风险有重要的意义。本研究通过前期大量查阅文献及对大理大学第一附属医院、大理州人民医院及大理市第一人民医院3家医院走访,选出常用于抗心血管疾病且多与西药联合应用的3种中成药:参松养心胶囊(Shensong yangxin capsule,SS)、芪苈强心胶囊(Qili Qiangxin capsule,QL)和通脉养心丸(Tongmai yangxin pill,TM),但以上三药对肝脏 CYPs 有无影响尚未见报道,且人的CYP1A2、CYP2C19、CYP2D6、CYP3A4与大鼠CYP1A2、CYP2C11、CYP2D1、CYP3A1存在同源性[4],鉴于此,本課题采用“Cocktail”探针药物法,体外评价大鼠肝微粒体中 3 种常见抗心血管病中成药对 CYP1A2、CYP2C19、CYP2D6 和 CYP3A4 酶的抑制活性,为预测临床上此 3 种常见抗心血管病中成药与以CYPs 4种亚酶为底物的药物合用时可能产生的相互作用提供实验数据,为临床药物的合理应用奠定理论基础。
1 材料
1.1 主要仪器 EL-304电子分析天平(Mettler Toledo);pH计(上海雷磁);色谱:Agilent 1260 HPLC工作系统 (美国Agilent 公司);TARGIN VX-III多管涡旋震荡器(中国北京踏科技有限公司);3-15台式高速离心机(美国Sigma)。
1.2 试剂及药品 咖啡因(中国食品药品检定研究院,批号20161014);奥美拉唑(批号G1325050)和美托洛尔(批号C1729022)均购自阿拉丁;咪达唑仑注射液(江苏恩华药业股份有限公司,批号20170328);地西泮注射液(上海旭东海普药业有限公司,批号AH160602);α-萘黄铜(批号O0506A)、奎尼丁(批号A1210A)、酮康唑(批号J0620AS)、氟康唑(批号O0615AS)均购自大连美仑生物技术有限公司;参松养心胶囊(北京以岭药业有限公司,批号1703008);芪苈强心胶囊(石家庄以岭药业股份有限公司,批号A1704018);通脉养心丸(乐仁堂制药厂,批号1070275)。
1.3 实验动物 雄性SD大鼠10只,体重(200±20) g,湖南斯莱克景达实验动物有限公司提供(SYXK湘2013-0004)。
2 方法
2.1 溶液配制 内标溶液配制:精密量取2 mL地西泮注射液(5 mg·mL-1),超纯水定容于5 mL容量瓶,得2.00 mg·mL-1的内标储备液。精密量取适量内标储备液,甲醇-乙腈(1∶1)稀释成8 μg·mL-1的内标工作液。
三种中成药溶液配制:精密称取SS、QL、TM各20 mg,加甲醇溶解并定容于50 mL容量瓶中,得400 μg·mL-1待测药物液,临用时采用倍比稀释法配制为200、100、50、25、12.5、6.25μg·mL-1溶液。具体操作[5]:采用96孔板,先向第1孔加入100 μL 400 μg·mL-1的待测药物液,吸走50 μL加入第2孔,向第2孔加入50 μL甲醇,混匀后吸走50 μL加入到第3孔,再向第3孔加入50 μL甲醇,混匀后吸走50 μL加入到第4孔,依此类推,直到第7孔,则第1孔至第7孔的药物浓度分别为:400、200、100、50、25、12.5、6.25 μg·mL-1。
2.2 大鼠肝微粒体制备 钙沉淀法[6]制备肝微粒体:取出大鼠肝脏称重,剪碎,用KCl磷酸盐缓冲液(pH=7.4)反复冲洗后,按1∶4(W/V)加入50 mmol·L-1Tris-1.15 % KCl缓冲溶液,冰上匀浆,然后4 ℃,10000 r/min,离心20 min,取上清液加入适量CaCl2溶液(1∶1,V∶V)后再以4 ℃,14000 r/min,离心40 min,弃上清,沉淀加入1mL上述KCl缓冲液混匀,4 ℃,14000 r/min,离心20 min,红色沉淀即为肝微粒体。将其悬浮于 PBS-20 % 甘油缓冲液中,分装至EP管中,采用BCA法,测定肝微粒体蛋白含量并于-80 ℃保存备用。
2.3 色谱条件 色谱柱:Zorbax SB-C18(250mm×4.6 mm,5 μm);流动相:乙腈(A)-0.1% 甲酸水溶液(B),洗脱程序:0~8 min,A为10 %~ 40 %;8~15 min,A为40 %~ 45 %;15~30 min,A为45 %~ 35 %;30~35 min,A为35 %~20 %;35~40 min,A为20 %~ 10 %。流速0.5 mL·min-1;检测波长280 nm;柱温30 ℃;进样量20 μL。
2.4 样品处理 参考文献[7]处理样品,加入10 μg·mL-1地西泮内标500 μL,涡旋混匀1 min,12000 r/min离心10 min,取上清液200 μL,进样20 μL。
2.5 探针底物与大鼠肝微粒体体外反应及HPLC法测定 孵育体系总体积500 μL,包含15 μL大鼠肝微粒体蛋白(0.5 mg·mL-1),10 μL NADPH再生系统(1 mmol·L -1NADP+,10 mmol· L-1G-6-P,1 U·mL-1G-6-PDH),472.5 μL PBS缓冲液(pH=7.4),2.5 μL混合探针底物(15.04 μmol·L-1咖啡因、7.81 μmol·L-1美托洛尔、4.98 μmol·L-1奥美拉唑和6 μmol·L-1咪达唑仑)。在37 ℃水浴中预孵育5 min, NADHP再生系统启动反应,37 ℃反应30 min后取出,按“2.4”项下处理样品,“2.3”项下色谱条件进样,每组平行做3份。
2.6 方法学考察 按照美国食品药品监督管理局方法学评价指导方针[8],进行专属性、线性关系、回收率、精密度和稳定性考察。
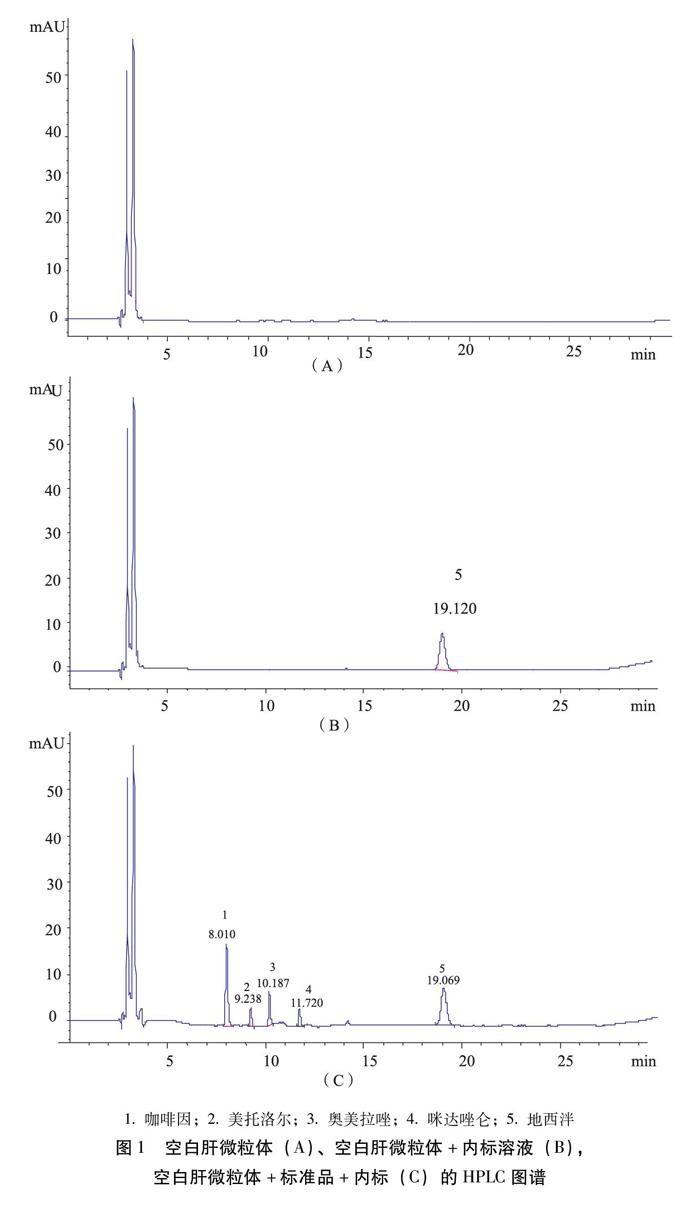
2.6.1 专属性 分别取大鼠空白肝微粒体、空白肝微粒体+内标溶液、空白肝微粒体+标准品+内标,按“2.4”项下处理样品,“2.3”项下色谱条件进样,考察色谱峰分离与干扰情况。
2.6.2 线性关系 将2.00 mg·mL-1的咖啡因、美托洛尔、咪达唑仑储备液,1.00 mg·mL-1的奥美拉唑储备液,用甲醇稀释成不同浓度的混合探针溶液,终浓度分别为咖啡因 1.91、3.75 、7.52 、15.04 、30.02 、37.59 、45.16 μmol·L-1,奥美拉唑0.64、1.24 、2.49 、4.98 、9.99 、12.56 、15.14 μmol·L-1,美托洛尔0.98 、1.96 、3.91 、7.81 、15.62 、19.52 、23.42 μmol·L-1,咪达唑仑0.74 、1.51 、3.02、6.00 、12.00 、16.49、18.00 μmol·L-1。将25 μL大鼠肝微粒体加入472.5 μL PBS缓冲液中,60 ℃加热灭活,放置至室温后分加入2.5 μL混合底物孵育体系,按“2.5”下孵育。每个样本平行制备3份。
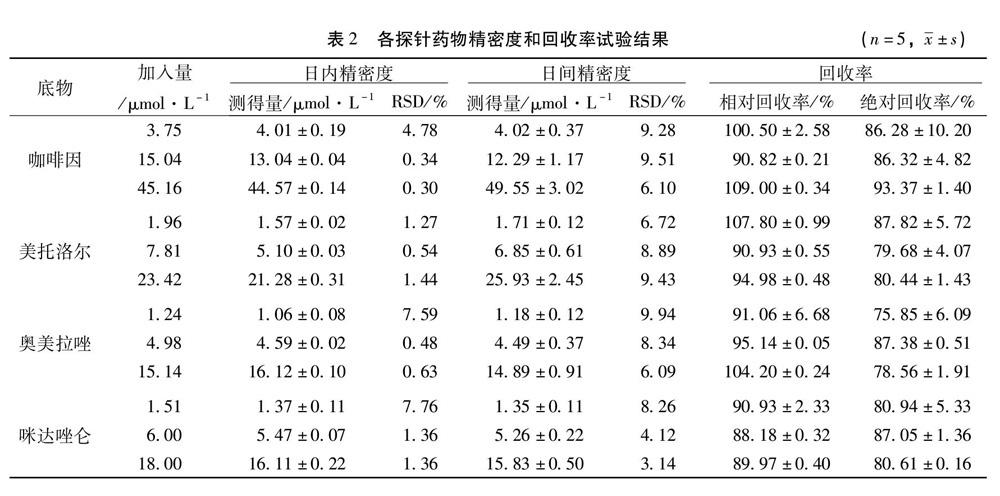
2.6.3 精密度 取空白肝微粒体25 μL,加入472.5 μL PBS缓冲液,再分别加入2.5 μL 低、中、高浓度的混合探针标准液(咖啡因3.75、15.04、37.59μmol·L-1,美托洛尔1.96、7.81、19.52μmol·L-1,奥美拉唑1.24、4.98、12.56μmol·L-1,咪达唑仑1.51、6.00、1.49μmol·L-1),其余按“2.4”项下方法操作后,于同日内进样3次测定,求得日内RSD;连续3日测定3次,求得日间RSD。
2.6.4 回收率 取空白肝微粒体 25 μL,加入472.5 μL PBS缓冲液,再分别加入2.5 μL按“2.6.3”项下方法制备的低、中、高浓度的混合探针标准液,其余按“2.4”项下处理进样后,记录峰面积A1,再选取对应浓度的对照品溶液进样,获得峰面积 A2,计算绝对回收率(绝对回收率 = A1/A2 × 100 %)。用以求得的标准曲线回归方程,计算出药物浓度,与理论浓度相比较,计算相对回收率(相对浓度= 实测浓度/理论浓度 × 100 %)。
2.6.5 稳定性 取空白肝微粒体 25 μL,加入472.5 μL PBS缓冲液后,再分别加入“2.6.3”项下低、中、高浓度样品2.5 μL,每个质量浓度6份样品分析,分别于室温放置6 h,-80 ℃冷冻放置2周,反复冻融3次条件下,按“2.4”项下处理样品并测定。
2.7 阳性抑制剂抑制作用的研究 置冰浴,向已加入15 μL 大鼠肝微粒体(0.5 mg·mL-1)的PBS液中分别加入2.5 μL不同浓度的阳性抑制剂(α-萘黄铜,奎尼丁,氟康唑,酮康唑终浓度分别为:10、50、50、10 μmol·L-1)和2.5 μL混合探针溶液,以下操作同“2.4”项,空白组使用等体积甲醇溶液,每份平行做3份。
2.8 三种抗心血管病中成药对大鼠肝微粒体的抑制作用 以各待测中成药置换孵育体系中的阳性抑制剂,药物组系列浓度为6.25、12.5、25、50、100、200 μg·mL-1,按“2.4”项下操作进行孵育。由不同浓度反应组底物剩余量来计算相应酶抑制率:酶活性=(总底物浓度-剩余底物浓度)/ 总底物浓度。采用GraphPad Prism 5.0软件线性回归,将酶相对活性对待测药物浓度对数值作图,并计算各药的半数抑制浓度( IC50)值。
2.9 数据处理 使用SPSS 22.0软件统计分析,数据以(x±s)描述,待测药物组和空白组采用单因素方差分析,当P<0.05可认为两组之间有显著性差异。
3 结果
3.1 探针底物与大鼠肝微粒体体外反应及HPLC测定
3.1.1 专属性 各探针底物与大鼠肝微粒体共孵育30 min后的色谱图如图1(A)~(C)所示。咖啡因、美托洛尔、奥美拉唑、咪达唑仑和内标的相对保留时间分别为:8.006、9.205、10.216、11.678和19.120 min。结果表明在选定的色谱条件下,孵育体系中的其他物质不干扰混合探针底物及内标的测定,各探针底物峰与内标物峰均良好分离,说明该方法具有良好的专属性。
3.1.2 线性關系 以探针底物浓度为横坐标,待测物的峰面积和内标峰面积比值为纵坐标,采用加权最小二乘法进行线性回归,见表1。结果发现在浓度范围内,各探针药物的回归方程线性关系良好,表明该方法灵敏度好,在线性范围内测定样品时准确可靠。
3.1.3 精密度 4 种探针底物在肝微粒体中的日内、日间精密度均RSD<10 %,精密度良好,结果见表2。
3.1.4 回收率 相对回收率范围为(88.18±0.32)% ~(108.92±0.34)%,绝对回收率范围为(75.85±6.09)% ~(93.37±1.40)%,符合检测要求,结果见表2。
3.1.5 稳定性 肝微粒体样品高、中、低浓度分别于室温放置6h、-80℃反复冻融3次,长期冻存14 d,各探针稳定性良好,符合生物样品分析要求。
3.2 阳性抑制剂对CYPs的抑制作用 利用阳性抑制剂抑制 CYPs 亚酶的活性,見表4。加入阳性抑制剂后,各亚酶的代谢明显减慢,表明 α-萘黄铜,奎尼丁,氟康唑,酮康唑分别对CYP1A2、P2D1、P2C11、P3A1活性有明显抑制作用,与对照组比较差异有显著性(P<0.05),进一步验证检测试验方法的合理性。将阳性抑制剂的 IC50值与文献比较[9],符合文献范围,所用实验体系满足 CYPs 抑制活性评价的要求。
3.3 三种抗心血管疾病中成药对CYPs的抑制作用 不同浓度药物组对4种CYPs酶的抑制曲线如图2 ~ 4所示。由图可见,随着各药物浓度的增高,各亚酶活性呈明显降低趋势。由抑制曲线计算得到的 IC50值见表2。据通用CYPs酶抑制强度分级规则[10]:IC50<1 μmol·L-1为强抑制剂;1 μmol·L-1
4 讨论
CYPs作为一类重要的药物代谢酶,参与75%的临床药物代谢,中药制剂在体内代谢酶作用下发生代谢转化的同时对酶也会产生抑制或诱导作用,产生代谢性相互作用[10]。对 CYPs的抑制作用所致的药物相互作用(约占全部相互作用的70%)的临床意义远大于诱导作用(23%)[11]。“Cocktail” 探针药物法指一种为获取多个代谢酶的表型信息,首先同时给予多种相对低剂量的探针药物,然后测定生物样本中各探针药物的代谢率或者其他代谢分型指标的方法,具有快速、高效、重现性好等优势[12]。笔者通过“Cocktail”探针药物法评价参松养心胶囊、芪苈强心胶囊和通脉养心丸对肝微粒体中CYPs各亚酶活性的影响,从而预测药物相互作用,提供临床用药参考。根据文献[10],可知参松养心胶囊对CYP1A2、P3A1和芪苈强心胶囊对CYP2C11、P3A1均有中度抑制作用;通脉养心丸对CYP2D1有强抑制作用。药物对CYP1A2、CYP2C11和CYP3A1酶的抑制作用,将使酶活性相应降低,可能会导致经上述亚酶代谢的其他药物代谢减慢,血药浓度升高或体内药物蓄积,作用时间相对延长,临床上应谨慎合用。中药作用是由多种有效成分的有机结合,与多种疾病相关靶点综合影响而产生的两个复杂体系之间的相互作用[13]。有文献[14-15]报道,参松养心胶囊的主组分酸枣仁的水提液,山茱萸、桑寄生等的主要活性成分没食子酸能抑制CYP3A活性。芪苈强心胶囊组分黄芪的主要活性成分胡椒苷II对人CYP2C16活性有抑制作用,且组分中的人参的主要药效物质人参总皂苷能够下调人CYP3A4酶活性,延长药物作用时间[16-17]。参松养心胶囊和芪苈强心胶囊均含有丹参成分, Wang等[18]研究表明丹参醇提物显著抑制人及大鼠肝微粒CYP1A2活性,还抑制人肝微粒CYP3A4和大鼠肝微粒CYP3A1酶活性。通脉养心丸中甘草的有效成分甘草酸(甘草甜素)、甘草次酸、甘草苷、甘草素等均能抑制CYP2D1的活性[19-20]。这些研究结果与本实验结果不矛盾。因此,参松养心胶囊、芪苈强心胶囊和通脉养心丸对CYPs亚酶的抑制作用可能与其主组分的活性成分有关。
本次研究,三药直接作用于大鼠肝微粒体,与传统给药途径差异较大,且中药成分复杂,口服给药吸收后对肝微粒体CYPs亚酶活性的影响与体外实验差异较大,体外研究或动物研究不能完全代替人的体内研究,因此三药是否在临床应用时产生抑制作用还需进行人肝微粒体或人体合并用药进一步验证。
参考文献
[1]葛均波,徐永健,王辰.内科学[M].北京:人民卫生出版社,2019:170-226.
[2]姚锦英,吕燊,王如伟.缓控释及靶向给药新剂型在心血管类中药中的应用[J].中草药,2014,45(12):1809-1812.
[3]董宇,王阶,杨庆,等. CYP450酶与中药代谢相互作用关系研究概况[J].中国中医药信息杂志,2011,18(1):100-103.
[4]潘洁,陆苑,孙佳,等.艾迪注射液对体外人和大鼠肝微粒体中CYP450酶的抑制作用[J]. 中成药,2016,38(11):2332-2337.
[5]皮荣标. 药物筛选和成药性评价的基础与实践[M]. 广州:中山大学出版社,2019:60-61.
[6]GUENGERICH F P. Cytochrome P450s and other enzymes in drug metabolism and toxicity [J]. Aaps Journal,2006,8(1): E101-E111.
[7]陈伟. “Cocktail”探针药物法评价新藤黄酸对大鼠肝微粒体细胞色素P450不同亚型酶体内外代谢活性的影响[D].合肥:安徽中医药大学,2016.
[8]FDA,Center for Drug Evaluation and Research,Center for Biological Evaluation and Research,et al.Guidance for industry:in vivo drug metabolism/drug interaction studies study design data analysis and recommendations for dosing and labeling[M]. Rockville:Federal Register,1999.
[9]YAO M,ZHU M,SINZ M W,et al. Development and full validation of six inhibition assays for five major cytochrome P450 enzymes in human liver microsomes using an automated 96-well microplate incubation format and LC-MS/MS analysis[J]. J Pharm Biomed Anal. 2007,44(1):211-223.
[10]范宰文,馬思琪,徐爱军,等. 3种中药成分对CYP2C9酶的影响[J]. 医药导报,2019,38(4):486-490.
[11]贾元威,沈杰,谢海棠,等.天麻素对人肝微粒体细胞色素P450酶的抑制作用[J].中国临床药理学与治疗学,2016,21(2):134-138.
[12]GIRI P,PATEL H,SRINIVAS N R. Use of Cocktail Probe Drugs for Indexing Cytochrome P450 Enzymes in Clinical Pharmacology Studies-Review of Case Studies[J].Drug Metab Lett. 2019,13(1):3-18.
[13]马增春,王宇光,谭洪玲,等.中药与肝脏药物代谢酶之间的相互作用[J]. 世界华人消化杂志,2016,24(7):994-1001.
[14]武佰玲,刘萍,高月,等. 酸枣仁、远志和桔梗水提液对大鼠肝CYP450酶活性及mRNA表达的调控作用[J]. 中国实验方剂学杂志,2011,17(18):235-239.
[15]石亮,张远冬,王二豪,等.没食子酸及其氧化产物对大鼠肝微粒体CYP3A的抑制效应[J]. 第三军医大学学报,2014,36(2):130-134.
[16]XIAO Y J,JIANG Z Z,YAO J C,et al. Investigation of Picroside IIs impacts on the P450 activities using a cocktail method[J]. Chin J Nat Med,2008,6(4):292-297.
[17]易剑峰,吴波,刘苍龙,等.人参总皂苷对 γ 射线照射后大鼠肝P450酶调节作用研究[J]. 中国中药杂志,2015,40(20):4037-4043.
[18]WANG X,CHEUNG C M,NAYNE Y W,et al. Major tanshinones of Danshen ( Salvia miltiorrhiza ) exhibit different modes of inhibition on human CYP1A2,CYP2C9,CYP2E1 and CYP3A4 activities in vitro[J]. Phytomedicine,2010,17(11):868-75.
[19]刘丽,肖娟,彭志红,等.甘草次酸在人细胞色素CYP450中体外代谢研究[J]. 药学学报,2011,46(0-1):81-87.
[20]CHEN H,ZHANG X,FENG Y,et al. Bioactive components of Glycyrrhiza uralensis mediate drug functions and properties through regulation of CYP450 enzymes[J]. Mol Med Rep,2014,10 (3) :1355-1362.
(收稿日期:2021-01-15 编辑:刘 斌)
基金项目:国家自然科学基金资助项目(81360511)。
作者简介:黄茹润(1995-),女,彝族,硕士研究生,研究方向为临床药学。E-mail:2041151163@qq.com
通信作者:赖泳(1973-),女,汉族,硕士,教授,硕士生导师,研究方向为药理学、中药学。E-mail:laiyong8879@163.com

