白三烯受体拮抗剂(LTRAs)治疗哮喘-慢阻肺重叠(ACO)患者的价值研究
韩彬
(利津县中心医院呼吸消化内科,山东 东营 257400)
慢性阻塞性肺疾病(简称慢阻肺)与哮喘均是威胁人类健康的常见疾病,具有发病率高、病死率高的特点。据2020年调查显示,全球死因排行中慢阻肺高居第3位,其病情加重诱因较多,如细菌、病毒等病原菌感染,空气污染、吸烟或过敏原吸入,但仍有1/3左右的患者无法确定其病情加重原因[1]。慢阻肺、哮喘均为慢性气道炎症疾病,且表现为相似的临床特性,如持续性、可逆性气流受限,过敏倾向,使用支气管扩张剂可缓解症状。全球哮喘防治倡议(2014年)提出,两者合并疾病为哮喘-慢阻肺重叠综合征(ACOS)[2]。2017年,哮喘-慢阻肺重叠(ACO)替代了ACOS,认为该病为不同潜在机制引起的表型不同的气道疾病,与两者单独发病相比,ACO的病情更重,住院率、病死率更高[3]。需给予患者规范诊治,控制其病情进展,提高患者生存质量。近年来,有研究发现,ACO患者多存在嗜酸性粒细胞(EOS)水平升高情况,而白三烯受体拮抗剂(LTRAs)可降低EOS水平[4]。基于此,本研究应用LTRAs治疗ACO患者,旨在分析其对患者临床症状、肺功能、气道炎症的影响,现报道如下。
1 资料与方法
1.1 临床资料 选取2018年1月至2020年1月本院收治的87例ACO患者,按照随机数字表法分为观察组(n=43)与对照组(n=44)。观察组男24例,女19例;年龄32~78岁,平均(57.97±6.56)岁;有吸烟史21例。对照组男26例,女18例;年龄31~76岁,平均(56.61±6.73)岁;有吸烟史20例。两组临床资料比较差异无统计学意义,具有可比性。纳入标准:参考《GOLD指南》,确诊为ACO;临床资料完整;入组前未使用过LTRAs类药物治疗;EOS水平异常升高;签署知情同意书;经本院伦理委员会审核批准。排除标准:合并肺纤维化、支气管扩张、肺大泡等肺基础疾病者;合并心血管原发性疾病者;近期内(4周)全身感染或呼吸道感染者;肝肾功能障碍者;妊娠期、哺乳期女性。
1.2 方法 两组均接受常规治疗。对照组使用布地奈德/福莫特罗粉吸入剂(AstraZeneca AB,国药准字H20140457)治疗,吸入给药,剂量160μg/4.5μg,每次2吸,每天2次。观察组在对照组基础上使用孟鲁司特(Merck Sharp&Dohme B.V.,国药准字H20181188)治疗,口服,每次10 mg,每天1次。两组均治疗3个月。
1.3 观察指标 ①使用慢阻肺症状评分(CAT)、哮喘症状评分(ACT)评价两组治疗前后临床症状,CAT评分共8个项目,每个项目5分,总分40分,分为病情轻微(0~10分)、中等(11~20分)、严重(21~30分)、非常严重(31~40分)。ACT评分共5个项目,总分25分,分为症状未控制(0~19分)、控制良好(20~24分)及完全控制(25分)[5]。②检测EOS、白细胞介素-4(IL-4)水平评价两组患者的气道炎症情况,EOS水平采取化学发光法检测,IL-4采取酶联免疫吸附法检测。③使用肺功能仪测定两组患者的肺功能指标,包括第1秒用力呼气容积(FEV1)、FEV1占用力肺活量比值(FEV1/FVC)、FEV1%pred(FVC占预计值的百分比)。
1.4 统计学方法 采取SPSS 22.0统计学软件进行数据处理,计量资料以“±s”表示,行t检验,以P<0.05为差异有统计学意义。
2 结果
2.1 两组临床症状比较 治疗后,观察组ACT评分明显高于对照组,CAT评分明显低于对照组(P<0.05),见表1。
表1 两组临床症状比较(±s,分)Table 1 Comparison of clinical symptoms between the two groups(±s,scores)
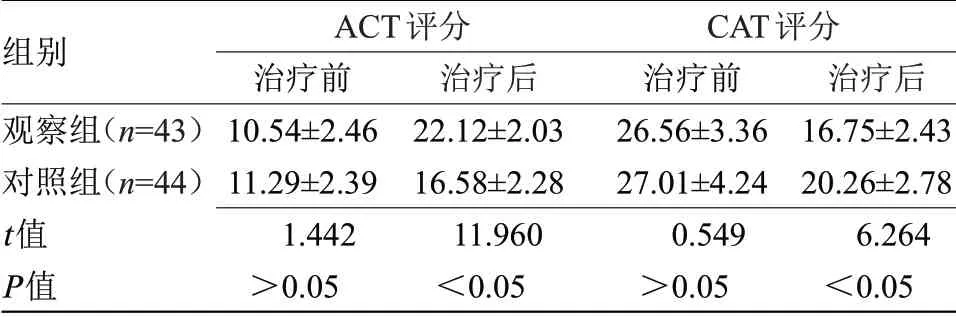
表1 两组临床症状比较(±s,分)Table 1 Comparison of clinical symptoms between the two groups(±s,scores)
注:ACT,哮喘症状评分;CAT,慢阻肺症状评分
组别观察组(n=43)对照组(n=44)t值P值ACT评分治疗前10.54±2.46 11.29±2.39 1.442>0.05治疗后22.12±2.03 16.58±2.28 11.960<0.05 CAT评分治疗前26.56±3.36 27.01±4.24 0.549>0.05治疗后16.75±2.43 20.26±2.78 6.264<0.05
2.2 两组气道炎症指标比较 治疗后,观察组EOS水平、IL-4水平均明显低于对照组(P<0.05),见表2。
表2 两组气道炎症指标比较(±s)Table 2 Comparison of airway inflammation indexes between the two groups(±s)
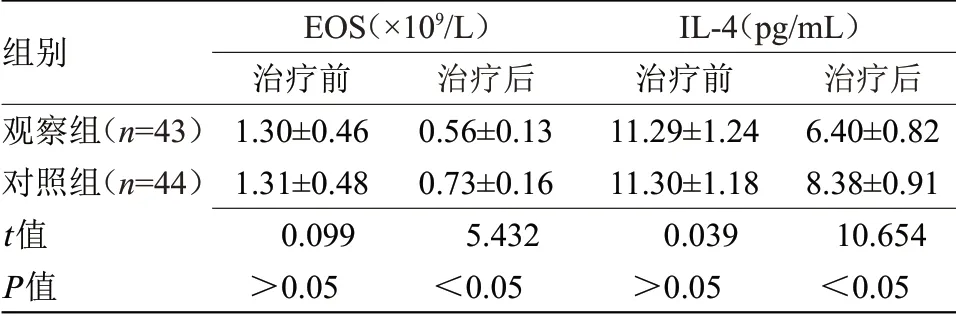
表2 两组气道炎症指标比较(±s)Table 2 Comparison of airway inflammation indexes between the two groups(±s)
注:EOS,嗜酸性粒细胞;IL-4,白细胞介素-4
组别观察组(n=43)对照组(n=44)t值P值EOS(×109/L)治疗前1.30±0.46 1.31±0.48 0.099>0.05治疗后0.56±0.13 0.73±0.16 5.432<0.05 IL-4(pg/mL)治疗前11.29±1.24 11.30±1.18 0.039>0.05治疗后6.40±0.82 8.38±0.91 10.654<0.05
2.3 两组肺功能指标比较 治疗后,观察组FEV1、FEV1%pred、FEV1/FVC水平均明显高于对照组(P<0.05),见表3。
表3 两组肺功能指标比较(±s)Table 3 Comparison of lung function indexes between the two groups(±s)

表3 两组肺功能指标比较(±s)Table 3 Comparison of lung function indexes between the two groups(±s)
注:FEV1,第1秒用力呼气容积;FEV1%pred,FVC占预计值的百分比;FEV1/FVC,第1秒用力呼气量占用力肺活量比值
组别观察组对照组t值P值FEV1(L)治疗前1.53±0.12 1.55±0.18 0.608>0.05治疗后2.05±0.22 1.85±0.21 4.338<0.05 FEV1%pred(%)治疗前55.34±4.34 55.95±5.03 0.605>0.05治疗后66.95±3.13 62.52±4.02 5.726<0.05 FEV1/FVC(%)治疗前53.23±4.64 52.98±4.71 0.249>0.05治疗后61.02±2.23 57.27±2.39 7.563<0.05
3 讨论
ACO兼有哮喘及慢阻肺的部分特征,主要特点为气流受限。研究发现,哮喘/慢阻肺患者中,15%~60%的患者同时合并ACO表现[6]。尽管哮喘、慢阻肺的炎症表型不完全相同,但临床特性有很多相似之处,例如,哮喘炎症反应主要为Th2型炎症反应,以EOS为主,多种细胞及细胞因子均有参与,而慢阻肺主要为Th1型气道炎症反应,主要效应细胞为中性粒细胞。研究显示,在慢阻肺患者中,25%~30%的患者伴有呼吸道过敏表现,且表现出IgE含量较高的哮喘样特点[7]。且随着对ACO发病机制研究的深入,发现ACO患者的EOS水平、中性粒细胞水平均明显高于健康人群,表明ACO发病机制与哮喘、慢阻肺具有相似性[8]。且有报道显示,外周血EOS水平的高低与ACO患者再住院率、D-二聚体、C-反应蛋白(hs-CRP)、中性粒细胞/淋巴细胞比例(NLR)等有关,检测EOS水平对ACO临床治疗及预后评估均有重要意义[9]。有研究表明,LTRAs可降低咳嗽变异性哮喘患者的EOS水平,且对患者肺功能、临床症状改善效果明显[10]。
LTRAs是一种临床上常用的抗哮喘药物,可降低气道内白三烯等介质的含量,尤其适用于激素治疗效果不佳的哮喘患者[11]。有研究显示,孟鲁司特除作为选择性半胱氨酰白三烯受体1(CysLT1R)拮抗剂外,对EOS、肥大细胞以及激素敏感性较低的中性粒细胞也具有良好的作用,推测可能与广谱抗炎症因子作用有关[12-13]。本研究结果表明,治疗后,观察组EOS水平、IL-4水平均明显低于对照组(P<0.05),证实孟鲁司特可降低EOS、IL-4水平,减轻中性粒细胞、EOS介导的免疫反应,减少炎症因子释放。本研究结果还显示,治疗后,观察组ACT评分明显高于对照组,CAT评分明显低于对照组(P<0.05),且观察组FEV1、FEV1%pred、FEV1/FVC水平均明显高于对照组(P<0.05),证明使用孟鲁司特治疗可更好地改善患者临床症状及肺功能,临床疗效显著。以往有报道[14]显示,应用孟鲁司特治疗ACO患者,治疗总有效率可达97.78%,明显高于单独布地奈德/福莫特罗治疗的84.44%,且患者CAT评分、肺功能指标、生存质量均显著改善,也表明孟鲁司特具有较高的治疗价值,与本研究结果一致。研究发现,ACO患者多伴有中度以上的肺通气障碍,可推测气道重塑是ACO的一项重要的病理生理机制[15-16]。使用孟鲁司特治疗后,患者肺功能明显改善,分析原因为,ACO具有一定的过敏倾向,气流受限具有可逆性,使用孟鲁司特后,患者气道高反应性减轻,可改善患者通气功能。同时,LTRAs可抑制气道炎症介质分泌和释放,缓解患者气道炎症有利于其肺功能的恢复。
综上所述,应用LTRAs孟鲁司特治疗ACO患者可缓解患者临床症状,减轻气道炎症,改善患者肺功能,治疗效果显著,值得临床推广。

