柚皮苷通过miR-34a下调MET表达并抑制PI3K/AKT信号通路的激活调控甲状腺癌细胞增殖和凋亡
汪冬梅 刘丹 郝凤杰 王立东 王兴波
(承德市中心医院 1内分泌科,河北 承德 067000;2体检中心)
甲状腺癌(TC)是内分泌系统中最常见的恶性肿瘤。在过去30年,我国TC的发病率和死亡率逐年增加。TC可分为乳头状TC、滤泡状TC、甲状腺髓样癌及间变性TC,其中乳头状TC占所有TC的70%~80%,而间变性TC只占所有TC的1%左右,但恶性程度最高,超过一半的TC患者死亡是间变性TC导致的。现代药理学研究证实,中药的有效成分对TC具有明显的抑制作用,具有对患者副作用较小、治疗途径广泛等特点。柚皮苷(NRG)是从柚子等柑桔类植物中提取的一种由葡萄糖、鼠李糖和柚配质的复合体,是一类天然类黄酮化合物,具有抗炎、抗氧化应激、抗动脉粥样硬化、保护心血管和抗肿瘤等作用〔1〕。有报道称,NRG在治疗异种移植食管癌小鼠的过程中表现出良好的抗肿瘤活性〔2〕;Erdogan等〔3〕报道,NRG可作为化疗增敏剂,增强紫杉醇对前列腺癌细胞的毒性作用,从而抑制前列腺癌的增殖和转移。MicroRNA(miRNA)是一种在真核细胞内广泛分布的小分子非编码RNA,参与了众多疾病的发生和发展过程,其中就包括TC〔4,5〕。Chen等〔6〕研究表明,miR-34a在TC组织中的表达下调,且可通过靶向GLUT1调节与氟脱氧葡萄糖的亲和力。Chen等〔7〕研究发现,NRG可通过调节miR-126/VCAN-1信号通路抑制非小细胞癌细胞的生长。
磷脂酰肌醇3激酶(PI3K)参与了细胞增殖、分化、凋亡及葡萄糖转运等多种细胞功能的调节,近年来发现PI3K与其下游分子蛋白激酶B(AKT)所组成的信号通路与人类肿瘤的发生发展密切相关,调节肿瘤细胞的增殖和凋亡等生物学过程。Cheng等〔8〕研究表明,NRG可通过抑制PI3K/AKT信号通路的激活抑制大肠癌细胞的生长。此外,Li等〔9〕研究显示,miR-34a也可以通过调节PI3K/AKT信号通路的激活抑制结直肠癌的进展。但到目前为止,NRG对TC是否有抗癌活性及其抗癌机制仍不明确,本文旨在探讨NRG对TC的抗癌活性,并探究miR-34a和PI3K/AKT信号通路在TC中的作用。
1 材料与方法
1.1药物与试剂 NRG(纯度:≥98%,规格:20 mg,批号:110722-201815)、MTT试剂、二喹啉甲酸(BCA)试剂盒及ECL化学发光试剂盒购于中国Beyotime公司;RIPA裂解液购于中国Solarbio公司;ANNEXIN-V-FITC/PI细胞凋亡检测试剂盒购于中国Beyotime公司;青霉素、链霉素及DMEM培养基购于美国Gibco公司;Lipofectamine 2000试剂盒、TRIzol试剂盒、SYBR GREEN试剂盒购于美国Invitrogen公司;二甲基亚砜(DMSO)试剂购于美国Sigma-Aldrich公司;反转录试剂盒购于美国Applied Biosystems公司;海肾荧光素酶psiCHECK2载体购于美国Promega公司。兔抗人MET单克隆抗体、PI3K单克隆抗体、p-PI3K单克隆抗体、AKT单克隆抗体和p-AKT单克隆抗体均购于美国Sigma-Aldrich公司。
1.2细胞 人甲状腺癌细胞系(乳头状TC细胞TPC-1、间变性TC SW1736细胞)和人正常甲状腺Htori-3细胞购于中国科学院上海生命科学研究资源中心。
1.3仪器 BJPX-200恒温培养箱(山东博科生物产业有限公司);HBS-1096C酶标仪(南京德铁实验设备有限公司);CyFlow Cube6流式细胞仪(广州吉源生物科技有限公司);A320离心机(上海友声衡器有限公司);FA2204G电子天平(常州万泰天平仪器有限公司);qRT-PCR仪(美国Bio-Rad公司);Mini-ProteanTetra小型垂直电泳槽(上海土森视觉科技有限公司)。
1.4方法
1.4.1组织收集 收集承德市中心医院手术切除的甲状腺癌组织样本及其对应的癌旁组织,患者在术前均已签署知情同意书,且患者及其家属均明确本研究的目的及意义,本研究已获得医院伦理委员会批准。
1.4.2细胞培养 将TPC-1和SW1736细胞接种于含10%胎牛血清(FBS),100 μg/ml青霉素和100 μg/ml链霉素的DMEM培养基中,置于37℃,5%CO2条件的恒温培养箱中进行培养。
1.4.3细胞转染 取对数生长期的TPC-1和SW1736细胞,以1×105个/孔的密度接种至6孔板内,在37℃,5%CO2条件的恒温培养箱中进行培养24 ,使用Lipofectamine 2000试剂盒将miR-NC、miR-34a mimics转染至细胞内继续培养48 h。每组实验重复3次。
1.4.4细胞处理 在37℃条件下,调整NRG浓度为6、12、25 μg/ml处理TPC-1和SW1736细胞12 h、24 h、48 h或72 h。收集处理后的细胞用于后续实验。
1.4.5MTT检测细胞增殖 将TPC-1和SW1736细胞以2 000个/孔的密度分别接种至96孔板中,在培养箱中孵育24 h后使用浓度为6、12、25 μg/ml的NRG分别处理两种细胞12、24、48或72 h。随后将20 μg/ml的MTT试剂添加至各孔中,在37℃条件下继续孵育4 h。最后加入150 μl DMSO终止孵育,使用酶标仪测定各孔在490 nm出的吸光光度(OD)值。每组实验重复3次。
1.4.6流式细胞术检测细胞凋亡 将TPC-1和SW1736细胞以1×106个/孔的密度分别接种至6孔板,在37℃条件下用使用浓度为6、12、25 μg/ml的NRG处理48 h,随后使用预冷的磷酸盐缓冲液(PBS)冲洗3次,在4℃条件下2 000 r/min离心5 min并收集沉淀。在室温下使用5 μl的ANNEXIN-V-FITC和10 μl PI染色15 min。随后使用流式细胞仪检测细胞凋亡水平,并通过FlowJo 10.6.2软件分析数据。每组实验重复3次。
1.4.7RT-qPCR检测细胞内miR-34a及蛋白mRNA表达 根据TRIzol试剂盒说明书提取甲状腺组织、TPC-1和SW1736细胞内总RNA。按照反转录试剂盒说明书进行反转录合成cDNA。按照SYBR GREEN试剂盒说明书构建PCR体系,PCR如循环参数如下: 95℃持续5 min,95℃持续45 s,60℃持续45 s,72℃持续60 s,共进行40个扩增循环。以U6或GAPDH作为内参。结果采用2-ΔΔCt法进行计算。每组实验重复3次。引物序列见表1。

表1 引物序列
1.4.8Western印迹检测细胞中MET及PI3K/AKT信号通路相关蛋白的表达 用浓度为6、12、25 μg/ml的NRG处理TPC-1和SW1736细胞48 h,使用RIPA裂解液收集细胞总蛋白,使用BCA试剂盒检测蛋白浓度。在12%的十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)中分理出50 mg的蛋白裂解物并转移至聚偏氟乙烯(PVDF)膜上,在室温下用5%的脱脂奶粉封闭2 h后将稀释后(1∶1 000)的一抗在4℃条件下孵育过夜,随后与稀释后(1∶2 000)的二抗在室温下孵育2 h。最后使用ECL化学发光试剂盒显影,使用ImageJ 1.52a软件进行数据分析。每组实验重复3次。
1.4.9双荧光素酶报告基因实验验证miR-34a与MET的靶向关系 扩增MET后将其克隆至海肾荧光素酶psiCHECK2载体中,构建野生型MET质粒(MET-WT)。将MET突变后克隆至载体内构建突变型MET质粒(MET-MUT)。使用Lipofectamin 2000试剂盒将MET-WT和MET-MUT或miR-NC和miR-34a mmics共转染至Htori-3细胞内,24 h后测定细胞内的荧光素酶活性。每组实验重复3次。
1.5统计学处理 使用SPSS19.0统计学软件进行t检验、单因素方差分析。
2 结 果
2.1NRG抑制TPC-1和SW1736细胞增殖并诱导细胞凋亡 与NRG共培养后,TPC-1和SW1736细胞的增殖受到明显抑制(P<0.05),呈现出明显的剂量和时间依赖性。TPC-1和SW1736细胞经NRG处理后其凋亡率也显著增加(P<0.05),也呈现出明显的剂量和时间依赖性。RT-qPCR检测TPC-1和SW1736细胞内增殖相关蛋白mRNA的表达水平,结果显示,经不同浓度NRG(0、6、12、25 μg/ml)处理48 h后,两种细胞内cyclinD1 mRNA和c-Myc mRNA的表达水平逐渐降低,差异有统计学意义(P<0.05)。同样地,通过RT-qPCR检测TPC-1和SW1736细胞内凋亡相关蛋白mRNA的表达水平,结果显示,随着NRG处理浓度的增加,两种细胞内survivin mRNA和Bcl-2 mRNA的表达水平逐渐降低,但细胞内caspase-3 mRNA、Cleaved-caspase-3 mRNA及Bax mRNA的表达水平逐渐增加,差异有统计学意义(P<0.05),见图1,图2,表2。

与0 μg/ml组比较:1)P<0.05,2)P<0.01图1 MTT实验检测TPC-1和SW1736细胞增殖
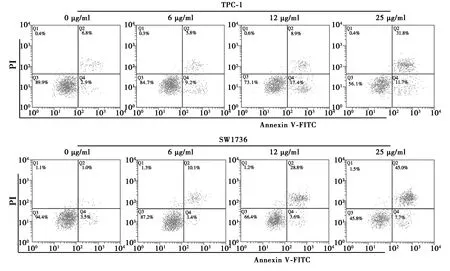
图2 流式细胞术检测TPC-1和SW1736细胞凋亡水平

表2 TPC-1和SW1736细胞内cyclinD1、c-myc蛋白及凋亡相关蛋白mRNA水平和细胞凋亡水平
2.2NRG抑制炎性介质在TPC-1和SW1736细胞中的表达 CCR6、CXCR4和CXCR7 mRNA在TC组织中的表达水平(2.36±0.13、2.01±0.16、1.89±0.11)明显高于正常甲状腺组织(1.00±0.02、0.98±0.06、1.00±0.05,P<0.01)。在TPC-1和SW1736细胞内CCR6(1.87±0.17、2.13±0.13)、CXCR4(1.64±0.17、2.13±0.12)和CXCR7 mRNA表达水平(1.72±0.16、1.97±0.12)也远高于HTori-3细胞(1.00±0.01、1.00±0.03、0.99±0.04,P<0.05)。经过不同浓度NRG(0、6、12、25 μg/ml)处理后,TPC-1和SW1736细胞内CCR6、CXCR4和CXCR7 mRNA的表达水平逐渐降低,且呈现出明显的剂量依赖性(P<0.05),见表3。

表3 柚皮苷抑制TPC-1和SW1736细胞中炎性介质的表达
2.3NRG调控miR-34a和MET的表达并抑制PI3K/AKT信号通路的激活 miR-34a在TC组织和细胞中的表达均下调(P<0.01);MET mRNA在TC组织和细胞内的表达增加(P<0.01)。不同浓度的NRG(0、6、12、25 μg/ml)处理后细胞内miR-34a表达水平显著增加,且呈现出明显的剂量依赖性(P<0.05)。随着NRG浓度的增加,TPC-1和SE1736细胞内MET蛋白的表达量逐渐降低,呈现出剂量依赖性(P<0.05)。此外,随着NRG浓度的增加,TPC-1和SW1736细胞内p-PI3K和p-AKT蛋白的表达量降低(P<0.05),即NEG处理抑制了细胞内PI3K/AKT信号通路的激活(P<0.05),见表4~6,图3。

表4 RT-qPCR检测miR-34a和MET mRNA在TC组织的表达水平

表5 RT-qPCR检测miR-34和MET mRNA在细胞内的表达水平

表6 RT-qPCR检测miR-34在不同浓度给药组细胞内的表达水平

图3 Western印迹检测MET、p-PI3K、AKT和p-AKT蛋白在TPC-1和SW1736细胞内的表达水平
2.4上调miR-34a抑制MET的表达并抑制PI3K/AKT信号通路激活 转染miR-34a mimics后,细胞内miR-34a的表达水平显著增加(P<0.001)。Western印迹实验结果显示,过表达miR-34a显著抑制TPC-1和SW1736细胞内MET蛋白的表达(P<0.05)。ENCORI预测结果显示MET是miR-34a的下游靶基因,靶向结合序列见图4。双荧光素酶报告基因实验证实,过表达miR-34a显著抑制野生型MET(MET-WT)的荧光素酶活性(0.36±0.04 vs 1.01±0.05,P<0.01)。MTT检测TPC-1和SW1736细胞的增殖情况,结果显示过表达miR-34a显著抑制细胞的增殖能力(P<0.01),且细胞内增殖相关蛋白cyclin D1和c-Myc mRNA的表达水平也显著降低(P<0.01)。同样地,过表达miR-34a显著增强了对TPC-1和SW1736细胞凋亡的诱导作用(P<0.01),细胞内凋亡相关蛋白survivin和Bcl-2 mRNA的表达受到明显抑制(P<0.01),caspase-3、cleaved caspase-3和Bax mRNA的表达量明显增加(P<0.01)。Western印迹检测结果显示,过表达miR-34a也可以显著抑制细胞内PI3K/AKT信号通路的激活(P<0.01),且显著抑制细胞内炎性介质CCR6、CXCR4和CXCR7 mRNA的表达(P<0.01),见图5~7,表7,图8。

图4 靶向结合序列

图5 Western印迹检测结果

与miR-NC组比较:1)P<0.05,2)P<0.01图6 MTT检测TPC-1和SW1736细胞增殖

图7 流式细胞术检测TPC-1和SW1736细胞凋亡水平

表7 上调miR-34a后TPC-1和SW1736细胞内蛋白、mRNA水平及细胞凋亡水平

图8 MTT检测TPC-1和SW1736细胞增殖
3 讨 论
TC是分布较为广泛的一种恶性肿瘤,随着TC发病率的逐年上升,各国学者都在寻找新型且有效的治疗方案〔10〕。NRG是柚皮中含量较为丰富的一种纯天然黄酮化合物,在多种肿瘤中发现具有抗肿瘤活性〔11〕,因此在本项目中将明确NRG对TC的抗肿瘤作用。
本研究结果表明NRG以剂量和时间依赖性的方式抑制TPC-1和SW1736细胞的增殖。同时,NRG剂量依赖性地增加了TPC-1和SW1736细胞的凋亡。为明确其抑制TPC-1和SW1736细胞增殖和促进凋亡的分子机制,通过RT-qPCR检测了两种细胞内增殖和凋亡相关蛋白mRNA的表达水平。G1/S-特异性周期蛋白(cyclin)D1是一个由人类CCND1基因编码的蛋白质,属于高度保守的细胞周期家族,可促进肿瘤的增殖并参与肿瘤的发生〔12〕。c-Myc癌基因是Myc基因家族的重要一员,是一种可使细胞获得无限增殖和永生化功能的基因,与多种肿瘤的发生发展密切相关〔13〕。在此项目中发现,随着NEG浓度的增加,处理48 h后两种细胞内cyclinD1和c-Myc mRNA的表达水平逐渐降低,且差异具有统计学意义,这也就解释了NRG会以剂量依赖性的方式抑制TPC-1和SW1736细胞的增殖。凋亡抑制基因survivin是抗凋亡基因家族中的新成员,具有肿瘤特异性,只表达在肿瘤和胚胎组织中,与肿瘤的增殖、凋亡和转移密切相关〔14〕。B淋巴细胞瘤(Bcl)-2是一种癌基因,具有明显的抗凋亡作用〔15〕。capsapse-3是促进细胞凋亡的重要调节剂,在癌症细胞中的表达下调抑制了癌细胞的凋亡〔16〕。Bax基因是与Bcl-2同源的蛋白,是Bcl-2基因家族中重要的促凋亡蛋白,Bax蛋白的过度表达可抑制Bcl-2基因的保护效应而促使细胞发生凋亡〔17〕。此项目中发现,survivin和Bcl-2 mRNA在两种细胞内的表达随着NRG剂量的增加而减少,且差异性显著。与此相反的是,caspacse-3、cleaved caspase-3和Bax mRNA在两种细胞内的表达水平随着NRG浓度的增加而逐渐上调。总之,NRG通过抑制TPC-1和SW1736细胞内cyclinD1和c-Myc mRNA的表达抑制细胞的增殖,且呈现出明显的剂量和时间依赖性。同时NRG通过抑制细胞内survivin、Bcl-2 mRNA的表达并上调caspase-3、cleaved caspase-3及Bax mRNA的表达,剂量依赖性地促进TPC-1和SW1736细胞的凋亡。
研究表明,患有甲状腺炎的患者患TC的风险增加,且在TC患者的癌症组织中常出现免疫浸润〔18〕,提示炎症反应可能是诱发TC的危险因素。趋化因子受体是参与和介导炎症反应的化学因子,其中一些不仅由免疫细胞产生,而且在正常的甲状腺细胞和TC细胞中产生,被认为与肿瘤进展和患者预后相关〔19〕。CCR6是趋化因子CCL20的唯一受体,CCR6与CCL20在许多预后不良的癌症中表达增加,且在TC的多种细胞系中均发现了CCR6 mRNA的表达增加〔20〕。CXCR4是CXCL12的受体,是在TC中研究最多的趋化因子受体之一,通常情况下CXCR4在正常TC组织和细胞中基本不表达,而在TC组织和细胞系中的表达明显升高〔21〕;有研究表明,过度表达的CXCR4还表现出了对癌细胞的抗凋亡作用,且增强了TC的转移能力〔22〕。CXCR7通过与CXCL12和CXCL11结合,介导细胞的黏附、迁移增殖和凋亡〔23〕。Werner等〔24〕研究发现,CXCR7在TC组织和细胞系中的表达明显升高,其表达水平也与淋巴结转移相关。此外Zhang等〔25〕研究结果表明,CXCR7可通过调节PI3K/AKT信号通路的激活抑制TC细胞的增殖和迁移。在此项目中发现,CCR6、CXCR4和CXCR7 mRNA的表达水平在TC组织和细胞内的表达均显著增加,但经过NRG处理后细胞内CCR6、CXCR4和CXCR7 mRNA逐渐降低,且呈现出浓度依赖性。上述研究结果也在一定程度上解释了NRG对TPC-1和SW1736细胞增殖的抑制作用和对其凋亡的促进作用。
miR-34a位于人类1p36号染色体之上,通常被认为是抑制肿瘤发生发展的重要调节因子,其功能包括通过靶基因调节细胞的炎症反应、增殖、迁移、凋亡及对化疗药物的敏感性〔26〕。研究显示,miR-34a可通过与Bcl-2基因的靶向结合,抑制Bcl-2蛋白的翻译从而发挥抗癌作用〔27,28〕。在此项目中发现,MET也是miR-34a的下游靶基因。研究显示,MET是包括TC在内多种癌症的潜在治疗靶标,并且可以通过PI3K/AKT信号通路调节TC细胞的增殖〔29〕。此项目研究结果显示,在TC组织和细胞内,miR-34a的表达量显著降低,MET mRNA在TC组织和细胞中的表达水平明显升高。经NRG处理后细胞内miR-34a的表达水平随NRG浓度的增加逐渐升高,MET蛋白随着NRG浓度的增加逐渐降低,且miR-34a负调控MET蛋白的表达。上述结果表明,miR-34a在TC组织和细胞中表达下调,MET的表达上调,且miR-34a可靶向负调控MET在细胞内的表达。另外,过表达miR-34a显著抑制TPC-1和SW1736细胞的增殖,并显著抑制cyclin D1和c-Myc mRNA在细胞内的表达。同样地,过表达miR-34a也显著增加了TPC-1和SW1736细胞的凋亡,并显著影响survivin、Bcl-2、caspase-3、cleaved caspase-3和Bax mRNA的表达。
PI3K/AKT信号通路是经典的信号通路之一,参与多种人类癌症的发生发展。磷酸化的PI3K(p-PI3K)刺激AKT的磷酸化,并因此影响肿瘤的生物学行为〔30〕。先前的研究已证实PI3K/AKT信号通路在TC中发挥作用。在此研究中发现,NRG可剂量依赖性的抑制PI3K的磷酸化,进而抑制PI3K/AKT信号通路的激活〔31〕。此外,过表达miR-34a也显著抑制PI3K/AKT信号通路在TPC-1和SW1736细胞中的激活。

