我国人群有机磷阻燃剂暴露评估及其健康风险
张晓华,赵繁荣,胡建英
地表过程分析与模拟教育部重点实验室,北京大学城市与环境学院,北京 100871
从产量和用量来看,阻燃剂已经成为次于增塑剂的第二大塑料助剂,而就主要种类而言,有机溴系阻燃剂因其持久的、生物蓄积性而在全球范围被逐步限制使用与淘汰,作为其替代品的有机磷阻燃剂(OPFRs)使用量正不断增加。人们日常生活中频繁接触的纺织品、电器外壳、PVC材料、地板涂蜡及食品包装中,都有有机磷阻燃剂添加。由于该类物质通常是以物理混合而非化学键合的方式添加到聚合物材料中,因此很容易通过挥发、浸出、磨损和溶解释放到周围环境当中。现有研究已经报道了在室内空气及灰尘、饮用水和土壤[1-5]等多种环境介质中检出有机磷阻燃剂。在人体内,头发、指甲、母乳、尿液、血液,甚至在孕妇蜕膜和胚胎绒毛样品中均检测到了机磷阻燃剂或其代谢产物[6-9],由于其广泛的人群暴露,该类物质导致的健康风险已经引起了关注[10]。
已有研究表明,有机磷阻燃剂具有ER、AR和PPARγ等多种核受体活性,干扰生物体内分泌系统,引起代谢紊乱[11-14]。在室内灰尘样品中,通过非靶向筛选鉴定出了具有肝X受体(LXR)拮抗活性的磷酸三苯酯(triphenyl phosphate, TPHP)与2-乙基己基二苯基磷酸酯(2-ethylhexyl diphenyl phosphate, EHDPP)2种有机磷阻燃剂[15]。LXR在转录调控脂质代谢中起重要作用,脂质组学分析表明,TPHP暴露会下调巨噬细胞中多不饱和脂质的水平,并诱发内质网应激和炎症反应,从而加剧代谢功能障碍,增加发生高脂血症等心血管疾病的风险[16]。胆固醇是心脑血管疾病的主要风险因子之一,血液总胆固醇升高目前已经作为一个重要的生理指标用于诊断高血脂症的发生[17],同时也是中国近几十年来心脑血管疾病发病率持续升高的主要原因[18]。2012—2015年对于全国29 678名超过35岁人群的抽样调查显示,全国年龄≥35岁人群中,有7.5%出现血液总胆固醇浓度异常[19]。流行病学研究发现,人体尿液中EHDPP与TPHP的羟基代谢产物2-乙基-5-羟基己基二苯基磷酸酯(5-OH-EHDPP)及4-羟基苯基二苯基磷酸酯(4-OH-TPHP)浓度与人体总胆固醇(TC)呈现显著正相关关系[20],该研究为我们在人群水平上评价有机磷阻燃剂暴露导致的人群健康风险提供了重要的毒性数据。
为评估有机磷阻燃剂的暴露水平及健康风险,本研究以11种有机磷酸酯代谢产物为对象物质,检测了全国8个城市600名研究对象尿液中代谢产物浓度,通过归一化处理计算了反映所有个体的浓度水平。结合流行病学调查数据,评估了我国人群EHDPP和TPHP这2种有机磷酸酯暴露导致血液总胆固醇升高的风险。
1 材料与方法(Materials and methods)
1.1 尿液样品收集
人群尿液样品采集自全国8个城市(哈尔滨市、南京市、上海市、沈阳市、深圳市、无锡市、郑州市和株洲市)的居民。以随机抽样方式从当地普通人群中招募研究对象。研究对象需要满足以下条件:(1)在当地居住一年以上;(2)女性研究对象未处于怀孕状态;(3)没有严重的心血管疾病或糖尿病等代谢相关疾病。对于已招募的研究对象,在相近时间点采集空腹晨尿样品,存放于40 mL棕色玻璃样品瓶中,运输全程使用干冰保持低温,随后置于-20 ℃、冰箱冷冻保存。
在知情同意及调查资料保密的前提下,对研究对象的基本资料进行了问卷调查。主要内容包括年龄、身高体质量指数(BMI)、房屋建筑年限、家庭月收入、所从事职业、饮酒及吸烟情况等可能影响暴露水平的相关因素,从而为排除可能存在的浓度异常值提供参考依据。
1.2 材料、试剂与标准品
本研究的目标物质包括11种有机磷酸酯阻燃剂代谢产物:磷酸二苯酯(DPHP)、磷酸二丁酯(DnBP)、二对甲苯基磷酸酯(DCrP)、磷酸二(2-乙基己)酯(DEHP)、磷酸二(2-丁氧基乙基)酯(BBOEP)、磷酸二(1,3-二氯异丙基)酯(BDCIPP)、磷酸二(2-氯乙基)酯(BCEP)、磷酸二(1-氯-2-丙基)酯(BCIPP)、4-羟基苯基二苯基磷酸酯(4-OH-TPHP)、2-乙基-5-羟基己基二苯基磷酸酯(5-OH-EHDPP)、2-乙基-3-羟基己基二苯基磷酸酯(3-OH-EHDPP)。DPHP和DnBP的分析标样购自TCI公司(东京,日本)。DCrP、DEHP、BBOEP、BDCIPP和BCIPP的标样购于Toronto Research Chemicals公司(多伦多,安大略省,加拿大)。4-OH-TPHP的标样购于韶光公司(上海,中国)。5-OH-EHDPP、3-OH-EHDPP和BCEP的标样均为自行合成,纯度在95%以上[9]。稳定同位素内标DPHP-d10和BCIPP-d12购自Toronto Research Chemicals公司(多伦多,安大略省,加拿大)。
Oasis WAX(60 mg, 3cc)固相萃取柱(SPE)购自Waters公司(米尔福德,马萨诸塞州,美国),LC-MS级甲醇购于Fisher Chemicals公司(新泽西州,美国);甲酸和乙酸钠为HPLC级,购自Dikma Technologies公司(加利福尼亚州,美国);超纯水经Milli-Q超纯水净化系统(Millipore公司,贝德福德,马萨诸塞州,美国)制备(电导率>18.2 Ω·cm-1)。本研究样品处理过程中未使用任何塑料或橡胶容器;使用铝箔衬于玻璃瓶盖内侧,以尽量减少样品的采样、储存、运输和提取过程中可能产生的污染;使用农残级或LC-MC级有机溶剂、高纯氮气;玻璃器皿均事先于马弗炉中450 ℃烘烤4 h以上。
1.3 尿液样品处理
尿液样品处理参考了文献方法[21]。由于羟基代谢产物在尿液中存在葡萄糖酸酯结合态和硫酸酯结合态[22-23],为了同时检测尿液中二酯代谢产物和羟基代谢产物,本研究尿液样品处理过程中加入了β-葡萄糖酸酯/芳基硫酸酯酶(Merck KgaA公司,达姆施塔特,德国),用以酶解结合态代谢产物。
尿液样品提前一晚置于冰上解冻,取0.5 mL解冻后的尿液,加入25 ng·mL-1的DPHP-d10内标20 μL,并与0.5 mLβ-葡萄糖酸酯/芳基硫酸酯酶解缓冲液(10 mg·mL-1水解酶,0.1 mol·L-1乙酸钠缓冲液)混合,置于37 °C恒温培养箱中酶解2 h。随后用WAX SPE小柱对样品进行富集净化,具体步骤为:用6 mL含2%(V∶V)氨水的甲醇溶液、4 mL甲醇和2 mL乙酸钠缓冲液(0.1 mol·L-1, pH=4.5)活化WAX SPE小柱,随后取酶解完成的尿样进行上样,上样后的SPE小柱用2 mL含30%(V∶V)甲醇的乙酸钠缓冲溶液混合液淋洗,并用高纯氮气吹干。使用2 mL含2%(V∶V)氨水的甲醇溶液进行洗脱,洗脱液使用高纯氮气缓吹浓缩至近干,随后用100 μL甲醇重溶,处理后的样品经0.2 μm的针式滤器(Waters)过滤后,用于UPLC-MS/MS分析。
1.4 仪器分析方法
目标物质的分析使用UltiMate 3000 UPLC仪器(Thermo Fisher Scientific公司,圣何塞,加利福尼亚州,美国)与TSQ Quantiva(Thermo Fisher Scientific公司,圣何塞,加利福尼亚州,美国)三重四级杆质谱仪联用完成。使用ACQUITY UPLC BEH C8色谱柱(1.7 μm×2.1 mm×50 mm)进行目标物质分离,柱温保持40 ℃。流动相A为甲醇,流动相B为10 mmol·L-1乙酸铵水溶液。采用线性梯度淋洗,流动相A的比例在1 min内从10%线性升高到50%,在6.5 min时升至75%,在10 min时升至100%,保持3.5 min后,恢复初始流动相比例平衡2 min。流动相流速为300 μL·min-1,进样量为5 μL。
质谱使用电喷雾离子源(ESI),所有目标物质都采用正离子模式,采用多选择反应监测转换模式(SRM)。ESI喷雾电压为3 kV,毛细管温度保持在320 ℃,氮气作为鞘气(40 Arb)和辅助气体(15 Arb),脱溶剂气温度保持在320 ℃。氩气作为碰撞气体(1.5 mTorr=0.1995 Pa)碰撞诱导解离。目标分析物的质谱参数是通过标准品溶液直接进样来获取较高目标化合物离子峰和碎片离子丰度,对质谱参数进行优化调整获得的。
1.5 质量控制与定量
本研究在定性识别样品中目标物质时考虑2个因素:与标准样品相比,保留时间相差20%以内;目标对象物质的定性、定量离子面积比相差20%之内。所有目标物质使用最高丰度或背景干扰最少的SRM转换离子对定量。校正曲线使用0.05、0.1、0.5、1、5、10、50、100和500 ng·mL-1浓度序列的标准样品溶液获得,每个目标物校准曲线的线性回归系数均>0.995。
通过在尿液样品基质中分别加入1、10和100 ng·mL-1(n=6) 3个浓度的目标分析物进行加标实验(表3)。低、中、高浓度组的加标回收率分别为76%~102%(RSD: 2%~12%)、73%~105% (RSD: 1%~7%)和79%~103% (RSD: 1%~7%),基质效应为-12.3%~4.1%。为了保证定性、定量分析的准确性,所有的分析流程进行了准确性、精度、重复性、线性、过程空白的检查。在分析尿样时,每10份样品间加入一个程序空白。在空白样品中检测到DPHP与DnBP具有背景值,分别为(0.028±0.002) ng·mL-1与(0.173±0.023) ng·mL-1。对于这2个物质,最终浓度扣除空白背景值,以空白背景值标准偏差的3倍作为检出限(LODs),以标准偏差的10倍作为定量限(LOQs);未检出空白的物质以实际样品的色谱峰信噪比为3时的浓度作为LODs,以信噪比为10的浓度作为LOQs。目标物质的LODs范围为0.006~0.507 ng·mL-1,LOQs范围为0.02~1.69 ng·mL-1。用氘代同位素内标法对目标物质进行定量,DPHP-d10用于DPHP、DCrP、DnBP、DEHP和BBOEP的定量,BCIPP-d12用于BCIPP、BCEP和BDCIPP的定量,TPHP-d15用于5-OH-EHDPP、3-OH-EHDPP和4-OH-TPHP的定量。
1.6 基准剂量(benchmark dose, BMD)的计算
对于因变量为连续变量的流行病学调查结果,采用美国环境保护局建议的BMD计算方法[24-25],计算公式如下:
(1)
式中:Φ-1为标准正态分布累积概率函数的反函数,BMR(benchmark response)是基准响应(%),即达到BMD的平均响应变化百分比,P(0)为背景发生率(%),即为在非暴露人群中的异常发生概率。在之前的研究中,普遍采用5%作为背景发生率[26-30],本研究也采用了5%的背景发生率。β为线性回归的斜率,已有流行病学调查结果显示,人群尿液中5-OH-EHDPP与4-OH-TPHP的浓度与血液总胆固醇(total cholesterol, TC)浓度呈显著正相关,与5-OH-EHDPP和4-OH-TPHP浓度回归的斜率β及95%上下限如表1所示[20]。σ是线性回归因变量的标准偏差,TC的σ为2.60[20]。本研究采用BMD的95%置信度水平下限值(BMDL)作为血液总胆固醇升高的基准剂量,当P(0)及BMR均确定时,公式中其余变量均为定值,将β的95%置信区间上限值代入式(1),即可得到BMDL。

表1 尿液有机磷阻燃剂(OPFRs)代谢产物浓度与总胆固醇(TC)的多元回归结果Table 1 Multiple regression results of urine organophosphate flame retardants (OPFRs) metabolites concentration and total cholesterol (TC) concentration
在流行病学研究中,较少发生10%的附加风险的情况[31]。美国环境保护局基于流行病学调查的BMD研究,建议BMR为1%~5%[32]。对国家毒理学计划(National Toxicology Program, NTP)58种化合物、6个毒性终点数据的分析发现,对于因变量为连续变量的毒性数据,BMDL05更加接近无可见有害作用水平(NOAEL)[33],欧洲食品安全局(EFSA)因此建议将BMR设定为5%[34],在以TC升高为终点制定全氟辛烷磺酰基化合物(PFOS)与全氟辛酸(PFOA)的健康指导值时,EFSA也采用了BMDL5作为基准值[35]。鉴于上述理由,本研究中采用BMR为5%计算了BMDL5作为基准值。
1.7 健康风险评价
使用ProUCL Version 4.00.02软件(美国环境保护局,2007)对尿液中有机磷酸酯代谢产物浓度数据进行未检出值处理,处理后的数据使用SPSS软件对其分布进行检验。对于尿液浓度呈现对数正态分布的物质,使用Crystal Ball v7.3.1软件中的蒙特卡洛方法进行模拟计算,得到8个城市中各物质浓度分布的几何均值(GM)及几何标准差(GSD)。通过式(2)和式(3),将8个城市的居民尿液的OPFRs代谢产物浓度分布进行归一化处理[36],计算得到全国人群尿液中OPFRs代谢产物浓度。
(2)
(3)
式中:Cbj为各城市尿液中OPFRs的代谢产物浓度的几何均值(ng·mL-1),SD为相应的几何标准差(ng·mL-1),n为各城市人口数量(人)。通过计算8个城市人群及全国人群当中有机磷酸酯尿液浓度高于BMDL5的人口比例,我们可以对有机磷酸酯暴露导致的健康风险进行评价。
2 结果(Results)
2.1 尿液样品有机磷酸酯代谢产物浓度水平及组成特征
在8个城市的600名居民中,所有11种目标OPFRs代谢产物均在尿液样品中检出(表2)。EHDPP的羟基代谢产物5-OH-EHDPP和3-OH-EHDPP以及TPHP的羟基代谢产物4-OH-TPHP检出率分别为72%、28%和80%,二酯代谢产物BCEP、BDCIPP、DnBP、DPHP、DCrP、DEHP、BBOEP和BCIPP的检出率分别为83%、73%、66%、63%、57%、43%、32%和5%。

表2 尿液样本中OPFRs代谢产物检出率及浓度Table 2 Detection frequency and concentration of OPFRs metabolites in urine samples
在11种OPFRs代谢产物中,BCEP是检出浓度最高的物质,这与之前中国华南地区儿童中采集的411个尿液样本中有机磷酸酯代谢产物的监测结果一致[37]。BCEP的中值浓度为2.89 ng·mL-1,比2015年华南地区儿童尿液浓度1.04 ng·mL-1[37]高出1倍。DnBP的检出浓度次之,中值浓度为0.84 ng·mL-1,比文献中报道的中国华南地区儿童尿液浓度(中值浓度为0.12 ng·mL-1)[37]和美国加利福尼亚州的人群尿液浓度(中值浓度为0.11 ng·mL-1)[38]高出8倍,比2017年中国13个城市的人类尿液浓度0.29 ng·mL-1[39]高近3倍。浓度排在第三的是DPHP,中值浓度为0.34 ng·mL-1,浓度与文献报道的中国13个城市的人类尿液浓度0.30 ng·mL-1相当[39],低于美国加利福尼亚州的人群尿液中DPHP的浓度0.44 ng·mL-1[38]和人工授精(IVF)孕妇的尿液浓度0.75 ng·mL-1[40],远低于美国北卡罗来纳州的1.6 ng·mL-1[41],高于美国马萨诸塞州男性尿液浓度0.27 ng·mL-1[42]。BDCIPP中值浓度为0.20 ng·mL-1,与美国马萨诸塞州男性的尿液浓度0.12 ng·mL-1[42]和中国13个城市的人类尿液浓度0.15 ng·mL-1[39]相近,低于美国北卡罗来纳州的1.1 ng·mL-1[41],以及美国加利福尼亚州的人群尿液浓度0.46 ng·mL-1[38]。DCrP的中值浓度为0.12 ng·mL-1,其余物质的中值浓度均低于LOQ。
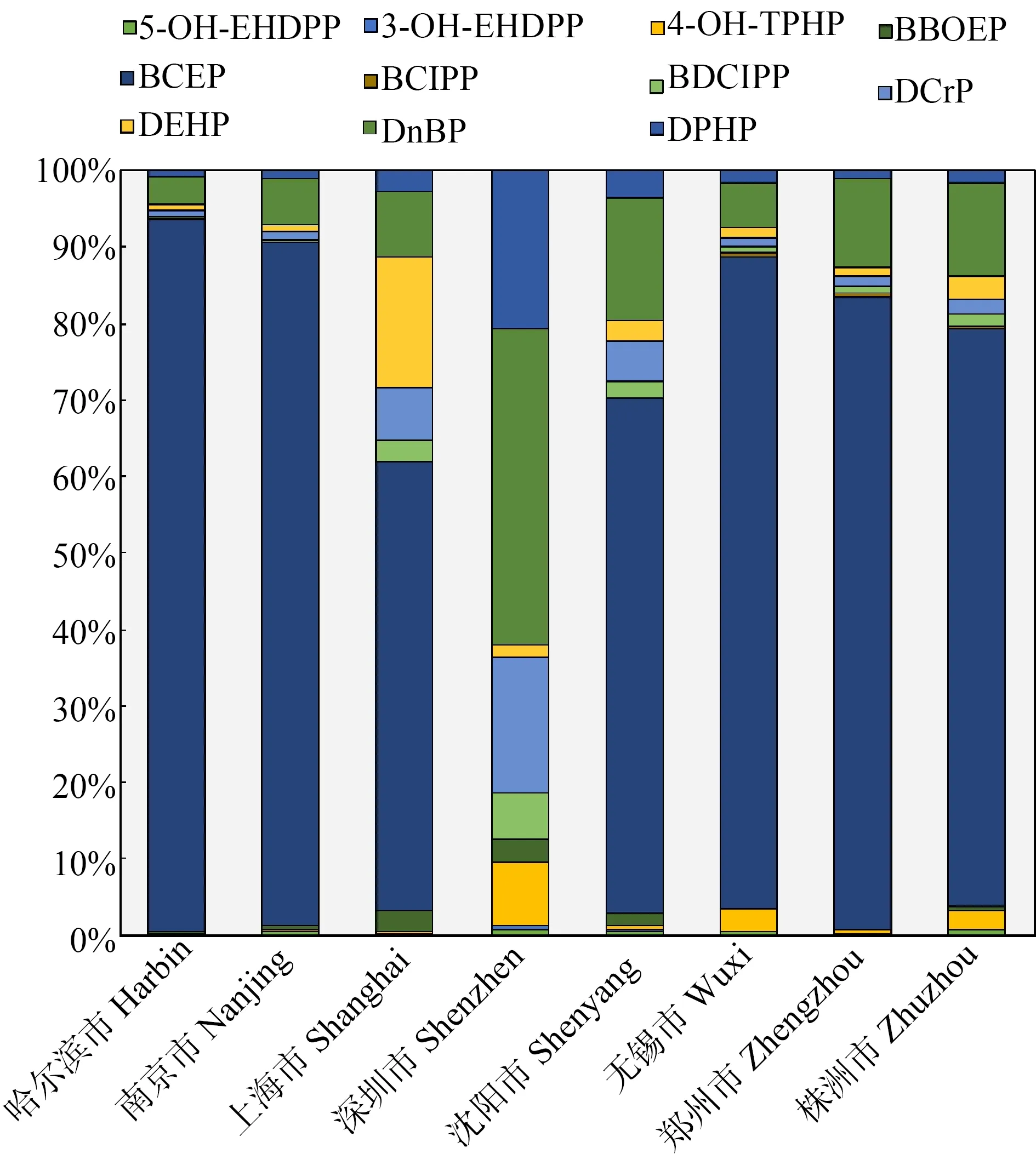
对比EDHPP的2种羟基代谢产物,5-OH-EHDPP的平均浓度(0.09±0.52) ng·mL-1,均高于3-OH-EHDPP的(0.06±0.66) ng·mL-1,说明EHDPP在人体内主要代谢为5-OH-EHDPP。TPHP的羟基代谢产物4-OH-TPHP的平均浓度为(3.01±2.12) ng·mL-1,中值浓度为0.12 ng·mL-1。4-OH-TPHP浓度范围较大( 不同城市的OPFRs尿液代谢产物的浓度总和相差较小(图1)。其中,哈尔滨市居民尿液总浓度最高,浓度中值为26.28 ng·mL-1,深圳市居民尿液代谢产物总浓度最低,浓度中值为5.80 ng·mL-1。其余城市的代谢产物总浓度中值分别为:郑州市22.78 ng·mL-1,南京市14.35 ng·mL-1,上海市6.82 ng·mL-1,沈阳市6.49 ng·mL-1,无锡市8.47 ng·mL-1,株洲市8.96 ng·mL-1。 图1 全国8个城市居民尿液OPFRs代谢产物总浓度Fig. 1 Total concentrations of urinary OPFRs metabolites among residents of 8 cities in China 不同城市尿液物质组成有明显的差异。哈尔滨市、南京市、无锡市、郑州市、株洲市、沈阳市及上海市居民尿液中,含氯的代谢产物BCEP为最主要的检出物质,占总浓度的比例分别为93%、89%、85%、83%、76%、67%和59%。烷基OPFRs的代谢产物DnBP在哈尔滨市、南京市、无锡市、郑州市、株洲市及沈阳市这些城市居民尿液中的浓度排在第二,占总浓度的比例分别为3.5%、6.1%、5.8%、12%、12%和16%;上海市居民尿液中DEHP的浓度排在第二位,占总浓度的17%。而在深圳市居民尿液中,最主要的是烷基的DnBP,占OPFRs代谢物总浓度的42%,芳香类有机磷酸酯的代谢产物DPHP(21%)、DCrP(18%)以及4-OH-TPHP(8%)在深圳市人群尿液当中也占据了较大的比例(图2)。 图2 全国8个城市居民尿液中OPFRs代谢产物组成Fig. 2 Profile of OPFRs metabolites in urine of residents from 8 cities in China 未检出率较高的数据集(如未检出率>40%),使用参数化方法对未检出值进行处理后,所得到的分布假设难以验证其真伪[43]。因此,本研究仅对于检出率高于60%的6种有机磷酸酯代谢产物5-OH-EHDPP、4-OH-TPHP、BCEP、BDCIPP、DnBP及DPHP进行未检出值处理及分布检验。检验结果显示,各个城市居民尿液中6种有机磷酸酯浓度符合对数正态分布(表3)。归一化计算结果显示,全国人群尿液中5-OH-EHDPP、4-OH-TPHP、BCEP、BDCIPP、DnBP及DPHP的浓度分别为(0.03±2.75)、(0.08±2.77)、(4.78±2.77)、(0.12±2.77)、(0.83±2.77)和(0.25±2.75) ng·mL-1。BCEP在全国人群当中平均浓度最高,5-OH-EHDPP平均浓度最低。 表3 8个城市及全国居民尿液OPFRs代谢产物浓度水平分布Table 3 Urinary concentration of OPFRs metabolites in 8 cities and across the country 根据式(1),计算得到5-OH-EHDPP和4-OH-TPHP以TC升高为终点的BMDL5值分别为0.93 ng·mL-1和0.21 ng·mL-1,5-OH-EHDPP的BMDL5低于4-OH-TPHP。 对8个城市尿液浓度分布进行归一化处理,得到全国5-OH-EHDPP与4-OH-TPHP浓度分布的几何均值与几何标准差。我们通过蒙特卡洛模拟分别生成了与8个城市人口数量及全国总人口数量相同的呈对数正态分布的随机浓度数据,并统计了尿液浓度超出BMDL5的概率(表4)。 表4 8个城市及全国居民胆固醇升高风险Table 4 Probability of elevated cholesterol in 8 cities and in China 在8个城市当中,深圳市的EHDPP风险最高。深圳市的人口中,有18%的人尿液5-OH-EHDPP浓度超过BMDL5,面临TC上升的风险。南京市的风险次之,有14%的人口的尿液5-OH-EHDPP浓度超过BMDL5。排在第3位的是无锡市,TC上升概率为11%。上海市EHDPP暴露的风险最低,只有0.41%的人口面临TC升高的风险。在全国范围当中,共有2.7%的人口尿液浓度高于BMDL5。 对于TPHP暴露,无锡市呈现最高的风险水平,其次是深圳市。2个城市尿液4-OH-TPHP浓度超出BMDL5的人口比例分别为17%和16%,风险最低的地区是哈尔滨市,有0.98%的尿液4-OH-TPHP浓度超过了BMDL5,其余城市的超出比例相对较低,范围在0.98%~5.9%之间。全国范围内,仅有0.80%的人口尿液浓度超过BMDL5。 通过全国8个城市的尿液数据调查,揭示了全国不同地区人群的有机磷酸酯内暴露水平及组成特征,并估算得到了6种有机磷酸酯代谢产物的全国人群尿液浓度。有机磷酸酯代谢产物尿液浓度和组成在不同城市人群中差异较大,呈现显著的区域差异,如深圳市的芳香类有机磷酸酯TPHP、TCrP与其他地区相比呈现出较高的暴露水平。在本研究的基础上,不同地区环境介质中的有机磷酸酯污染水平及人体主要暴露来源仍有待进一步细致的调查与分析,从而更具有针对性地避免有机磷阻燃剂暴露所导致的人群健康风险。 芳香类有机磷酸酯在人体中会被快速降解代谢为磷酸二酯类化合物,因此在尿液中很难检出有机磷酸酯本身[44]。目前,以尿液中芳香类有机磷酸酯代谢物作为生物标记物对人群进行内暴露评价是主要的评价方法[41-42]。但以往以二酯类代谢产物为标志物的人群暴露研究中,存在一些代谢产物非特异性指示有机磷酸酯暴露的问题。如大多数研究中常用DPHP指示TPHP的暴露,但是EHDPP、TPHP以及间苯二酚双(二苯基)磷酸酯(RDP)都有共同的代谢产物DPHP[22-23],DPHP并不能特异性指示TPHP的暴露水平。已有研究也证明,羟基化代谢产物是评估EHDPP、TPHP暴露的更加稳定、可靠的特异性生物标志物[9]。本研究中,5-OH-EHDPP与4-OH-TPHP的中值浓度虽然均低于以往研究中常用作TPHP标记物的DPHP,但两者的检出率均高于DPHP,表明羟基代谢产物不但特异性指示TPHP和EHDPP的暴露,而且是更加灵敏的芳香类有机磷酸酯暴露标志物。根据已有的流行病学调查数据,本研究计算得到了以血液总胆固醇水平升高5%为终点的2种羟基代谢产物基准浓度,结果表明,EHDPP与TPHP暴露分别导致了2.72%与0.80%的全国人群面临血液总胆固醇升高的风险,有机磷酸酯暴露对于普通人群血脂浓度的影响应当进一步关注与研究。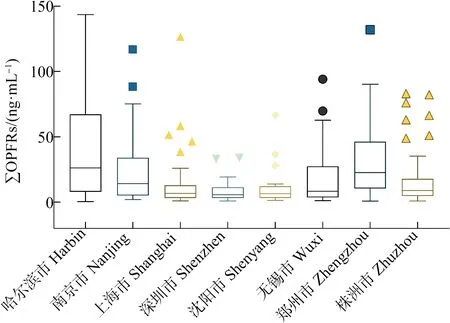
2.2 全国人群尿液有机磷酸酯代谢产物浓度水平

2.3 BMD估计值及人群风险评价

3 讨论(Discussion)

