四种替米考星制剂在猪体内的药代动力学研究
钱坤 张浩 刘学慧 曹蕊 安同伟 杨慧杰 李平


摘 要:为评价四种替米考星制剂在猪体内的药代动力学,试验采用高效液相分析法(HPLC),对32头体重70 kg左右健康杜长大猪(雌雄各半)进行研究。结果表明,替米考星无论是内服还是皮下注射给药,吸收均极为迅速,达峰快,血液中药物半衰期长,药物组织穿透力强,体内分布容积大,在组织中药物浓度高,维持时间长,这些特殊的药动学特性尤其适合于家畜肺炎、乳房炎等感染性疾病的治疗,可安全用于临床。
关键词:替米考星; 猪; 药代动力学; 血药浓度; 稳定性试验
中图分类号:S859.79 文献标识码:A DOI 编码:10.3969/j.issn.1006-6500.2021.08.008
Pharmacokinetics of Four Tilmicosin Preparations in Swines
QIAN Kun1, ZHANG Hao1, LIU Xuehui1, CAO Rui2, AN Tongwei3, YANG Huijie4, LI Ping5
(1. Tianjin Agricultural Ecological Environment Monitoring and Agricultural Product Quality Testing Center, Tianjin 300402, China; 2. Tianjin Animal Disease Prevention and Control Center, Tianjin 300402, China; 3. Tianjin Heliente Biotechnology Limited Company, Tianjin 301702, China; 4.Liaoning Inspection and Testing Certification Center, Liaoning 110016, China; 5. Tianjin Academy of Agricultural Sciences, Tianjin 300381, China)
Abstract: In order to evaluate the pharmacokinetics of four tilmicosin preparations in swines, 32 healthy Duroc Landrace swines (half male and half female) weighing about 70 kg were studied by High Pertormance Liquid Chromatography(HPLC). The results showed that: the absorption was very fast, the peak reached quickly, the half-life of drug in blood was long, the drug tissue penetration was strong, the distribution volume in vivo was large, the drug concentration in tissue was high, and the maintenance time was long. These special pharmacokinetic properties were especially suitable for the treatment of infectious diseases such as domestic animal pneumonia and mastitis, and could be safely used in clinical practice.
Key words: tilmicosin; swine; pharmacokinetics; plasma concentration; stability test
替米考星(Tilmicosin)是美国礼来公司(Lilly)于20世纪80年代开发的半合成的具有16环的大环内酯类畜禽专用抗生素。替米考星具有强抗菌性,耐药性低,抗菌谱广,对所有的革兰氏阳性菌和部分革兰氏阴性菌、霉形体、螺旋体等均有抑制作用,抗菌活性优于泰乐菌素、单诺沙星、土霉素、氟苯尼考和壮观霉素等多种抗生素[1]。替米考星的抗菌机理与其他大环内醋类相似,与细菌的核蛋白体的50S大亚基相结合,作用于P位结合点,抑制转移酶[2-4],主要通過抑制细菌的蛋白质合成而起到杀菌作用[5]。
Ose[6]报道替米考星对无乳葡萄球菌、金黄色葡萄球菌和产脓葡萄球菌的MIC分别为3.12,0.78,0.02 μg·mL-1。Modric等[7]报道给绵羊和牛皮下注射10 mg·kg-1替米考星,血中峰浓度分别为0.822,0.873 μg·mL-1,达峰时间分别为3.9,0.5 h。同时,比较了牛和绵羊的药代动力学特征,结果没有差异。Thomson等[8]测定了替米考星按200 mg·kg-1和400 mg·kg-1饲料拌料给药在猪体内组织的浓度。Blackall等[9]用琼脂稀释法测得替米考星对澳大利亚临床分离的51株多杀性巴氏杆菌的MIC≤12.5 μg·mL-1,其中48株高度敏感,3株中度敏感。用同样的方法测得药物对在澳大利亚临床分离的25株多杀性巴氏杆菌的MIC≤3.12 μg·mL-1[10]。Inamoto等[11]报道,对日本1985—1989年间猪肺炎损害部位分离出的61株多杀性巴氏杆菌和35株胸膜肺炎放线杆菌的抗菌作用,大多数菌株对替米考星、金霉素敏感。Ziv等[12]报道了替米考星在奶牛的药动学特征,给药30 min内乳中药物高于血液浓度近50倍,乳中消除半衰期为21.6 h。Ramadan等[13]报道了替米考星在奶牛和山羊体内的药动学特征,乳中浓度远高于血清中的药物浓度。Keles等[14]报道了给家禽口服50 mg·kg-1.替米考星药动学符合有吸收的二室开放模型。Thomson等[15]测定了替米考星按200,400 mg·kg-1饲料拌料给药在猪体内组织的浓度,相当于10.97和21.34 mg·kg-1·d-1连续给药14 d后肺组织中药物浓度分别为0.73~1.43 μg·mL-1和1.11~2.59 mg·kg-1·d-1。从而证实约70%~80%替米考星的细胞分布是定位于溶酶体中。由此可见,家畜肺泡巨噬细胞对替米考星的高度积累为临床上肺炎的有效防治提供了基础,即使血液和肺组织中药物水平低于致病菌的MIC值。
1 材 料
1.1 试验动物
健康杜长大猪32头,体重70 kg左右,4月龄,雌雄各半。给药前在清洁、安静的环境下饲养7 d,每日定量喂给不含任何药物的基础日粮,自由饮水。
1.2 主要药品
标准品: 替米考星标准品,含量95.0%,批号101655,中国兽医药品监察所。
供试样品: 替米考星肠溶颗粒,规格:20%,瑞普(天津)生物药业有限公司。
替米考星预混剂1,规格:20%,以C46H80N2O13计,北京康牧生物科技有限公司。
磷酸替米考星可溶性粉,规格:20%,以C46H80N2O13计,保定冀中药业有限公司。
对照药品:替米考星预混剂2,规格:20%,以C46H80N2O13计,北京康牧生物科技有限公司。
试验试剂: 二正丁胺(分析级),购自天津市元立化工有限公司;磷酸(分析级),购自国药集团化学试剂有限公司;乙腈(色谱级),Sigma-Aldrich;甲醇(色谱级),Sigma-Aldrich;四氢呋喃(色谱级),购自天津市光复科技发展有限公司。
1.3 主要仪器
高效液相色谱仪:Waters e2695,紫外检测器:Waters 2489,沃特世科技(上海)有限公司;C18色谱柱: Sagix Copsil C18(4.6×250 mm,5 μm);C18固相萃取柱:Aglient Bond Eliut C18(500 mg/6 mL);高速冷冻离心机:H1850R型,长沙湘仪离心机仪器有限公司;酸度计:PHS-3C型,上海精密科学仪器有限公司;水浴氮吹仪:CM-24型,北京成萌伟业科技有限公司;电子天平:BT25S、BSA224S-CW型,赛多利斯科学仪器(北京)有限公司;涡旋混合器:VORTEX-5型,Kylin-Bell;可调微量移液器:Thermo。
1.4 替米考星标准储备液配制
替米考星标准溶液:精密称取替米考星标准品适量,置于100 mL棕色容量瓶中,用流动相配制成浓度为200 μg·mL-1的储备液,置于4 ℃冰箱保存,待需要时用流动相逐级稀释配成所需浓度标准工作液。
2 方 法
2.1 动物给药、血样采集和血样处理
2.1.1 试验分组及给药剂量 将32头试验猪随机分为4组,每组6头,雌雄各半。前3组为受试药物组,第四组为对照药物组,其中第1组给予替米考星肠溶颗粒,第2组给予磷酸替米考星可溶性粉,第3组给予替米考星预混剂1,第4组给予替米考星预混剂2,给药剂量均为20 mg·kg-1,均以替米考星计。
2.1.2 给药方式 单剂量口服一次性给予。
2.1.3 血样采集 给药前(0 min)、给药后15,30,45 min及1,2,3,4,6,8,10,12,18,24,36,48,60,72 h在前腔静脉窦采集血液,采血量为5 mL,肝素钠抗凝。血样4 000 r·min-1离心10 min,吸取上清液于另一管中保存在-20 ℃待测。
2.1.4 样品的处理 确取混匀后的血浆样品1 mL,加入3 mL提取液(乙腈:甲醇为95∶5(v∶v)),涡旋混匀,超声5 min,3 500 r·min-1,4 ℃离心10 min,将上清液转移至新的离心管中,加入10 mL水,混匀,即为样品提取液。将C18固相萃取柱置于固相萃取装置上,依次用10 mL甲醇和10 mL水平衡,将样品提取液过柱,自然流干,依次加入10 mL水和10 mL乙腈洗涤,抽真空干燥3 min,用2.5 mL洗脱液洗脱,收集洗脱液,30 ℃水浴中氮气吹干。加250 μL流动相溶解,涡旋混匀,静置15 min,经微孔滤膜过滤,供高效液相色谱分析。
2.2 色谱条件
色谱柱:Sagix Copsil C18(4.6×250 mm,5 μm);流动相:乙腈-四氢呋喃-1 mol·L-1二丁胺磷酸缓冲液,130+55+25,v/v/v;流速:1.0 mL·min-1;进样量:100 μL;检测波长:290 nm;柱温:30 ℃。
2.3 标准曲线和线性范围
取空白血浆,分别加入标准工作液,制备成替米考星含量分别为0.02,0.05,0.1,0.2,0.5,1.0,2.0,2.5 μg·mL-1的空白添加样品。在选定的色谱条件下,按浓度从低到高的顺序分别进样100 μL作HPLC分析。以替米考星浓度为横坐标,相应的峰面积为纵坐标绘制标准曲线,确定回归方程及相关系数。
2.4 定量限和检测限的测定
取空白血浆,分别加入标准工作液,制备成替米考星含量分别为0.005,0.01,0.02,0.05 μg·mL-1空白添加样品,按样品的处理方法处理。每个浓度各5个平行,测得基线噪音值,按信噪比S/N≥3为检测限,S/N≥10为定量限。
2.5 精密度及回收率的測定
取空白血浆,分别加入标准工作液,制备成替米考星含量分别为0.02,0.5,2.5 μg·mL-1空白添加样品,按样品的处理方法处理,分别取100 μL进行HPLC检测。每批每个浓度平行设5个重复样品,共进行3个平行批次分析。根据测定结果分别计算出提取回收率、精密度及批内和批间变异系数。
2.6 样品稳定性试验
取空白血浆,添加标准工作液,使血浆中药物浓度为0.5 μg·mL-1,在室温、4 ℃及-20 ℃条件下分别存放于0,6,12,24,36,48 h后,用HPLC测定响应值。
2.7 数据处理与统计分析
采用WinNonLin 8.1药代动力学分析软件对试验数据进行处理和统计。
3 结果与分析
3.1 血药浓度的测定方法
3.1.1 色谱分离 分别吸取替米考星对照品血浆溶液、空白血浆溶液进行样品处理,按上述色谱条件测定。由血浆色谱图可知目标化合物的两个峰与杂质完全分离,无相互干扰,替米考星顺式和反式异构体的保留时间分别为11.5,9.8 min。实测血浆样品与标准品峰值和保留时间一致,确定为替米考星物质。
3.1.2 标准曲线与线性范围 分别取900 μL空白血浆,各添加100 μL替米考星系列标准工作液,使血浆中替米考星的浓度分别为0.02,0.05,0.1,0.2,0.5,1.0,2.0,2.5 μg·mL-1,将逐级稀释的标准品进样检测,以替米考星峰面积(y)对血浆浓度(x)进行线性回归,相关系数良好,标准曲线见表1。
3.1.3 定量限与检测限 取空白血浆,分别加入标准工作液,制备成替米考星含量分别为0.005,0.01,0.02,0.05 μg·mL-1空白添加样品,按样品的处理方法操作。每个浓度各5个平行,测得基线噪音值,按信噪比S/N=3为检测限(LOD),S/N=10为定量限(LOQ)。其中检测限为0.01 μg·mL-1,定量限为0.02 μg·mL-1。
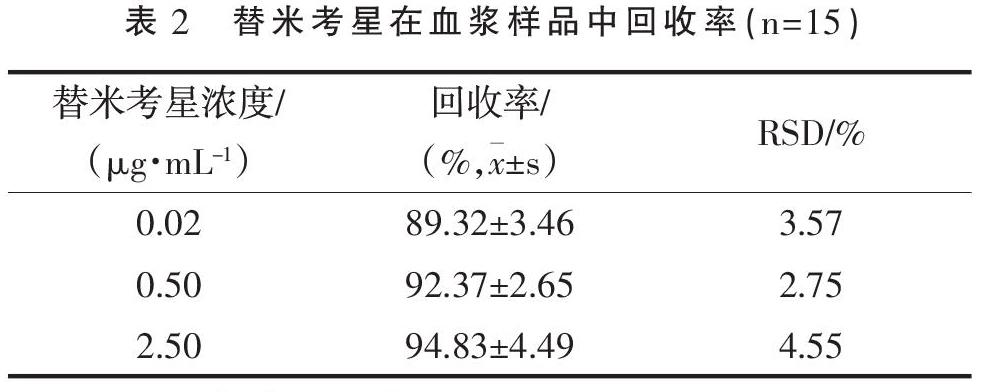
3.1.4 提取回收率、精密度与准确度 将峰面积代入回收率计算公式:回收率=×100%
(式中,A为添加样品中替米考星实测峰面积;As为对应标准液中替米考星峰面积)。替米考星低、中、高(0.02,0.5,2.5 μg·mL-1)浓度的血浆样品测定结果的回收率见表3,结果表明,在低、中、高(0.02,0.5,2.5 μg·mL-1)3个浓度下分析方法的平均回收率(%)分别是89.32±3.46,92.37±2.65,94.83±4.49,RSD均小于10%,能满足后续药代动力学分析要求 。
3.2 血浆中药物浓度
分别给猪灌服替米考星制剂,各时间点的血浆中替米考星浓度测定结果见下表3-表6,药时曲线图见图1。
3.3 药物动力学参数
采用WinNonlin 8.1药动学软件处理,用实测血药浓度-时间数据,计算出替米考星药动学参数,结果见下表7-表10。
猪按20 mg·kg-1的剂量口服替米考星肠溶颗粒后,血药浓度4 h达峰值,Cmax为1.04±0.14 μg·mL-1,药物在体内消除缓慢,消除半衰期为14.13±0.78 h。AUClast为12.27±1.43 μg·h·mL-1,AUC0~∞为13.04±1.17μg·h·mL-1,Vz_F_obs为33.62±6.46 L·kg-1,Cl_F_obs为1.54±0.14 L·h-1·kg-1,MRT为21.65±3.51 h,Tlag为0.59±0.19 h,与替米考星预混剂2相比,相对生物利用度F为133.93±12.03%。
猪按20 mg·kg-1的剂量口服替米考星预混剂1后,血药浓度1.25±0.27 h达峰,Cmax为0.87±0.04 μg·mL-1,药物在体内消除缓慢,消除半衰期为9.94±1.00 h。AUClast为8.66±0.81 μg·h·mL-1,AUC0~∞为9.00±0.90 μg·h·mL-1,Vz_F_obs为31.95±2.46 L·kg-1,Cl_F_obs为2.24±0.23 L·h-1·kg-1,MRT为13.61±1.25 h,与替米考星预混剂2相比,相对生物利用度F为92.40±9.20%。
猪按20 mg·kg-1的剂量口服磷酸替米考星可溶性粉后,血药浓度1.63±0.23 h达峰,Cmax为0.83±0.03 μg·mL-1,药物在体内消除缓慢,消除半衰期为1.22±0.44 h。AUClast为9.77±0.98 μg·h·mL-1,AUC0~∞为10.13±1.01 μg·h·mL-1,Vz_F_obs为29.33±2.71 L·kg-1,Cl_F_obs为1.99±0.18 L·h-1·kg-1,MRT为14.62±0.79 h,与替米考星预混剂2相比,相对生物利用度F为100.33±10.08%。
猪按20 mg·kg-1的剂量口服替米考星预混剂2后,血药浓度1.81±0.26 h达峰,Cmax为0.86±0.04 μg·mL-1,药物在体内消除缓慢,消除半衰期为10.60±3.70 h。AUClast为9.33±0.47 μg·h·mL-1,AUC0~∞为9.74±0.39 μg·h·mL-1,Vz_F_obs为31.52±11.71 L·kg-1,Cl_F_obs为2.06±0.08 L·h-1·kg-1,MRT为13.35±1.45 h。
4 结 论
本试验采用高效液相分析法,四种替米考星制剂在猪体内的药代动力学进行评价,考虑到非房室模型不受经典房室模型的影响,适用于任何房室,目前体内数据解析中多采用此法,且各国药品评审当局也陆续采用推荐,固本试验所测血药经时数据均采用非房室模型進行分析。结果表明,四种制剂血液中药物半衰期长,药物组织穿透力强,体内分布容积大,在组织中药物浓度高,维持时间长,具有一定的生物安全性。
参考文献:
[1] 韩孝欣, 刘芳, 范建华, 等. 磷酸替米考星可溶性粉对鸡毒支原体病的临床疗效[J]. 畜牧与兽医, 2016, 48(7): 144-145.
[2] 沈建忠, 谢联金. 兽医药理学[M]. 北京: 中国农业大学出版社, 2000.
[3] 朱模忠. 兽药手册[M]. 北京: 化学工业出版社, 2002.
[4] 王煊, 马志强, 王忠仁. 动物专用抗菌药——替米考星的简介[J]. 养殖技术顾问, 2012(4): 241.
[5] 蔡田, 罗行炜, 徐引第, 等. 猪链球菌对大环内酯类抗生素的耐药性研究[J]. 河南农业大学学报, 2019, 53(1): 73-81.
[6] OSE E E. In vitro antibacterial properties of EL-870, a new semi-synthetic macrolide antibiotic[J]. The Journal of Antibiotics, 1987, 40(2): 190-194.
[7] MODRIC S, WEBB A I, DERENDORF H. Pharmacokinetics and pharmacodynamics of tilmicosin in sheep and cattle[J]. Journal of Veterinary Pharmacology and Therapeutics, 1998, 21(6): 444-452.
[8] THOMPSON T D, LAUDERT S B, CHAMBERLAND S, et al. Micotil: pharmacokinetics of tilmicosin, a semi-synthetic macrolide antibiotic, in acutely pneumonic cattle and primary alveolar macrophages[C]// 6th European Association for Vet Pharmacology and Therapeutics Congress, Edinburgh: 1994: 32-32.
[9] BLACKAL P J, ASAKAWA T, GRAYDON R J, et al. In-vitro antibacterial-properties of tilmicosin against Australian isolates of Pasteurella multocida and Actinobacillus pleuropneumoniae from pigs[J]. Australian Veterinary Journal, 1995, 72(1): 35-36.
[10] 芮萍, 沈建忠, 李建成, 等. 替米考星靜脉及皮下注射后在绵羊体内的药代动力学研究[J]. 畜牧兽医学报, 2005, 36(3): 296-300.
[11] INAMOTO T, KIKUCHI K, IIJIMA H, et al. Antibacterial activity of tilmicosin against Pasteurella multocida and Actinobacillus pleuropneumoniae isolated from pneumonic lesions in swine[J]. The Journal of Veterinary Medical Science, 1994, 56(5): 917-921.
[12] ZIV G, SHEM-TOV M, GLICKMAN A, et al. Tilmicosin antibacterial activity and pharmacokinetics in cows[J]. Journal of Veterinary Pharmacology and Therapeutics, 1995, 18(5): 340-345.
[13] RAMADAN A. Pharmacokinetics of tilmicosin in serum and milk of goats[J]. Research in Veterinary Science, 1997, 62(1): 48-50.
[14] KELES O, BAKIREL T, SENER S. Pharmacokinetics and tissue levels oftilmicosin in fowls[J]. Turkish Journal of
Veterinary & Animal Sciences, 2001, 25(4): 629-634.
[15] THOMPSON T D, DARBY J M, MORAN J W, et al. Tilmicosin pharmacokinetics in healthy swine[C]// The 6th EAVPT Congress,1994:52.

