益气定眩饮通过抑制凋亡和促进血管新生改善大鼠脑缺血损伤研究
贺桂莲 谢刘阳 刘春华 侯帆 朱雯雯 贺宏伟 刘飞

〔摘要〕 目的 從抑制神经元细胞凋亡和促进血管新生角度,探讨益气定眩饮改善大鼠脑缺血损伤的作用机制。方法 97只SPF级健康成年雄性SD大鼠,随机选取20只为假手术组,其余大鼠采用大脑中动脉线栓法制作脑缺血模型。选取造模成功的60只SD大鼠随机分为模型组、丁苯酞组、益气定眩饮组,每组20只,分别予以蒸馏水、丁苯酞胶囊及益气定眩饮灌胃干预。Zea-Longa法检测各组1、3、7、14 d时间点脑缺血大鼠神经功能评分,HE染色观察大鼠脑缺血海马组织形态学变化,TUNEL法检测神经凋亡细胞,免疫组化检测缺血脑组织促红细胞生成素(EPO)、促红细胞生成素受体(EPOR)、血管内皮生长因子(VEGF)、脑源性神经营养因子(BDNF)、酪氨酸激酶B(TrkB)蛋白表达。结果 与假手术组比较,模型组细胞凋亡率增高,EPO、EPOR、VEGF、BDNF、TrkB蛋白表达增加(P<0.05);与模型组相比,丁苯酞组、益气定眩饮组神经功能缺损评分、细胞凋亡率明显降低(P<0.05);EPO、EPOR、VEGF、BDNF、TrkB蛋白表达增加(P<0.05)。结论 益气定眩饮对大鼠脑缺血损伤后的神经功能、局部神经元细胞形态均具有改善作用,以14 d效果更显著,推测其可能与上调EPO、EPOR、VEGF、BDNF、TrkB蛋白表达,促进血管新生,改善脑组织供血供氧,从而保护神经元形态与功能、促进受损神经功能修复有关。
〔关键词〕 益气定眩饮;促红细胞生成素;血管内皮生长因子;脑源性神经营养因子;酪氨酸激酶B;细胞凋亡;脑缺血
〔中图分类号〕R285.5 〔文献标志码〕A 〔文章编号〕doi:10.3969/j.issn.1674-070X.2021.08.009
Yiqi Dingxuan Yin Improved Cerebral Ischemia Injury in Rats by Inhibiting
Apoptosis and Promoting Angiogenesis
HE Guilian1, XIE Liuyang2, LIU Chunhua1*, HOU Fan1, ZHU Wenwen3, HE Hongwei1, LIU Fei1
(1. Hunan University of Chinese Medicine, Changsha, Hunan 410208, China; 2. Gansu University of Political Science and Law, Lanzhou, Gansu 730070, China; 3. Affiliated Fuzhou First Hospital of Fujian Medical University, Fuzhou,
Fujian 350009, China)
〔Abstract〕 Objective To investigate the mechanism of Yiqi Dingxuan Yin in improving cerebral ischemia injury in rats from the perspective of inhibiting neuronal apoptosis and promoting angiogenesis. Methods 97 SPF healthy adult male SD rats, a total of 20 rats were randomly selected as the sham operation group. The other rats were cerebral ischemia model by middle cerebral artery line embolization. 60 SD rats successfully modeled were randomly divided into model group, butylphthalide group and Yiqi Dingxuan Yin group, with 20 rats in each group. Distilled water, butylphthalide capsule and Yiqi Dingxuan Yin were given for intragastric intervention. Zea-Longa method was used to detect the neurological function scores of rats with cerebral ischemia at 1, 3, 7 and 14 days in each group. HE staining was used to observe the morphological changes in the hippocampus of rats with cerebral ischemia. Nerve apoptosis cells were detected by TUNEL method. The expression levels of erythropoietin (EPO), erythropoietin receptor (EPOR), vascular endothelial growth factor (VEGF), brain-derived neurotrophic factor (BDNF), tyrosinine-stimulated B (TrkB) protein in ischemic brain tissue were detected by immunohistochemistry. Results Compared with sham operation group, cell apoptosis rate and protein expression of EPO, EPOR, VEGF, BDNF, TrkB in model group were increased (P<0.05). Compared with model group, nerve function deficit score and cell apoptosis rate were significantly decreased (P<0.05), the protein expression of EPO, EPOR, VEGF, BDNF, TrkB increased (P<0.05) in butylphthalide group and Yiqi Dingxuan Yin group. Conclusion Yiqi Dingxuan Yin can improve the neural function and the morphology of local neurons after cerebral ischemia injury in rats, and with more significant effect of 14 days. It is speculated that it may be related to the up-regulation of EPO, EPOR, VEGF, BDNF, TrkB protein expressionpromoting angiogenesis, improving cerebral blood flow and oxygen supply, thus protecting neurons form and function, promoting restoration of the damaged neural function.
〔Keywords〕 Yiqi Dingxuan Yin; erythropoietin; vascular endothelial growth factor; brain-derived neurotrophic factor; tyrosinine-stimulated B; cell apoptosis; cerebral ischemia
急性缺血性脑卒中(ischemic stroke, IS)是最常见的脑卒中类型,占我国脑卒中的69.6%~70.8%,是严重威胁中老年人生命和健康的疾病之一,早期诊治意义重大[1-2]。尽管医疗机构开辟绿色通道、建立多学科合作的脑卒中诊治团队,由于急性缺血性脑卒中的治疗时间窗窄、很多患者起病时间不明、特异性治疗中静脉溶栓的出血并发症、动脉溶栓与取栓受医疗和患者个体条件限制、他汀与神经保护药物的疗效尚需进一步证实等原因,仍需积极寻求多种解决方法和药物[3]。益气定眩饮是刘祖贻国医大师辨治脑病理论指导下的临证常用经验方,前期临床研究[4-5]显示其防治后循环缺血性眩晕疗效显著,不仅能降低血黏度、提高椎-基底动脉血流速度,亦可改善神经功能缺损和眩晕症状,推测其疗效机制为通过改善椎-基底动脉供血不足和脑缺血缺氧,促进神经功能恢复而改善神经功能缺损症状,因前庭神经功能恢复而缓解眩晕症状。促红细胞生成素(erythropoietin, EPO)及促红细胞生成素受体(erythropoietin receptor, EPOR)是一種刺激人体造血器官、促进红细胞生成的蛋白,发挥血管新生的作用[6]。血管内皮生长因子(vascular endothelial growth factor, VEGF)又称血管通透因子,具有促进血管新生的作用[7]。脑源性神经营养因子(brain derivedneurotr?ophic factor, BDNF)是一种具有神经营养作用的蛋白质,与酪氨酸激酶B(tymsinekinase B, TrkB)结合而在神经系统广泛表达[8]。益气定眩饮是否可通过上调EPO/EPOR、VEGF、BDNF/TrkB蛋白的表达,促进脑组织血管新生,改善脑组织缺血缺氧,从而达到保护神经元形态与功能、促进受损神经功能修复的作用?本实验通过采用大脑中动脉线栓法(middle cerebral artery occlusion, MCAO)建立大鼠脑缺血模型,观察益气定眩饮对脑缺血损伤的神经功能、局部神经元形态改善的作用,并探讨其可能的作用机制。
1 实验材料
1.1 实验动物
健康雄性SD大鼠,体质量250~280 g,97只,由湖南中医药大学动物实验中心提供(动物合格证号:1107271911003822),购于湖南斯莱克景达实验动物有限公司[许可证号:SCXK(湘)2019-0004],饲养于湖南中医药大学动物实验中心[使用许可证编号:SYXK(湘)2019-0009]。室温20~25 ℃,湿度50%~70%,自由进食、饮水,适应性喂养1周,术前12 h禁食不禁水。
1.2 主要药物、试剂及仪器
益气定眩饮(湖南省中医药研究院附属医院药剂科);丁苯酞软胶囊(H20050299,石药集团恩必普药业有限公司生产);2636A4型MCAO线栓(北京西浓科技有限公司);TUNEL细胞凋亡检测试剂盒(C1098,碧云天生物科技有限公司),EPO一抗(A5663)、VEGF一抗(A11127)、BDNF一抗(A10760)、TrkB一抗(A2099)均来自武汉Abclonal公司,EPOR 一抗(bs-1424r,北京博奥森生物技术有限公司),通用型二步法检测试剂盒(pv-9000,北京中杉金桥生物科技有限公司);CM3050S型冰冻切片机、SYD-B型石蜡包埋机(德国Leica公司);CX23型光学显微镜(日本Olympus公司);电子天平(北京六一仪器厂)。
2 实验方法
2.1 分组
造模前随机取20只为假手术组,其余77只大鼠进行造模。在本实验中,大鼠造模失败共17只,总计模型制备成功率约77.9%。随机选取造模成功的60只大鼠采用随机数字表法分为模型组、丁苯酞组和益气定眩饮组,每组20只。
2.2 模型制备及神经功能评分
采用大脑中动脉线栓法[9]制作脑缺血模型。假手术组大鼠予10%水合氯醛腹腔注射麻醉,每100 g体质量0.35 mL,大鼠麻醉成功后,仰卧位固定,颈部正中切口,分离并暴露右侧颈总动脉及颈内、外动脉后缝合切口。待实验动物清醒后,进行Zea-Longa神经功能评分[10],神经功能评分标准为:(1)无神经功能损伤症状,动物正常活动、进食,评0分;(2)将动物尾巴提起后,左前肢屈曲,评1分;(3)将动物放置平板上,向左侧转圈,评2分;(4)将动物放置平板上,用手轻推向左侧倾倒,评3分;(5)动物左侧偏瘫,不能自发行走,意识朦胧或丧失,评4分。模型成功标准:评分大于或等于2分,则表明模型成功,低于2分则予以剔除。
2.3 给药干预
各组大鼠再随机分为4个亚组,每个亚组5只大鼠,分别给与相应药物干预1、3、7、14 d,每日灌胃1次,具体如下:
(1)益气定眩饮组:黄芪30 g、赤芍10 g、川芎6 g、红花10 g、地龙10 g、葛根45 g、制何首乌10 g、熟地黄15 g、制南星9 g、天麻10 g、丝瓜络15 g、鬼箭羽30 g,常规煎煮浓缩,得生药浓度为1.6g/mL,按动物与人体表面积折算给药剂量。
(2)丁苯酞组:将丁苯酞软胶囊内的药物倒出,按动物与人体表面积折算给药剂量,加蒸馏水稀释成10 mL/(kg·d),每日灌胃1次。
(3)假手术组及模型组用相应剂量蒸馏水以10 mL/(kg·d),每日灌胃1次。
2.4 标本取材与制备
假手术组及其余组造模成功的大鼠分别于干预1、3、7、14 d后观察神经功能缺损评分。并在干预1、3、7、14 d时取各亚组5 只大鼠,予以10%水合氯醛3 mL/kg腹腔注射麻醉大鼠,打开胸腔予以生理盐水及4%多聚甲醛磷酸盐进行左心室灌注,断头取脑,用直镊从大脑基底部剥取大脑,从视交叉处冠状位切为两半,除去嗅脑、小脑和脑干,剩余脑组织置于4%多聚甲醛固定12 h,再用蒸馏水冲洗浸泡24 h,取视交叉前后2 mm脱水、透明、包埋,分别做HE染色、细胞凋亡检测和免疫组化检测。
2.5 HE染色观察脑组织形态
将包埋后的海马区脑组织连续冠状切片,脱蜡后行苏木素染色、盐酸乙醇分色、自来水浸泡返蓝、伊红染色、二甲苯透明。染色完成后中性树胶封片,常温晾干,在光学显微镜下观察脑组织结构、神经元数量、细胞核形态、胞质染色情况。
2.6 TUNEL法测定神经细胞凋亡
取包埋后的海马区脑组织切片、脱蜡,蛋白酶K作用,3%过氧化氢溶液孵育,生物素标记,滴加标记反应终止液,Streptavidin-HRP工作液,DAB显色,苏木素细胞核染色,二甲苯封片观察。光镜下凋亡细胞核呈棕黄色,计算凋亡细胞所占的百分比。
2.7 免疫组化法测定脑组织中EPO/EPOR、VEGF、BDNF/TrkB蛋白表達
取包埋后的海马区脑组织切片,过氧化氢浸泡,湿盒中进行一抗孵育,加二抗,PBS冲洗,DAB显色,显微镜下观察显色结果,苏木素复染,二甲苯透明,中性树胶封片,将切片置于光学显微镜下观察,采用Scan Scope数字病理扫描系统计数阳性细胞数,其中阳性细胞数为棕黄色颗粒或胞质染成黄色。
2.8 统计学分析
采用SPSS 20.0软件进行统计处理。计量资料以“x±s”表示,先进行正态分布检验:符合正态分布者,两组间比较采用成组t检验,多组组间比较采用单因素方差分析;不符合正态分布者采用非参数检验。均以P<0.05表示差异有统计学意义。
3 结果
3.1 各组大鼠神经功能学评分
假手术组大鼠Longa评分结果为0分,神经功能表现正常;模型组、丁苯酞组及益气定眩饮组的大鼠Longa评分在1~4分之间,与假手术组比较Longa评分差异有统计学意义(P<0.01);与模型组同时间点比较,干预后1 d的Longa评分与丁苯酞组、益气定眩饮组无显著性差异(P>0.05),3、7、14 d的Longa评分较模型组下降,差异有统计学意义(P<0.05);丁苯酞组与益气定眩饮组相同时间点的差异无统计学意义(P>0.05);益气定眩饮组与丁苯酞组3、7、14 d与1 d比较Longa评分差异有统计学意义(P<0.05);益气定眩饮组14 d与3 d比较Longa评分差异有统计学意义(P<0.05)。见表1。
3.2 各组大鼠海马区神经元细胞的形态学变化
假手术组大鼠脑组织海马区神经元细胞结构完整,形态正常,排列整齐,核膜清晰,胞质染色均匀;模型组缺血脑组织海马区神经元细胞减少,形态、结构破坏,排列紊乱,细胞膜破裂,细胞核出现固缩、变性、坏死、形成空洞,胞质染色变浅;与模型组比较,丁苯酞组、益气定眩饮组在3、7、14 d组海马区神经元细胞数量增多,形态、结构破坏较轻,排列稍紊乱,细胞膜破裂不明显,细胞核少量固缩、变性。见图1。3.3 各组大鼠细胞凋亡情况
假手术组大鼠脑缺血组织未见凋亡细胞;模型组、丁苯酞组、益气定眩饮组大鼠缺血侧可见凋亡细胞出现,模型组细胞凋亡率逐渐升高,到第7天达到高峰;与假手术组比较,模型组、丁苯酞组、益气定眩饮组大鼠凋亡率明显升高(P<0.01);与模型组同时间点比较,丁苯酞组、益气定眩饮组3、7、14 d大鼠脑组织细胞凋亡率明显降低(P<0.05),且随着干预时间的增加,细胞凋亡率逐渐下降,14 d组细胞凋亡率最低;与丁苯酞组同时间点比较,益气定眩饮组细胞凋亡率差异无统计学意义(P>0.05)。见图2和表2。
3.4 各组大鼠EPO、EPOR蛋白表达情况
与假手术组比较,在1、3、7、14 d,模型组和丁苯酞组、益气定眩饮组海马区的EPO、EPOR蛋白表达水平升高,差异有统计学意义(P<0.05);与模型组比较,在3、7、14 d,丁苯酞组和益气定眩饮组中海马区的EPO、EPOR蛋白表达水平升高,差异具有统计学意义(P<0.05);而益气定眩饮组与丁苯酞组同时间点相比差异无统计学意义(P>0.05)。见图3-5。
3.5 各组大鼠VEGF蛋白表达情况
与假手术组比较,模型组和丁苯酞组、益气定眩饮组在不同时间点海马区的VEGF蛋白表达水平升高(P<0.05),差异有统计学意义;与模型组比较,在3、7、14 d,丁苯酞组和益气定眩饮组中海马区的VEGF蛋白表达量升高(P<0.05),差异有统计学意义;而益气定眩饮组与丁苯酞组同时间点相比差异无统计学意义(P>0.05)。见图6-7。
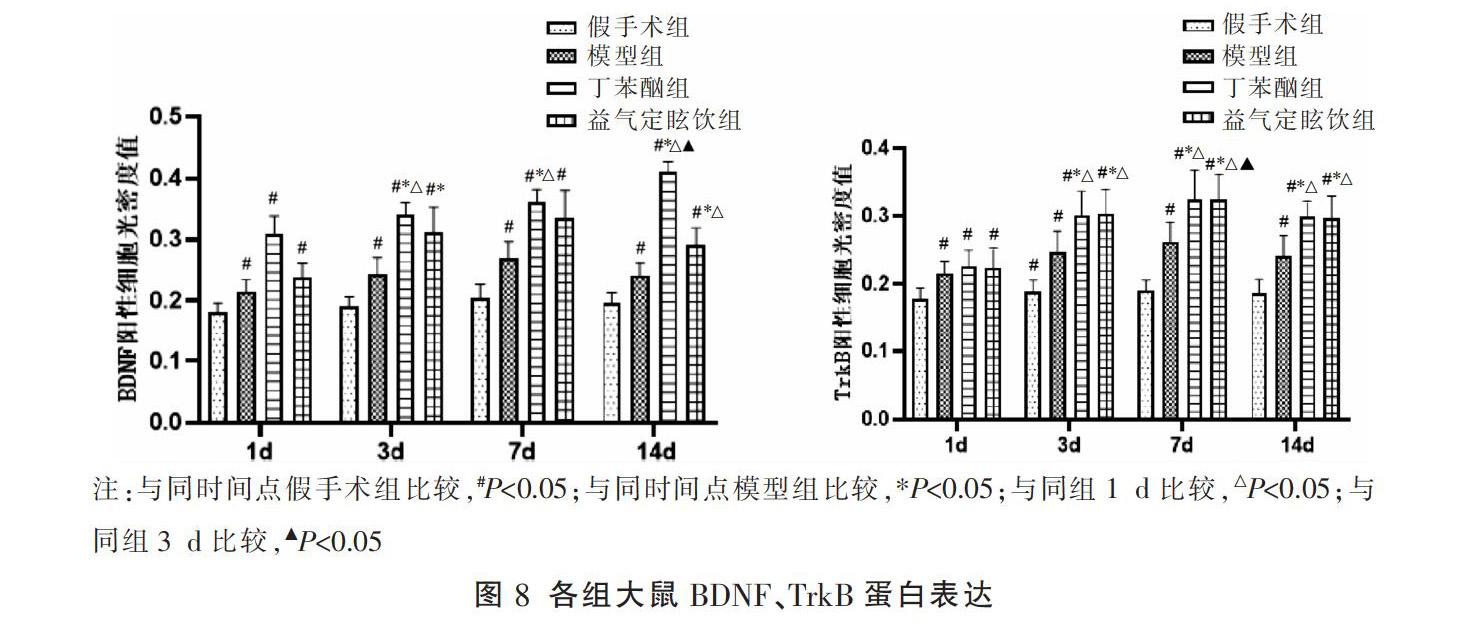
3.6 各组大鼠BDNF/TrkB蛋白表达情况
与假手术组比较,模型组、丁苯酞组和益气定眩饮组在不同时间点海马区的BDNF、TrkB蛋白表达水平升高(P<0.05);与模型组比较,在3、7、14 d,丁苯酞组和益气定眩饮组中海马区的BDNF、TrkB蛋白表达量升高,差异有统计学意义(P<0.05);但益气定眩饮组和丁苯酞组同时间点相比差异无统计学意义(P>0.05)。见图8-10。
4 讨论
急性缺血性脑卒中属于中医“中风病”范畴,“气虚血瘀”为最主要的病理机制,清代王清任《医林改错》中补阳还五汤为治疗代表方,具有益气活血通络之功效。随着中医学的发展,及对“中风病”的不断研究,逐渐认识到该病具有病因复杂、病机多端、病势变化迅速、等多种特点。常见的病因有风痰阻络、风火上扰、阴虚风动、气虚血瘀、肝肾亏虚[11]。益气定眩饮是在补阳还五汤的基础上进行加减,兼具益气活血、补肾益髓、祛风化痰3种功效。
脑缺血发生后产生的级联反应可以引起自由基的改变、氧化应激、炎症反应等,这一系列的病理生理学变化,最终导致神经细胞凋亡[12-13]。血管新生是IS恢复过程中的重要因素,脑缺血后通过新生血管增加了脑缺血区血流的供应,促进了新生血管网的形成,为缺血缺氧脑组织提供能量,促进神经功能损伤的修复[14-15]。该过程释放血管生成因子包括EPO、VEGF、BDNF等[16-17]。
EPO又称红细胞刺激因子、促红素,主要由肾脏和肝脏分泌,基本功能是促进红细胞生成。在正常人脑组织中EPO蛋白水平表达较低,但在缺氧状态下会明显增加,这表明EPO可能有自身保护性作用,对神经损伤有修复作用。研究[18-21]显示:EPO作为中枢神经系统内源性的细胞因子,可通过神经元与胶质细胞的旁分泌作用,作用至神经元EPOR,从而激活下游通路信号转导,参与缺血后的脑保护;可以使MMP-9的表达减少,TGF-β1的表达增多起到神经保护作用;也可通过激活AMPK,上调KLF2的表达,增加NO产生,进而提高血管新生。
VEGF作为目前最强的血管通透因子,是一种高度特异性的促血管内皮细胞生长因子,具有促进血管新生的作用,对MCAO细胞恢复具有重要作用[22]。在发生了脑缺血损伤后,相比于损伤发生之前,脑组织内VEGF的表达显著提高[23]。VEGF与其受体结合后,一方面促使微血管内皮细胞增殖、迁移,诱导新血管生成,改善局部血供,并保护内皮细胞不发生程序性死亡;另一方面能促进微血管新生来维系脑微环境稳定和改善病理状态下的微环境以保护神经元,是脉络渗灌气血发挥对脑神经营养作用的生物学基础之一[24]。
BDNF是神经营养因子家族的主要成员之一,有促进脑缺血大鼠神经发生和血管生成的作用[25]。大鼠海马区神经保护因子对神经元缺血损伤较为敏感,而BDNF可通过与TrkB相结合,启动细胞内信号转导途径,发挥神经保护作用[26-27]。有研究[28]表明其原理主要通过拮抗细胞内Ca2+超载兴奋氨基酸毒性,增强抗氧化酶的活性,减轻氧自由基的损伤,抑制细胞凋亡坏死和Caspase-3活性,调节Bax和Bcl-2表达来实现神经细胞的再生修复和功能恢复。丁苯酞是我国自主研发的药物,具有促进缺血性脑卒中后侧枝血管的形成、改善脑组织能量代谢、清除自由基、抑制神经元凋亡和焦亡、保护神经元等多重作用[29]。
本研究中,脑缺血后大鼠海马区EPO、EPOR、VEGF、BDNF、TrkB蛋白表达均有不同程度的增多,益气定眩饮干预后其上调作用更明显,并能改善神经功能缺损、细胞形态学改变,细胞凋亡程度降低,且随着干预时间的增加,其效果更显著,推测其可能通过上调内源性EPO、EPOR、VEGF、BDNF、TrkB蛋白,从而促进血管新生,改善脑缺血损伤,保护脑缺血海马神经元细胞。综上所述,益气定眩饮与丁苯酞均能促进脑缺血损伤大鼠神经功能的恢复,保护缺血损伤神经元细胞。课题组后期将进一步从信号通路和细胞凋亡方面明确益气定眩饮保护脑缺血神经功能的具体机制。
参考文献
[1] WANG W Z, JIANG B, SUN H X, et al. Prevalence, incidence, and mortality of stroke in China: Results from a Nationwide population-Based survey of 480687 adults[J]. Circulation, 2017, 135(8): 759-771.
[2] WANG D R, LIU J F, LIU M, et al. Patterns of stroke between university hospitals and nonuniversity hospitals in mainland China: Prospective multicenter hospital-based registry study[J]. World Neurosurgery, 2017, 98: 258-265.
[3] 中華医学会神经病学分会,中华医学会神经病学分会脑血管病学组.中国急性缺血性脑卒中诊治指南2018[J].中华神经科杂志, 2018,51(9):666-682.
[4] 邓浩庆,刘春华,冯 娜,等.益气定眩饮联合盐酸丁咯地尔注射液治疗后循环缺血性单发性气虚血瘀型眩晕30例[J].中医研究,2014,27(12):13-15.
[5] 刘春华,卜献春,颜 旭,等.益气定眩饮治疗老年后循环缺血性单发性眩晕的临床研究[J].湖南中医杂志,2014,30(11):1-4.
[6] CARELLI S, GIALLONGO T, VIAGGI C, et al. Recovery from experimental parkinsonism by intrastriatal application of erythropoietin or EPO-releasing neural precursors[J]. Neuropharmacology, 2017(119): 76-90.
[7] HUNTER S F, AGIUS M, MILLER D M, et al. Impact of a switch to fingolimod on depressive symptoms in patients with relapsing multiple sclerosis: An analysis from the EPOC (Evaluate patient outcomes) trial[J]. Journal of the Neurological Sciences, 2016(365): 190-198.
[8] LASEK-BAL A, JEDRZEJOWSKA-SZYPUIKA H, RTYCKA J, et al. Low concentration of BDNF in the acute phase of ischemic stroke as a factor in poor prognosis in terms of functional status of patients[J]. Medical Science Monitor, 2015, 21:3900-3905.
[9] ENGEL O, KOLODZIEJ S, DIRNAGL U, et al. Modeling stroke in mice-middle cerebral artery occlusion with the filament model[J]. Journal of Visualized Experiments, 2011, 1(47): 3791-2423.
[10] LONGA E Z, WEINSTEIN P R, CARLSON S, et al. Reversible
middle cerebral artery occlusion without craniectomy in rats[J]. Stroke, 1989, 20(1): 84-91.
[11] 高长玉,吴成翰,赵建国,等.中国脑梗死中西医结合诊治指南(2017)[J].中国中西医结合杂志,2018,38(2):136-144.
[12] LI J, CAI Y. The dual effects of autophagy in myocardial hypert?
rophy[J]. Actacardiologica, 2015, 70(4): 493-498.
[13] SANDERSON T, GALLAWAY M, KUMAR R. Unfolding the unfolded protein response: Unique insights into brain ischemia[J]. International Journal of Molecular Sciences, 2015, 16(4): 7133-7142.
[14] HATAKEYAMA M, NINOMIYA I, KANAZAWA M. Angiogenesis and neuronal remodeling after ischemic stroke[J]. Neural Regeneration Research, 2020, 15(1): 16-19.
[15] HABIB P, STAMM A S, ZEYEN T, et al. EPO regulates
neuroprotective Transmembrane BAX Inhibitor-1 Motif-containing (TMBIM) family members GRINA and FAIM2 after cerebral ischemia-reperfusion injury[J]. Experimental Neurology, 2019, 320: 112978.
[16] 倪广晓,王 璞,段春巧,等.EPO通过AMPK-KLF2信号通路调节脑缺血后血管新生的分子机制研究[J].广西医科大学学报,2020,37(2):218-223.
[17] 樊飞燕,张运克.益气活血中药联合骨髓间充质干细胞促进缺血性脑卒中血管新生的作用与机制[J].中国组织工程研究,2021, 25(13):2060-2069.
[18] WANG D, SONG Y, ZHANG J, et al. AMPK-KLF2 signaling pathway mediates the proangiogenic effect of erythropoietin in endothelial colony forming cells[J]. American Journal of Physiology Cell Physiology, 2017, 313(6): C674-C685.
[19] CARELLI S, GIALLONGO T, VIAGGI C, et al. Recovery from experimental parkinsonism by intrastriatal application of erythropoietin or EPO-releasing neural precursors[J]. Neuropharmacology, 2017, 119: 76-90.
[20] 劉 敏,王 英,王敬东,等.促红细胞生成素通过AMPK-KLF2信号通路调节脑缺血后血管新生的分子机制[J].贵州医科大学学报,2019,44(7):804-809.
[21] 赵德福,张 辉,杨文海.促红细胞生成素对大鼠脑缺血再灌注损伤的抑制作用[J].中国老年学杂志,2019,39(17):4330-4333.
[22] WANG X, VALLS A F, SCHERMANN G, et al. YAP/TAZ orchestrate VEGF signaling during developmental angiogenesis[J]. Developmental Cell, 2017, 42(5): 462-478.
[23] LEE H S, YOU J K, SHIM Y S, et al. Associations between serum vitamin D levels and precocious puberty in girls[J]. Annals of Pediatric Endocrinology & Metabolism, 2014, 19(2): 91-95.
[24] DZIETKO M, DERUGIN N, WENDLAND M F, et al. Delayed VEGF treatment enhances angiogenesis and recovery after neonatal focal rodent stroke[J]. Translational Stroke Research, 2013, 4(2): 189-200.
[25] 诸葛陆杰,方 燕,金华倩,等.补阳还五汤上调miR-199a-5p表达促进脑缺血大鼠神经发生和血管生成[J].浙江大学学报(医学版),2020,49(6):687-696.
[26] 师 佳,戴 丹,李洋洋,等.脑卒中后抑郁大鼠海马小胶质细胞脑源性神经营养因子及酪氨酸激酶受体B蛋白的表达[J].中华老年心脑血管病杂志,2018,20(1):83-87.
[27] 李 敏,陶 陶,张继荣.丰富环境对脑缺血再灌注损伤后相关凋亡基因的研究进展[J].中国康复医学杂志,2018,33(10):1238-1241.
[28] MANNELLI L C, PACINI A, MICHELI L, et al. Astragali radix: could it be an adjuvant for oxaliplatin-induced neuropathy?[J]. Scientific Reports, 2017, 7: 42021.
[29] 张 玮,马静萍.丁苯酞通过NLRP3炎性小体信号通路对大鼠脑缺血再灌注损伤后细胞焦亡的影响[J].中西医结合心脑血管病杂志,2020,18(6):898-902.

