闽楠叶斑病病原菌的分离鉴定及其生物学特性
姚 英, 于 存
(贵州大学 林学院, 贵州 贵阳 550025)
闽楠(Phoebebournei)俗称楠木,属樟科(Lauraceae)楠属(Phoebe)常绿大乔木,是我国特有物种,为国家二级保护植物,分布于福建、江西、湖南、广西、广东、贵州、浙江和湖北等地[1]。其材质通直并带有特殊香味,纹理精美,广泛用于建筑、家具、雕刻行业和精密木模的制作。同时,楠木冠大荫浓,树姿优美,是优良的园林绿化树种[2]。此外,闽楠还有净化空气、隔音降噪和杀菌驱虫等生态功能,广泛用于香料提取及化妆品研发领域[3]。由于野生资源过渡采伐,导致楠木濒临灭绝,现已开始大量人工栽植[4-5],但其种植过程中常伴有多种病虫害的发生,尤其是叶斑病已成为闽楠叶部的主要病害之一,且遍布各闽楠育苗基地及幼龄林分布区。闽楠叶斑病染病初期受害部位出现红褐色圆形斑点,向外扩展,由许多小病斑块融合成不规则的大斑,最后导致叶片退绿,严重致其死亡。炭疽菌属(Colletotrichumspp.)是主要的植物致病菌和病原菌,分布广、寄主多,可危害谷物、水果蔬菜和核桃等多种农林植物,对农林业生产威胁极大[6]。胶孢炭疽菌(Colletotrichumgloeosporioides)是炭疽菌属的重要种类,可引起橡胶、芒果和香蕉等多种植物炭疽病[7],C.gloeosporioides具有集合种和复合种的特点,种内菌株间变异大,有数个专化型或生理小种[8]。目前,在闽楠上已发现小孢拟盘多毛孢(Pestalotiopsismicrospora)可引起叶斑病[9]。笔者在调查闽楠病害时发现,除P.microspora可引起闽楠叶斑外,还有其他病原菌可引起闽楠叶斑病。因此,探明引起某一植物病害的胶孢炭疽菌生物学特性,明确其引发病规律和发病特点,对该原菌引起的植物病害的防治具有重要意义。从贵州省都匀市螺丝壳自然保护区采集闽楠典型叶斑病病叶,对其进行病原菌的分离与鉴定,探明其生物学特性,以期为闽楠叶斑病的防治提供科学依据。
1 材料与方法
1.1 材料
闽楠典型叶斑病病叶样品共计30片,采自贵州省都匀市螺丝壳自然保护区。
1.2 方法
1.2.1 病原菌的分离 采用常规组织分离法分离闽楠叶斑病病原菌,首先用1%次氯酸钠进行叶片表面消毒3~5 min,后用无菌水清洗3~5次,无菌条件下,剪取病健交界处约3 mm×3 mm的组织放置在PDA平皿,每个平皿放置3块病组织,每个叶片3次重复,30个叶片共90个处理。之后将样品于(25±2) ℃条件下培养,当样品边缘生长出菌丝时及时挑取边缘菌丝尖端转移至新的PDA平皿中进行菌株纯化,直至获得纯化菌株。获取真菌菌株后根据菌落、菌丝和孢子特征进行合并,确定主要种类后统计不同真菌的分离率。
分离率=某一真菌分离个数/所有真菌分离个数×100%
1.2.2 病原菌的致病性测定 随机选取分离得到的相同种真菌菌株5株按照柯赫氏法进行离体叶片的回接。将20年生闽楠健康叶经75%酒精表面消毒后,用无菌昆虫针轻轻刺伤表面,用打孔器截取直径为0.5 cm真菌菌饼置于刺伤部位,用湿脱脂棉保湿,25℃恒温培养10 d,观察不同真菌是否引起闽楠叶片叶斑的症状。选择回接后产生明显叶斑病的叶片,由发病的病健交界处,利用组织分离法再次分离病原菌,利用形态学方法比较再分离菌株与原接种菌株形态特征是否一致,以上每个真菌离体回接20片叶。
1.2.3 病原菌的鉴定
1) 形态学鉴定。将回接引起闽楠叶斑的病原菌接种至PDA平板上,于25℃暗培养5 d,培养过程中观察菌落颜色、形状、气生菌丝的疏密程度等形态特征,并采用插片法获取病原菌菌丝和孢子,观察记录菌丝和孢子的分支及大小,参照陆家云的方法进行病原菌的形态学鉴定[10]。
2) 分子学鉴定。在PDA平板上活化闽楠叶斑病病原菌,利用接种钩刮下平板上生长的菌丝体用于病原菌基因组的提取。病原菌基因组提取采用CTAB法,用真菌ITS通用引物ITS1 (5′-TCCGTAGGTGAACCTGCGG-3′)、ITS4(5′-TCCT-CCGCTTATTGATATGC-3′)扩增病原菌的目的基因序列。PCR反应体系(25 μL):10×Buffer 2.5 μL、2.5 mmol/L d NTP 2 μL、Taq 酶0.2 μL、模板 DNA 1 μL、25 μmol/L引物ITS1和ITS4各0.5 μL,加ddH2O至25 μL。PCR 扩增条件:95℃预变性4 min;94℃变性1 min,54℃退火1 min,72℃延伸1 min,共35个循环;最后72℃延伸10 min,4℃保存。扩增产物的纯化和序列测定委托重庆擎科生物技术有限公司进行,所得到的核苷酸序列进行在线NCBI(https://blast.ncbi.nlm.nih.gov/Blast.cgi)同源性比对分析,应用MEGA 7.0中的临近法(Neighbor-joining,NJ)构建病原菌ITS的系统进化树,系统进化树构建过程中采用Bootstrap法进行检验,重复计算1 000次后确定菌株的分类地位。
1.2.4 不同因素对病原菌菌丝体生长的影响
1) 培养基。供试培养基有水琼脂(WA)培养基、马铃薯葡萄糖琼脂(PDA)培养基、马铃薯蔗糖琼脂(PSA)培养基、PDA+维生素B6(PDA+VB 6)培养基、PDA+楠木煎汁(Ph.bournei’s leaf agar,PBLA)培养基、孟加拉红(Rose Bengal Agar)培养基、查彼培养基(Czapek Dox Agar) 、SNA培养基(Synthetic low nutrient Agar) 、燕麦琼脂培养基(Oatmeal agar medium,OA)。将直径为5 mm的菌饼接种至不同培养基,25℃暗培养5 d,然后采用“十字交叉法”测定菌落生长直径,5次重复。
2) 温度。试验温度设15℃、20℃、25℃、30℃和35℃共5个梯度,取直径为5 mm的菌饼接至PDA平板中央,分别在不同温度条件下暗培养5 d,然后采用“十字交叉法”测定菌落生长直径,5次重复。
3) pH。用1 mol/L HCl溶液和1 mol/L NaOH溶液分别调节PDA培养基pH为5.0、6.0、7.0、8.0、9.0共5个梯度,取直径5 mm 菌饼分别接种于不同pH的PDA培养基平板,25℃条件下暗培养5 d,然后采用“十字交叉法”测定菌落生长直径,5次重复。
4) 光照。取直径5 mm菌饼接种至PDA平板中央后,分别置于全黑暗、12 h光暗交替和日光灯连续照射条件下,25℃暗培养5 d,然后采用“十字交叉法”测定菌落生长直径,5次重复。
5) 碳、氮源。以查彼培养基为基础培养基,将等量的葡萄糖、麦芽糖、蔗糖、乳糖、可溶性淀粉、果糖为碳源,以不添加碳源为对照;将等量的蛋白胨、尿素、硝酸铵、酵母浸粉、牛肉膏为氮源,以不添加氮源作为空白对照;取直径5 mm 菌饼分别接种于不同条件的培养基,25℃条件下暗培养5 d,然后采用“十字交叉法”测定菌落生长直径,5次重复。
6) 菌丝的致死温度。设40℃、45℃、50℃、55℃和60℃共5个梯度,在无菌环境下,将无菌水加入5 mL的离心管中,取直径5 mm菌饼放入离心管中并置于不同温度的水浴锅中水浴10 min,再接回PDA平板中,25℃条件下暗培养5 d,然后采用“十字交叉法”测定菌落生长直径。5次重复。
1.3 数据处理
采用SPSS 20.0对数据进行统计分析,用最小显著差数(LSD)法进行差异显著性检验。
2 结果与分析
2.1 病原菌及其致病性
从闽楠患病叶片品中共分离得215个真菌菌株,经形态学初步检测合并菌株后确定为15种。分离后确定的菌株按回接试验结果显示,菌株CB-2和CB-3均可产生叶斑病症状(图1B)。其中,菌株CB-2和CB-3在30片病叶样品中均有出现,其分离率分别为78.0%和86.0%。观察闽楠叶斑病症状发现,病害初期在侵染点周边呈黑点状,后期逐渐扩大形成黑褐色不规则病斑,病斑边上常产生密集的黑色小点,潮湿环境下发病部位常密布病原菌丝,与野外自然发病症状一致(图1A)。对离体回接叶片进行病原菌的再分离,经形态学对比,同样与菌株CB-2和CB-3一致。经柯赫氏法验证,可确定菌株CB-2和CB-3为闽楠叶斑病致病菌。

注:A为野外发病病样,B为离体回接致病症状。
2.2 病原菌的鉴定
2.2.1 形态学 菌株CB-2在PDA平板上的菌落生长呈圆形(图2-A),初期为白色,培养5~6 d后变为鼠灰色,菌丝蓬松,有黑色小点,背面为黄绿色,近圆形,气生菌丝浓密(图2-B)。菌落生长速率12.4 mm/d。其分生孢子为无色,单胞,呈圆柱形,两端钝圆,大小为(15.0~25.0)μm×(4.0~7.5)μm(图2C~D)。根据《植物病原真菌学》的方法初步鉴定菌株CB-2为胶孢炭疽菌(Colletotrichumgloesporioides)。菌株CB-3在PDA平板上菌落为白色絮状,气生菌丝浓密,背部淡黄色,具轮纹,生长较快。20 d 后菌丝表面形成黑色墨汁状黏液,排列松散不规则,即为分生孢子堆,分生孢子梗短,圆柱形,无色。成熟分生孢子纺锤形,直或略弯,具4隔膜5细胞,大小(18.4~22.5)μm×(5.0~7.5)μm,初步鉴定菌株CB-3为小孢拟盘多毛孢(Pestalotiopsismicrospora)[9]。
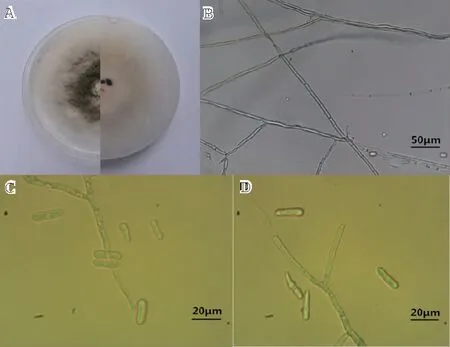
注:A为菌株CB-2的菌落,B~D为菌株CB-2的孢子及菌丝。
2.2.2 rDNA-ITS序列分析 以菌株CB-2总DNA为模板,ITS1/ITS4为引物扩增得到长度542 bp的序列,GenBank接收号为MK728960。该菌株序列经NCBI在线BLAST比,与GenBank号为MH700457.1、MF379341.1的胶孢炭疽菌(Colletotrichumgloeosporioides)的碱基序列覆盖度达100%,序列相似度高达99%。用MEGA7.0 NJ法构建系统发育树后发现其形成明显的分枝,其中菌株CB-2与不同菌株来源的胶孢炭疽菌聚类为同一分枝(图3),遗传距离最近,结合形态学特征确定菌株CB-2为胶孢炭疽菌(Colletotrichumgloeosporioides)。
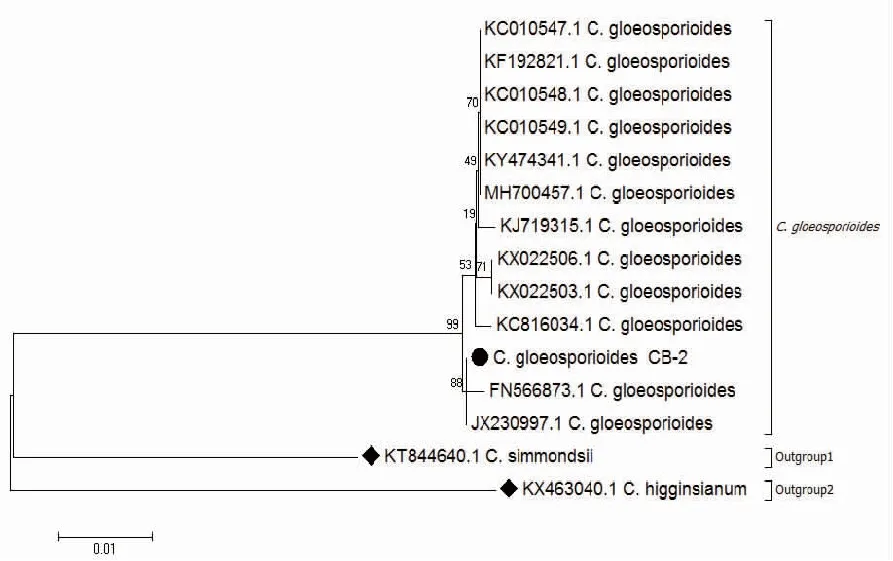
注:●为菌株CB-2,◆为外源菌株。
2.3 不同因素对胶孢炭疽菌菌丝体生长的影响
2.3.1 培养基 从图4可知,PSA培养基最利于胶孢炭疽菌菌落的生长,培养5 d后的菌落直径达9 cm,且菌丝最为茂密。在燕麦培养基上菌落生长速度仅次于PSA培养基,但在燕麦培养基上菌丝生长太过稀薄。在PDA+楠木叶煎汁琼脂培养基上菌落直径位于燕麦培养基之后。在察氏、SNA、PDA+维生素B6培养基中菌落生长较慢,在PDA、虎红培养基上菌落直径显著降低,在对照组WA培养基上基本不生长。PSA培养基菌落直径显著大于其余培养基,WA培养基菌落直径显著小于其余培养基,其余基培养基间菌落直径差异显著或不显著。

图4 不同培养基闽楠叶斑病病原菌菌丝的生长状况
2.3.2 温度、pH与光照 从图5看出,不同温度、pH和光照下闽楠叶斑病病原菌菌落的生长状况。温度:病菌菌落在15~35℃均可生长,以25℃时菌丝的生长速度最快,各温度下菌丝的生长速度依次为25℃>30℃>20℃>15℃>35℃。其中,25℃时菌丝的生长速度显著大于除30℃外的其余温度处理,35℃菌丝的生长速度显著小于其余温度处理。pH:为9.0时菌落直径最大,各pH下菌落的生长速度依次为pH 9.0>pH 7.0>pH 8.0>pH 5.0>pH 6.0,pH 9.0与pH 7.0菌落直径显著大于其余pH处理,但二者间差异不显著,其余pH处理间差异不显著,表明该菌株不适宜在过酸或过碱的环境下生长。光照:全光照条件下菌落生长最好,菌落直径为9 cm;光暗交替次之,菌落直径为4.6 cm;全黑暗条件最差,菌落直径为3.9 cm;全光照显著大于光暗交替和全黑暗,光暗交替和全黑暗间差异不显著。此外,在全黑暗情况下,菌丝生长扩散性不强,生长比较密集,趋于块状生长。
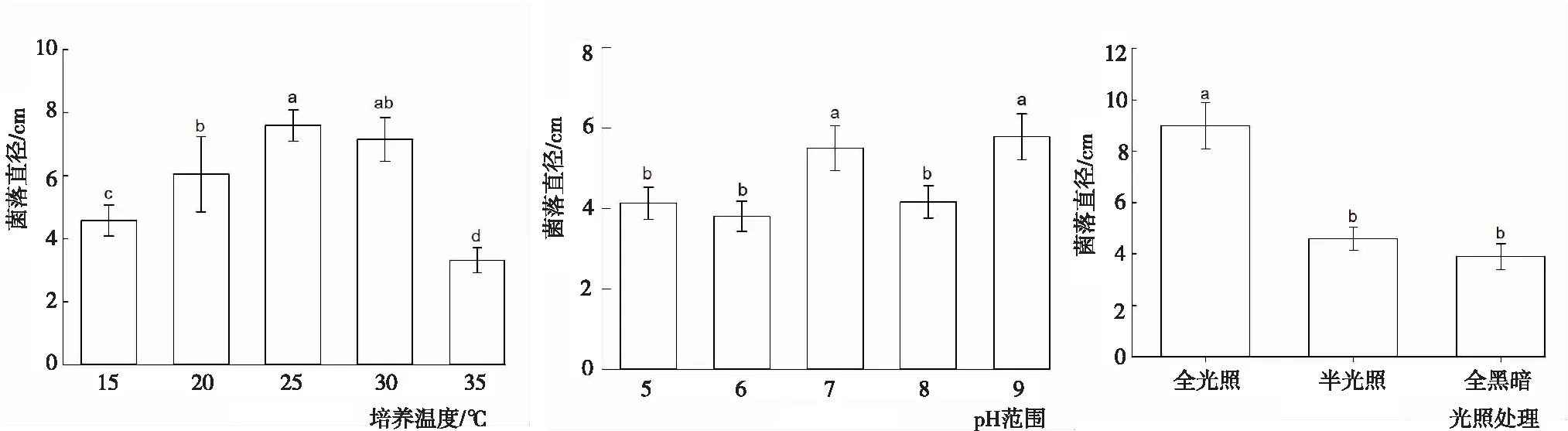
图5 不同温度、pH和光照下闽楠叶斑病病原菌菌丝的生长状况
2.3.3 碳源与氮源 从图6可知,不同碳源和氮源下闽楠叶斑病病原菌菌落生长的变化。碳源:各处理菌株均可生长,但菌落直径存在差异。菌落直径以麦芽糖最大,为4.90 cm;对照最小,为1.6 cm;各处理依次为麦芽糖>葡萄糖>蔗糖>果糖>可溶性淀粉>乳糖>对照。其中,麦芽糖显著大于除葡萄糖和蔗糖外的其余处理,对照显著小于其余处理,其余处理间差异显著或不显著。氮源:各处理菌株均可生长,但菌落直径存在差异。菌落直径以酵母浸粉最大,为4.3 cm;尿素最小,为0.5 cm;各处理依次为酵母浸粉>硝酸铵>蛋白胨>牛肉膏>对照>尿素。酵母浸粉显著大于其余处理,尿素显著小于除对照外的其余处理,其余处理间差异显著或不显著。
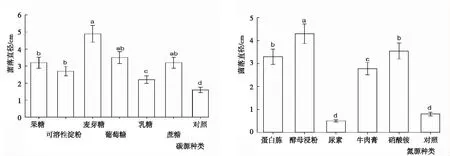
图6 不同碳源与氮源下闽楠叶斑病病原菌菌丝的生长状况
2.3.4 胶孢炭疽菌菌丝致死温度 不同温度水浴处理结果表明,菌丝块在35~45℃水浴处理10 min后,置于PDA平板上培养,均可正常长出菌丝,50℃、55℃和60℃处理10 min,培养10 d后仍未观察到菌丝生长。可见,胶孢炭疽菌菌丝的致死温度为50℃下10 min。
3 结论与讨论
闽楠是我国特有树种,该树种的生理特性、苗木繁育、群落生态、遗传多样性和野外资源等已有研究报道[11-14],但对闽楠病害的研究报道极少。陈全助等[9]研究结果表明,引起闽楠叶斑病的病原菌为小孢拟盘多毛孢(Pestalotiopsismicrospora)。研究结果表明,除P.microspora可引起闽楠叶斑病外,胶孢炭疽菌(C.gloeosporioides)也可引起闽楠叶斑病的发生。C.gloeosporioides寄主范围广泛,可侵染山楂、苹果、桂花、决明子和柿树等多种树种,引起相关病害[15-19],C.gloeosporioides侵染闽楠叶片引起叶斑病为国内首次报道。
研究结果表明,C.gloeosporioidesCB-2的生物学特性与张翊等对C.gloeosporioides的生物学特性研究结果不完全一致[20],这可能与菌株来源不同或菌株所处环境差异有关。C.gloeosporioidesCB-2在25℃时更利于菌株的生长,当温度继续升高或下降菌株生长均呈下降趋势。推测闽楠叶斑病的发生多在25℃左右,因此,在这个温度对应的季节之前应做好该病害的防控工作。全光照更利于菌株的生长,结合闽楠自身生长特性为阴性树种,因此,要尽量避免闽楠幼苗栽植在光照较强的地域,或在幼苗栽植过程中做好遮阴处理,即可满足闽楠自身生长特性所需,也可减少闽楠叶斑病的发生。另外,结合C.gloeosporioidesCB-2的其他生物学特性及闽楠生长特性,在其幼苗栽植及管护过程中要注意合理的播种密度,保持苗木通风,适度喷灌,控制幼苗期光照时长,做好遮阴处理,在温度达25℃前做好病害的防控工作。

