慢加急性乙型肝炎肝衰竭患者血清自噬相关蛋白水平及其临床意义探讨*
黄霜湘,姚朝光,蓝 婧,欧 琴,覃冬林,陈丽芬,黄洁婕
肝衰竭可由病毒感染、酒精性、药物性肝病和其他等原因引起,导致严重的肝脏合成、解毒、排泄和生物转化功能障碍,临床主要表现为凝血功能障碍、黄疸、腹水等,肝组织病理学特征为大块肝坏死,临床病死率可高达60%以上[1-3]。慢加急性肝衰竭(acute on chronic liver failure,ACLF)是指在慢性肝病的基础上出现新的肝细胞坏死性病变引起的肝衰竭,我国以乙型肝炎病毒(hepatitis B virus,HBV)感染引起的ACLF(HBV-ACLF)最为普遍[4-6]。近年研究发现,HBV-ACLF临床尚无特效治疗药物、病死率高,对患者预后进行准确的判断,并适时开展人工肝支持系统或血液净化治疗,对合理利用医疗资源,改善患者预后意义重大。有关血清学指标预测肝衰竭患者临床转归的研究报道较多,比如应用血清凝血酶原活动度、国际标准化比值(international standard ratio,INR)、血清胆碱酯酶和C反应蛋白等一系列肝功能指标或细胞因子以判断肝损害或肝衰竭患者的预后[7,8]。然而,由于发病机理的复杂性,这些指标对患者预后转归的判断价值都存在局限性,因此需要更多研究来发现更多的相关因子。自噬是过量物质或损坏或老化的细胞器被分解的过程,在ACLF等肝脏疾病的发生、发展过程中发挥重要的作用。p62、Beclin1和微管相关蛋白1轻链3-Ⅱ(LC3-Ⅱ)为自噬相关蛋白,但较少用于HBV-ACLF患者预后的评估[9,10]。本研究探讨了应用血清自噬相关蛋白对HBV-ACLF患者预后的预测价值,现报道如下。
1 资料与方法
1.1 研究对象 2018年9月~2020年9月我院收治的HBV-ACLF患者60例,男36例,女24例;年龄31~58岁,平均年龄为(43.7±4.7)岁。ACLF诊断符合《肝衰竭诊治指南(2018年版)》的诊断标准[11],有乙型肝炎病史。排除标准:有饮酒习惯(女性大于20 g/d,男性大于40 g/d),酒精性肝炎或其他病因导致的ACLF、合并甲状腺功能改变性疾病、合并恶性肿瘤、近2个月内应用过免疫抑制剂者。另选择同期健康人65例作为对照,男35例,女30例;年龄30~62岁,平均年龄为(44.9±5.4)岁。两组性别和年龄比较无显著性差异(P>0.05)。纳入的所有HBV-ACLF患者签署知情同意书,本研究经本院医学伦理委员会审核。
1.2 血清指标检测 采集静脉血3 mL,3000 r/m离心10 min,分离血清。采用ELISA法检测血清p62、LC3-Ⅱ和Beclin1水平(优尼康公司试剂,美国Bio-Rad公司生产的680型全自动酶标仪);使用日本佳能TBA-FX8型全自动生化分析仪及其配套试剂盒检测血生化指标;采用荧光定量聚合酶链反应法测定血清HBV DNA(试剂盒购自贝克曼库尔特有限公司)。终末期肝病模型评分(model for end-stage liver disease,MELD)=3.78×ln[TBIL(mg/dl)]+11.2×ln[INR]+9.57×ln[sCr(mg/dl)]+6.43。
1.3 治疗方法 所有HBV-ACLF患者均接受内科综合治疗,包括抗病毒、护肝、退黄、促肝细胞再生、调节免疫功能等,并根据病情间断给予血浆置换或血液滤过支持治疗,必要时进行血浆置换联合血液滤过或双重血浆分子吸附系统联合血液滤过治疗。

2 结果
2.1 两组血清HBV DNA和肝功能指标比较 60例HBV-ACLF患者血清TBIL、ALB和INR水平显著异常(表1)。
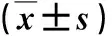
表1 两组血清HBV DNA和肝功能指标比较
2.2 两组血清自噬相关蛋白水平比较 HBV-ACLF患者血清LC3-Ⅱ和Beclin1水平显著高于健康人,而血清p62水平显著低于健康人(P<0.05,表2)。
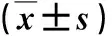
表2 两组血清自噬相关蛋白水平比较
2.3 不同疾病转归的HBV-ACLF患者血清自噬相关蛋白水平和MELD评分比较 本组患者在治疗观察的90 d,死亡18例(30.0%);入院时,死亡的HBV-ACLF患者血清LC3-Ⅱ、Beclin1水平和MELD评分均显著高于生存组,而血清p62水平显著低于生存组(P<0.05,表3)。
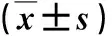
表3 不同转归的HBV-ACLF患者血清自噬相关蛋白和MELD评分比较
2.4 MELD和血清自噬相关蛋白联合预测HBV-ACLF患者预后的效能分析 以MELD评分>18.3 分为截断点预测HBV-ACLF患者不良预后的曲线下面积(area under the curve,AUC)为0.917,约登指数为0.758,其敏感度为93.7%,特异性为82.1%;以血清p62<2.2 ng/mL为截断点,预测HBV-ACLF患者不良预后的AUC为0.856,约登指数为0.485,其敏感度为85.2%,特异性为63.3%;以血清LC3-Ⅱ>70.3 ng/mL为截断点预测HBV-ACLF患者不良预后的AUC为0.820,约登指数为0.588,其敏感度为80.0%,特异性为78.8%;以血清Beclin1>12.6 ng/mL为截断点预测HBV-ACLF患者不良预后的AUC为0.765,约登指数为0.399,其敏感度为79.6%,特异性为60.3%;应用三者联合预测HBV-ACLF患者死亡的AUC为0.910,其敏感度为95.2%,特异性为80.0%,预测价值显著优于任何一个单因素预测(Z=2.998、Z=3.025、Z=3.548,P<0.05,图1)。
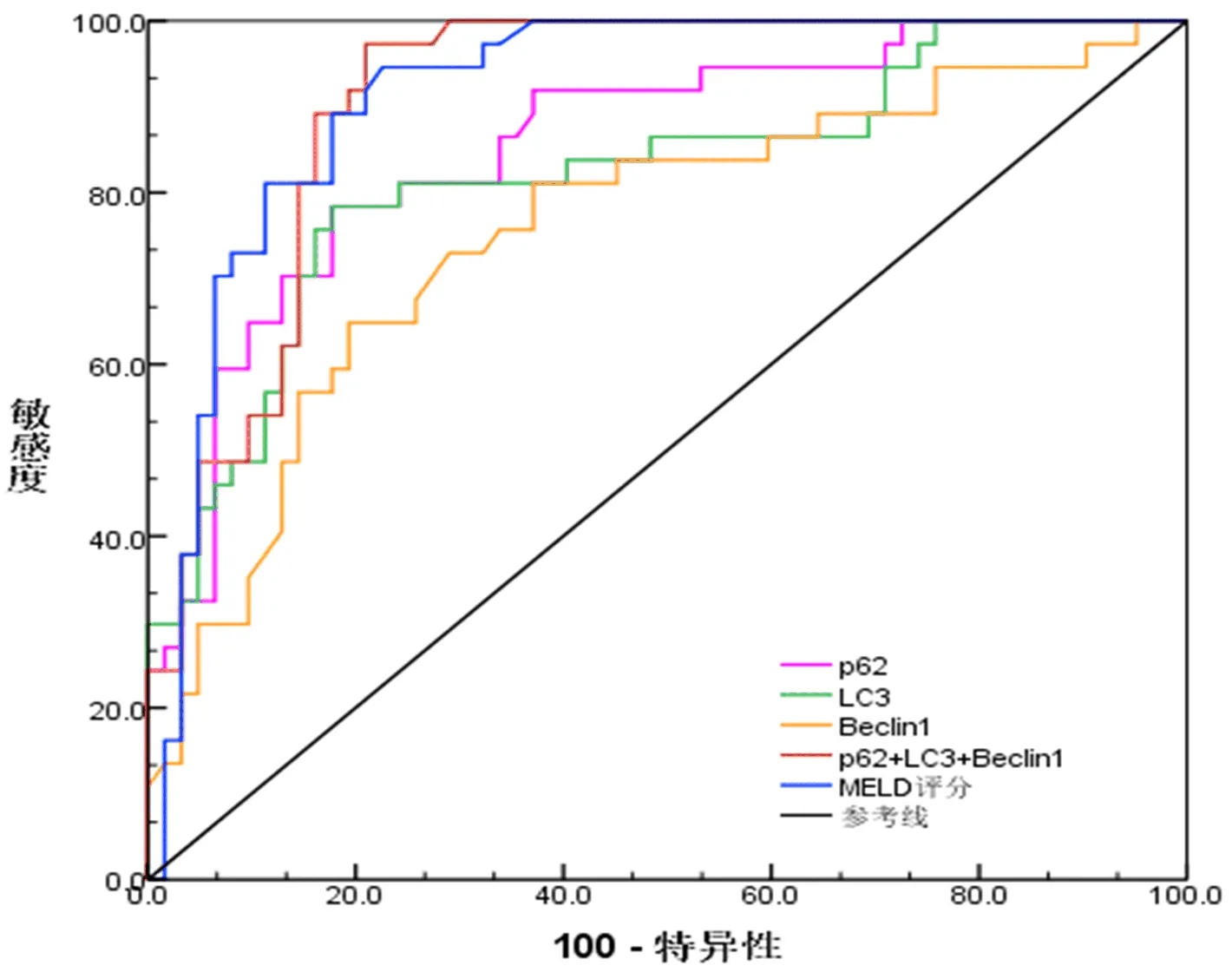
图1 MELD评分和血清自噬相关蛋白联合预测HBV-ACLF患者预后的ROC曲线分析
3 讨论
肝脏疾病的最终预后取决于多种因素,但目前针对失代偿期肝硬化和肝衰竭患者的治疗还存在诸多问题[12,13]。因此,如何有效控制肝病的发展、准确评估疗效、预测预后,对于肝衰竭患者选择合适的治疗方法和时机非常重要。目前,自噬在疾病发病过程中的作用是研究的热点之一。自噬在细胞的生长发育和生物学功能发挥方面起着维稳的功能。然而,当细胞的损伤超过了细胞自身的修复能力时,将启动吞噬死亡[14]。为了进一步探讨自噬在HBV-ACLF发病过程中的作用,为临床干预治疗提供依据,本研究对比分析了不同预后的HBV-ACLF患者血清自噬相关蛋白水平的变化差异。
LC3是一个位于自噬双膜上的自噬相关蛋白,编码LC3的基因与Atg8是同源的,主要参与自噬的延展,在细胞内以LC3-I和LC3-Ⅱ的形式存在。在机体自噬激活时,LC3-I通过泛素化修饰,与磷脂酰乙醇胺聚合而延长双层膜,最终形成LC3-Ⅱ型。LC3-Ⅱ可被用于标志自噬水平;Beclin 1是在自噬过程中在哺乳动物体内最早发现的肿瘤抑癌基因之一,通过与多种辅因子相结合调节Vps-34活性,形成Beclinl-Vps34-Vpsl5复合体,诱导自噬的启动[15,16]。本研究中,HBV-ACLF患者血清LC3-Ⅱ和Beclin 1显著高于健康人,说明HBV-ACLF患者体内自噬水平出现异常,究其原因可能是细胞内环境在慢性炎症疾病的影响下发生改变,而HBV DNA载量增多也会提升细胞自噬水平,这一结论在一些研究[17]中也得到了证实;p62蛋白作为自噬降解底物,一般与LC3-Ⅱ和泛素化蛋白质聚合,其C端和N端分别结合泛素化蛋白LC3-Ⅱ,集成到自噬吞噬体中,然后在自噬溶酶体降解,其水平与自噬功能成反比[18,19]。本研究中,HBV-ACLF患者血清p62显著低于健康人,与HBV-ACLF患者肝功能下降和肝组织改变导致自噬激活有关。所以,HBV-ACLF患者细胞自噬水平增强。本研究发现死亡组HBV-ACLF患者入院时MELD评分显著高于生存组,MELD评分系统在终末期肝病患者的预后评估中优势明显[20,21]。值得关注的是,死亡的HBV-ACLF患者血清LC3-Ⅱ水平显著高于生存组,血清p62水平显著低于生存组,提示自噬相关蛋白与HBV-ACLF患者预后有一定的关联。HBV-ACLF患者自噬被激活,随着肝功能的减退,自噬相关蛋白水平发生了显著的改变。自噬相关蛋白诱导细胞对于损伤细胞器和蛋白的降解能力显著提升,与疾病的预后关系密切。
本研究应用ROC曲线评估三种自噬蛋白对患者预后的预测价值,发现以血清p62<2.2 ng/mL为截断点预测HBV-ACLF预后不良的AUC为0.856;分别以LC3-Ⅱ>70.3 ng/mL和Beclin1>12.6 ng/mL为截断点预测HBV-ACLF预后不良的AUC为0.820和0.765,三者联合预测HBV-ACLF预后不良的AUC为0.910,显著优于三者单独预测,与MELD评分的预测价值相近,提示三者联合对HBV-ACLF患者预后的预测价值较高。今后在临床治疗中,可以对HBV-ACLF患者自噬相关蛋白水平进行动态检测和分析,进一步研究其变化规律和影响因素,有望成为预测HBV-ACLF患者预后的新的标志物。但本研究病例来自同一医院、随访时间较短,研究结果可能存在一定的偏差,有待扩大样本量进行多中心和前瞻性的研究,进一步探究HBV-ACLF患者血清p62、Beclin1和LC3-Ⅱ水平检测的临床意义。
综上所述,本研究60例HBV-ACLF患者血清自噬相关蛋白水平显著不同于正常人,应用三者联合可为HBV-ACLF患者的预后评估提供更为准确的预测方法。

