非酒精性脂肪性肝病合并2型糖尿病患者外周血miR-17、miR-20a和miR-20b变化及其临床意义*
葛海燕,匡 霞,周瑞君
非酒精性脂肪性肝病(nonalcoholic fatty liver disease,NAFLD)和2型糖尿病(type 2 diabetes mellitus,T2DM)是我国居民特别是老年群体的常见疾病[1,2]。近年来研究发现,普通人群NAFLD发病率约为20%~30%,而T2DM人群中NAFLD发病率可达60%~80%[3,4]。NAFLD患者进展为非酒精性脂肪性肝炎(nonalcoholic steatohepatitis,NASH)和肝纤维化还可导致肝硬化和肝细胞癌。NAFLD与T2DM 之间存在复杂的病理学相互作用,值得引起重视[5,6]。探讨NAFLD和T2DM相关标志物对于早期诊疗和治疗药物的开发具有重要的意义。研究发现,微小RNA(micro RNA,miRNA)作为一种短序列小分子,广泛参与NAFLD和T2DM的疾病发生、发展过程,但在NAFLD合并T2DM患者,它们的表达谱改变研究还较少,且存在一定的争议。miRNA分子用于NAFLD合并T2DM患者的临床诊断、病情和疗效评估及预后判断的价值还有待阐明[7,8]。本研究检测了NAFLD合并T2DM患者外周血miR-17、miR-20a和miR-20b水平变化,以判断其临床意义,现将结果报道如下。
1 资料与方法
1.1 一般资料 2018年12月~2020年6月我院收治的T2DM患者46例,男性19例,女性27例;年龄39~65岁,平均年龄为(55.9±6.7)岁;NAFLD合并T2DM患者50例(轻度19例、中度17例和重度14例),男性25例,女性25例;年龄28~67岁,平均年龄为(46.1±6.5)岁。NAFLD诊断符合《非酒精性脂肪性肝病防治指南(2018年更新版)》[9],无过量饮酒(或饮酒量折合乙醇男性<40 g/d,女性<20 g/d)。T2DM诊断符合《中国2型糖尿病防治指南(2017年版)》[10],空腹血糖≥7.0 mmol/L和(或)餐后2 h血糖≥11.1 mmol/L。排除标准:存在全身炎症性疾病、自身免疫性肝炎、病毒性肝炎、酒精性肝炎或恶性肿瘤者;近2个月内有服用降糖药物史;妊娠期或哺乳期妇女;合并心、脑、肾等脏器功能严重不全者。患者签署知情同意书,本研究经医院医学伦理委员会审核通过。
1.2 外周血miR-17、miR-20a和miR-20b mRNA检测 无菌抽取外周静脉血3 mL,离心,提取总RNA(日本TAKARA公司),将RNA逆转录为cDNA,将样品保存于-80℃冰箱。采用实时荧光定量RT-PCR法扩增miR-17、miR-20a和miR-20b目标片段,扩增反应体系为20μL,反应条件:95℃ 3 min,95℃ 30 s,56℃ 30 s,72℃ 28 s,35个循环完成后,72℃ 10 min。以β-action为内参基因,在反应结束后,以2-ΔΔct法得出3指标的相对水平。引物由南京擎科生物公司合成,使用美国罗氏公司生产的Cobas Lightcycle480z荧光定量PCR仪。
1.3 血生化指标检测 使用日本奥林巴斯公司生产的AU2700型全自动生化分析仪检测。

2 结果
2.1 两组BMI和血脂指标比较 NAFLD合并T2DM患者BMI、血清TG、TC和LDL-C水平显著高于T2DM患者(P<0.05),而血清HDL-C水平显著低于T2DM患者(P<0.05,表1)。
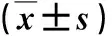
表1 两组BMI和血脂指标比较
2.2 两组血清miR-17、miR-20a和miR-20b mRNA水平比较 NAFLD合并T2DM患者外周血miR-17、miR-20a和miR-20b mRNA水平显著高于T2DM患者(P<0.05,表2)。
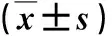
表2 两组血清miR-17、miR-20a和miR-20b mRNA水平比较
2.3 不同严重程度NAFLD患者血清miR-17、miR-20a和miR-20b mRNA水平比较 重度组血清miR-17、miR-20a和miR-20b mRNA水平显著高于中度组或轻度组(P<0.05),中度组血清miR-17、miR-20a和miR-20b mRNA水平显著高于轻度组(P<0.05,表3)。
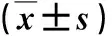
表3 不同程度NAFLD患者血清miRNA水平比较
2.4 NAFLD合并T2DM的多因素Logistic回归分析 结果显示,BMI、LDL-C、miR-17、miR-20a和miR-20b是NAFLD合并T2DM的独立危险因素(P<0.05,表4)。
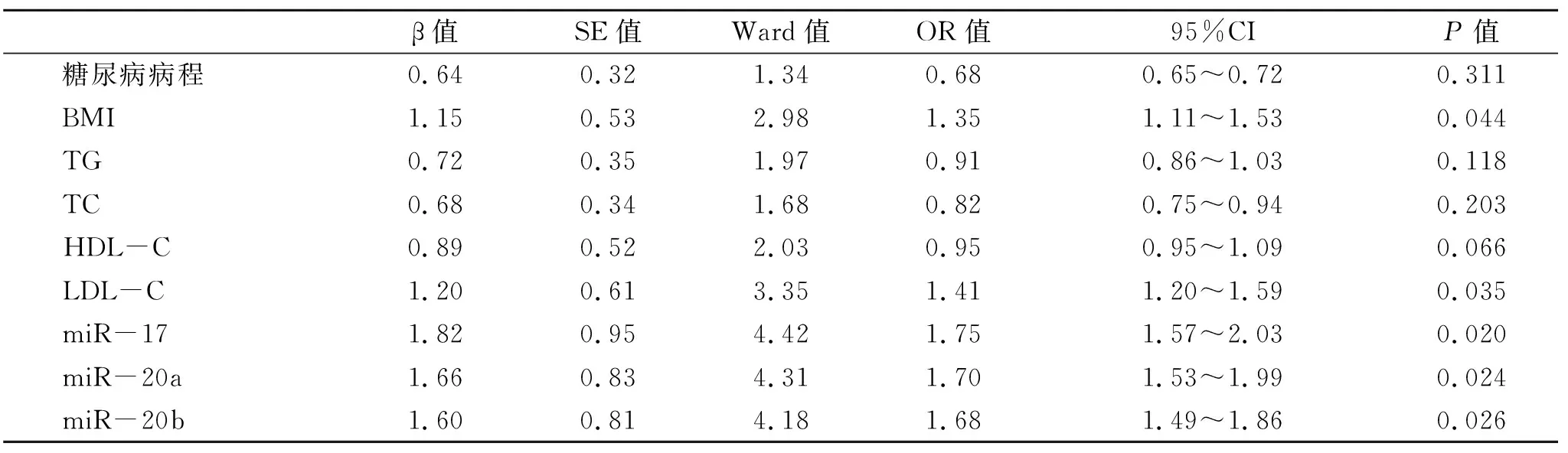
表4 NAFLD合并T2DM的多因素Logistic回归分析
2.5 血清 miR-17、miR-20a、miR-20b诊断严重NAFLD的效能分析 经ROC分析显示,血清miR-17、miR-20a、miR-20b诊断严重NAFLD的AUC分别为0.75、0.74、0.70(P<0.05,表5,图1)。
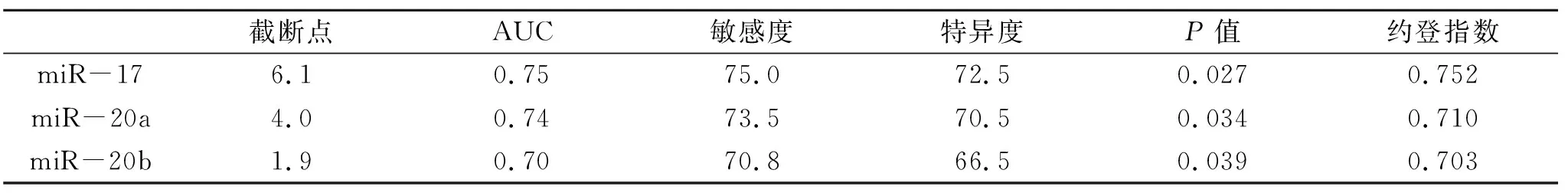
表5 各指标诊断严重NAFLD的效能
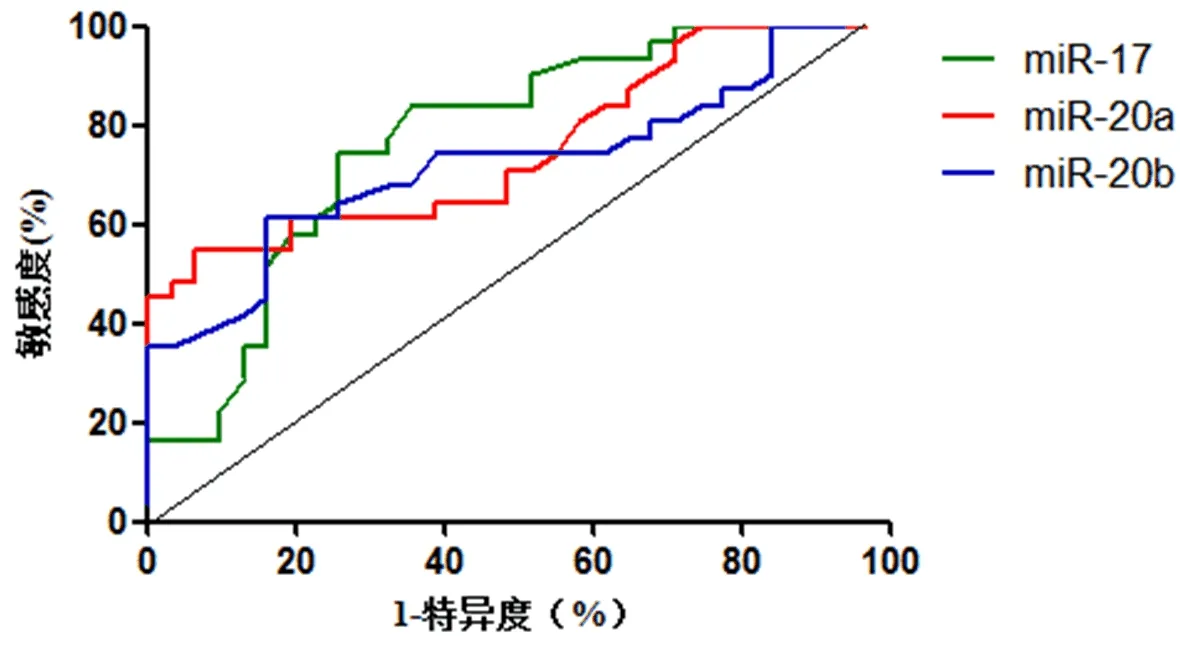
图1 血清miRNA诊断严重NAFLD的ROC曲线
3 讨论
相关研究发现NAFLD合并T2DM患者糖脂代谢失衡更为严重,全身炎症水平较高,T2DM和NALFLD进展的倾向更为明显,对其机制进行研究对于改善患者生存质量,延长寿命具有重要的意义[11-15]。T2DM患者存在多种合并症,仅依赖社区血糖监测和降糖药物治疗难以避免并发症的发生。NAFLD早期发病较为隐匿,对其确诊依赖于组织病理学检查,目前临床上主要以影像学检查、血清学检查对其进行评估。
miRNA可抵抗核糖核酸酶的降解过程保持相对稳定,因此循环血miRNA水平被报道对于多种疾病具有良好的诊断效能,还可用于多种疾病的病情和治疗反应的评估,并对预后有一定的预测价值,是具有潜力的血液生物标志物[16,17],但目前研究有关NAFLD患者miRNA谱变化存在一定的争议。采用微阵列技术研究发现,NAFLD合并T2DM患者血清miR-17、miR-20a和miR-20b 水平显著升高[18],与本研究结果一致。NAFLD合并T2DM患者血清miR-17、miR-20a和miR-20b 水平变化的临床意义尚需进一步阐明。本研究比较了不同严重程度的NAFLD患者血清miR-17、miR-20a和miR-20b mRNA水平的变化,结果显示随着NAFLD严重程度的加重,血清miR-17、miR-20a和miR-20b 水平也不断升高,提示血清miR-17、miR-20a和miR-20b 可能参与了NAFLD患者发生T2DM的过程,还可能影响NAFLD患者的病情进展。
已有T2DM和NAFLD患者血清miR-17、miR-20a和miR-20b 水平变化的研究报道,体外研究发现,miR-17和miR-20a异位表达可以显著抑制肝细胞Pknox1的表达,而miR-17和miR-20a过表达还可导致HepG2和L02细胞胰岛素敏感性显著提高并减少肝脏脂肪变性[19]。miR-17 可通过靶向调控CYP7A1的方式调控脂肪变性过程,降低HepG2细胞miR-17水平可加剧肝脂肪变性程度[20]。此外,miR-17还可靶向调控Tcf7l2上调成脂分化过程,而Tcf7l2作为Wnt通路的关键效应因子,被认为是T2DM发病的关键风险基因。同时,miR-20a过表达导致肝糖原合成增多,并通过靶向p63激活AKT/GSK信号通路,参与糖生成过程,而miR-20b可通过调控CD36表达影响脂质代谢,在甘油三酯的异常积累中发挥关键作用。这些研究表明,上述miRNAs均在调节肝脏内胆固醇和糖脂代谢等能量代谢过程中发挥重要作用。本研究通过Logistic回归分析发现,血清miR-17、miR-20a和miR-20b 水平与BMI和LDL-C均是导致NAFLD合并T2DM的危险因素,结合其它学者研究可知,miR-17、miR-20a、miR-20b 可能通过调控肝脏糖和脂质代谢,在NAFLD患者发生T2DM过程中发挥一定的生物学功能,但其是否依赖于相同或相似的作用机制进行调节尚未明确,值得进一步研究。
本研究经ROC分析显示血清miR-17、miR-20a和miR-20b 对于严重的NAFLD具有一定的评估效能,是具有潜力的生物标志物。虽然临床已报道了较多血清学指标用于NAFLD的临床评估,但单指标往往存在灵敏度高,但特异性低的缺陷,联合更多的指标对于提高诊断效能具有明显的益处。目前,研究已阐明的NAFLD患者发生T2DM的发生机制有氧化应激、内质网应激改变、炎症反应和凋亡等。当出现胰岛素抵抗时,周围组织对胰岛素敏感性下降,葡萄糖利用率降低,导致糖和脂质代谢的综合性紊乱。血清miR-17、miR-20a和miR-20b在NAFLD发病过程中具体作用机制和对肝纤维化评估的作用仍不明确。本研究结果发现NAFLD合并T2DM患者外周血miR-17、miR-20a和miR-20b水平显著上升,它们可能参与了NAFLD并发T2DM的发病过程,并对NAFLD的严重程度具有一定的诊断效能。但由于本研究是单中心研究,纳入病例数少,可能存在选择偏倚等缺陷,所得结论有待后续研究的不断完善和补充。

