NOD样受体热蛋白结构域相关蛋白3对哮喘小鼠气道炎症反应及细胞焦亡的调控作用
惠超 刘馨
(锦州医科大学附属第一医院检验科,辽宁锦州 121000)
支气管哮喘是儿科常见的呼吸系统疾病,是一类以可逆性气流受限为特征的慢性气道炎症性疾病,中性粒细胞、嗜酸性粒细胞、淋巴细胞等多种炎性细胞在气道内大量浸润所介导的炎症反应、细胞焦亡与该病的发病密切相关[1-2]。目前,哮喘发病的具体分子机制及发病过程中炎症反应、细胞焦亡的调控机制尚不十分清楚。NOD样受体热蛋白结构域相关蛋白3(nod-like receptor,pyrin domain containing3,NLRP3)是在呼吸系统内发挥重要作用的模式识别受体,与凋亡相关斑点样蛋白、含半胱氨酸的天冬氨酸蛋白水解酶-1(cysteinyl aspartate specific proteinase-1,caspase-1)组成炎症小体,激活后的生物学效应是生成裂解型caspase-1(cleaved caspase-1),促进白细胞介素(interleukin,IL)-1β及IL-18的释放,并介导炎症反应,同时促进Gasdermin D(GSDMD)剪切为GSDMD-N并介导细胞焦亡[3-4]。已有哮喘相关的研究证实哮喘患者血清中IL-1β、IL-18的含量增加[5-6],哮喘小鼠肺组织中NLRP3表达增加[7],但NLRP3在哮喘发病中的直接生物学作用尚未见报道。本研究将通过NLRP3基因敲除(knockout,KO)的方式观察NLRP3在支气管哮喘发病中的作用,具体探究NLRP3对哮喘小鼠气道炎症反应及细胞焦亡的调控作用,以期为今后深入认识哮喘的发病机制提供实验依据。
1 材料与方法
1.1 动物
NLRP3野生型(wild type,WT)C57BL/6J小鼠、NLRP3KOC57BL/6J小鼠均购自上海南方模式生物研究中心。
1.2 试剂与仪器
卵白蛋白(ovalbumin,OVA)、氢氧化铝凝胶(Sigma公司,美国),苏木精-伊红染色试剂盒(上海碧云天生物技术有限公司),IL-1β、IL-18的酶联免疫吸附法检测试剂盒(上海酶联生物科技有限公司),NLRP3、cleaved caspase-1、GSDMD-N及β-actin一抗(Abcam公司,美国)。
全身体积描记检测系统(巴克西科公司,美国),显微镜(尼康公司,日本),酶标仪(南京德铁实验设备有限公司),凝胶电泳系统(Bio-Rad公司,美国),凝胶成像系统(上海勤翔科学仪器有限公司)。
1.3 动物分组及造模
NLRP3WT小鼠分为NLRP3-WT对照组、NLRP3-WT哮喘组,NLRP3KO小鼠分为NLRP3-KO对照组、NLRP3-KO哮喘组,每组各10只。参照文献[7-8]进行哮喘模型制备,方法如下:第1、7、14天时给予OVA与氢氧化铝凝胶混悬液0.2 mL(100μg OVA、1 mg氢氧化铝凝胶溶于0.2 mL 0.9%氯化钠溶液)腹腔注射致敏;第21天起每天给予5%OVA雾化吸入,每次持续30 min,连续7 d进行激发。对照组用等体积0.9%氯化钠溶液代替OVA与氢氧化铝凝胶混悬液进行腹腔注射、代替OVA进行雾化吸入。末次雾化吸入激发24 h后进行标本收集。
1.4 气道反应性的检测
末次雾化吸入激发24 h后,将小鼠放入全身体积描记检测系统,记录3 min的基线读数后给予乙酰甲胆碱25.0 g/L雾化吸入3 min并记录读数,根据配套的Cough analyzer系统计算增强呼气间歇(enhanced pause,Penh)。
1.5 支气管肺泡灌洗液的收集及检测
完成气道反应性检测后对小鼠进行麻醉,采用1 mL预冷的磷酸盐缓冲液进行肺泡灌洗,得到支气管肺泡灌洗液(bronchoalveolar lavage fluid,BALF)后在离心机中以4℃、15 000 r/min的条件离心5 min,收集上清并采用酶联免疫吸附法试剂盒检测IL-1β、IL-18的含量;收集沉淀并加入双蒸水0.2 mL定容,Diff-quick染色后在显微镜下对中性粒细胞、嗜酸性粒细胞、淋巴细胞进行计数。
1.6 肺组织苏木精-伊红染色
完成BALF收集后处死小鼠,收集适量肺组织,0.9%氯化钠溶液清洗后4%多聚甲醛固定,制作4μm厚度的病理切片后采用苏木精-伊红染色试剂盒进行染色实验,在显微镜下观察肺组织形态学表现,按照下列标准进行炎症评分[8]:无炎性细胞浸润为0分,偶见炎性细胞浸润为1分,多数支气管或血管表层见1~2个炎性细胞为2分,中层见3~5个炎性细胞为3分,厚层见5个以上炎性细胞为4分。
1.7 Western blot法检测肺组织中蛋白表达水平
取适量肺组织,采用组织裂解液进行匀浆,匀浆液在离心机中以4℃、12 000 r/min的条件离心10 min,收集上清并检测蛋白浓度。根据检测结果将30μg蛋白样本用于Western blot实验,在SDS-聚丙烯酰胺凝胶中进行电泳,分离不同分子量的蛋白,电转移至硝酸纤维素膜,用5%脱脂牛奶室温封闭硝酸纤维素膜1 h;用1∶1 000稀释的NLRP3、cleaved caspase-1、GSDMD-N一 抗 或1∶2 500稀释的β-actin一抗4℃孵育硝酸纤维素膜16~24 h;而后用1∶2 000稀释的二抗室温孵育硝酸纤维素膜1 h,最后在凝胶成像系统中进行蛋白显影及表达水平的半定量分析。结果以目的蛋白NLRP3、cleaved caspase-1、GSDMD-N与内参蛋白β-actin的比值表示。
1.8 统计学分析
采用SPSS22.0软件对数据进行统计学分析,采用Prism 6.0软件进行数据的制图。符合正态分布的计量资料以均数±标准差(±s)表示,多组间比较采用单因素方差分析,组间两两比较采用LSD-t法,P<0.05为差异有统计学意义。
2 结果
2.1 各组小鼠肺组织中NLRP3表达水平的鉴定
NLRP3-WT对照组、NLRP3-WT哮喘组小鼠肺组织中均表达NLRP3,且NLRP3-WT哮喘组小鼠肺组织中NLRP3的表达水平(0.91±0.16)高于NLRP3-WT对照组(0.38±0.08,t=15.575,P<0.05)。NLRP3-KO对照组、NLRP3-KO哮喘组小鼠肺组织中均不表达NLRP3。见图1。

图1 Western blot法检测各组小鼠肺组织中NLRP3表达水平电泳图
2.2 各组小鼠气道反应性的变化
NLRP3-WT对照组、NLRP3-WT哮喘组、NLRP3-KO对照组、NLRP3-KO哮喘组小鼠的Penh分别为117±14、375±63、108±15、189±25,差异有统计学意义(F=20.398,P<0.001)。与NLRP3-WT对照组比较,NLRP3-WT哮喘组小鼠的Penh明显升高(P<0.05),NLRP3-KO对照组小鼠的Penh水平无明显变化(P>0.05);与NLRP3-WT哮喘组比较,NLRP3-KO哮喘组小鼠的Penh水平明显降低(P<0.05)。
2.3 各组小鼠BALF中各细胞计数变化
与NLRP3-WT对照组比较,NLRP3-WT哮喘组小鼠BALF中性粒细胞、嗜酸性粒细胞、淋巴细胞计数明显升高(P<0.05),NLRP3-KO对照组小鼠BALF中性粒细胞、嗜酸性粒细胞、淋巴细胞计数无明显变化(P>0.05);与NLRP3-WT哮喘组比较,NLRP3-KO哮喘组小鼠BALF中性粒细胞、嗜酸性粒细胞、淋巴细胞计数明显降低(P<0.05)。见表1。
表1 各组小鼠BALF中性粒细胞、嗜酸性粒细胞、淋巴细胞计数比较 (±s,×105/mL)
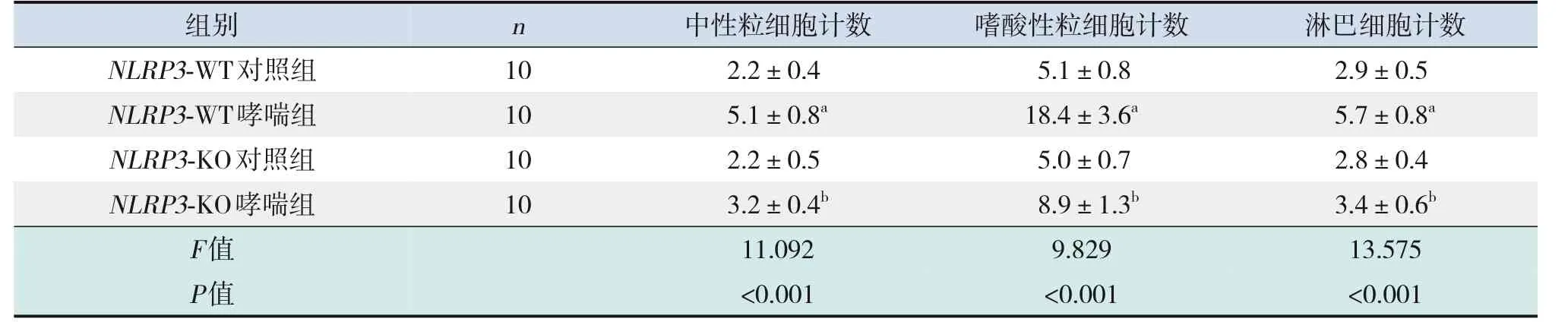
表1 各组小鼠BALF中性粒细胞、嗜酸性粒细胞、淋巴细胞计数比较 (±s,×105/mL)
注:a示与NLRP3-WT对照组比较,P<0.05;b示与NLRP3-WT哮喘组比较,P<0.05。
n 组别NLRP3-WT对照组NLRP3-WT哮喘组NLRP3-KO对照组10 10 10淋巴细胞计数2.9±0.5 5.7±0.8a 2.8±0.4中性粒细胞计数2.2±0.4 5.1±0.8a 2.2±0.5嗜酸性粒细胞计数5.1±0.8 18.4±3.6a 5.0±0.7 NLRP3-KO哮喘组F值P值10 3.2±0.4b 11.092<0.001 8.9±1.3b 9.829<0.001 3.4±0.6b 13.575<0.001
2.4 各组小鼠肺组织形态学表现及炎症评分的变化
NLRP3-WT对照组、NLRP3-KO对照组小鼠肺组织内气道平滑肌形态正常,未见明显炎性细胞浸润;NLRP3-WT哮喘组小鼠肺组织出现气道平滑肌增厚、炎性细胞浸润的形态学表现;NLRP3-KO哮喘组小鼠肺组织内气道平滑肌增厚、炎性细胞浸润的形态学表现较NLRP3-WT哮喘组明显改善。见图2。

图2 各组小鼠肺组织形态学表现(苏木精-伊红染色,×200) NLRP3-WT对照组(A)、NLRP3-KO对照组(C)小鼠肺组织内气道平滑肌形态正常,未见明显炎性细胞浸润;NLRP3-WT哮喘组(B)小鼠肺组织出现气道平滑肌增厚、炎性细胞浸润的形态学表现;NLRP3-KO哮喘组(D)小鼠肺组织内气道平滑肌增厚、炎性细胞浸润的形态学表现较NLRP3-WT哮喘组明显改善。
NLRP3-WT对照组、NLRP3-WT哮喘组、NLRP3-KO对照组、NLRP3-KO哮喘组小鼠的肺组织炎症评分分别为(0.61±0.09)分、(3.94±0.67)分、(0.55±0.08)分、(1.62±0.22)分,差异有统计学意义(F=19.383,P<0.001)。与NLRP3-WT对照组比较,NLRP3-WT哮喘组小鼠肺组织炎症评分明显升高(P<0.05),NLRP3-KO对照组小鼠肺组织炎症评分无明显变化(P>0.05);与NLRP3-WT哮喘组比较,NLRP3-KO哮喘组小鼠肺组织炎症评分明显降低(P<0.05)。
2.5 各组小鼠肺组织中cleaved caspase-1表达水平的变化
NLRP3-WT对照组、NLRP3-WT哮喘组、NLRP3-KO对照组、NLRP3-KO哮喘组小鼠的肺组织cleaved caspase-1表达水平分别为0.76±0.08、1.32±0.20、0.45±0.06、0.64±0.08,差异有统计学意义(F=12.575,P<0.001)。与NLRP3-WT对照组比较,NLRP3-WT哮喘组小鼠肺组织中cleaved caspase-1的表达水平明显升高,NLRP3-KO对照组小鼠肺组织中cleaved caspase-1的表达水平明显降低(P<0.05);与NLRP3-WT哮喘组比较,NLRP3-KO哮喘组小鼠肺组织中cleaved caspase-1的表达水平明显降低(P<0.05)。见图3。

图3 Western blot法检测各组小鼠肺组织中cleaved caspase-1表达水平电泳图
2.6 各组小鼠BALF中IL-1β、IL-18含量的变化
与NLRP3-WT对照组比较,NLRP3-WT哮喘组小鼠BALF中IL-1β、IL-18的含量明显升高(P<0.05),NLRP3-KO对照组小鼠BALF中IL-1β、IL-18的含量无明显变化(P>0.05);与NLRP3-WT哮喘组比较,NLRP3-KO哮喘组小鼠BALF中IL-1β、IL-18的含量明显降低(P<0.05)。见表2。
表2 各组小鼠BALF中IL-1β、IL-18含量的比较(±s,ng/mL)
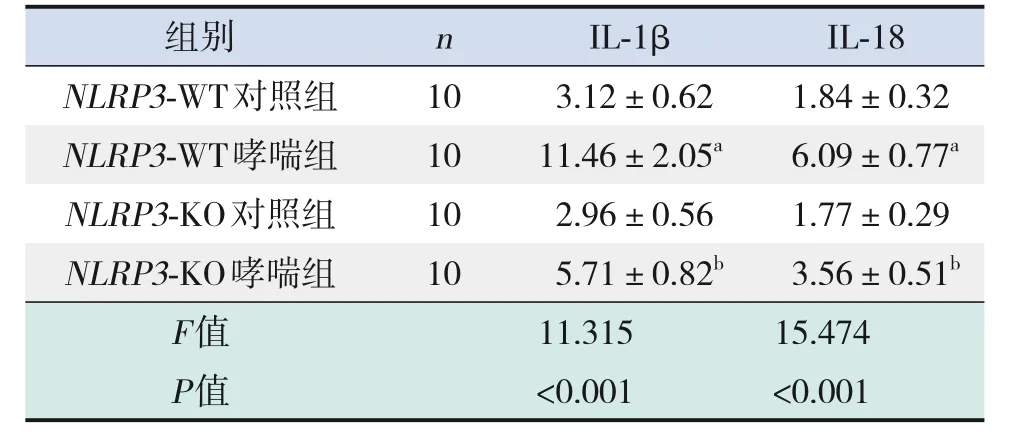
表2 各组小鼠BALF中IL-1β、IL-18含量的比较(±s,ng/mL)
注:[IL]白细胞介素。a示与NLRP3-WT对照组比较,P<0.05;b示与NLRP3-WT哮喘组比较,P<0.05。
NLRP3-KO哮喘组F值P值10 5.71±0.82b 11.315<0.001 3.56±0.51b 15.474<0.001 n IL-18 1.84±0.32 6.09±0.77a 1.77±0.29组别NLRP3-WT对照组NLRP3-WT哮喘组NLRP3-KO对照组10 10 10 IL-1β 3.12±0.62 11.46±2.05a 2.96±0.56
2.7 各组小鼠肺组织中GSDMD-N表达水平的变化
NLRP3-WT对照组、NLRP3-WT哮喘组、NLRP3-KO对照组、NLRP3-KO哮喘组小鼠的肺组织GSDMD-N表达水平分别为0.54±0.07、1.08±0.16、0.31±0.06、0.46±0.06,差异有统计学意义(F=9.387,P<0.001)。与NLRP3-WT对照组比较,NLRP3-WT哮喘组小鼠肺组织中GSDMD-N的表达水平明显升高,NLRP3-KO对照组小鼠肺组织中GSDMD-N的表达水平明显降低(P<0.05);与NLRP3-WT哮喘组比较,NLRP3-KO哮喘组小鼠肺组织中GSDMD-N的表达水平明显降低(P<0.05)。见图4。
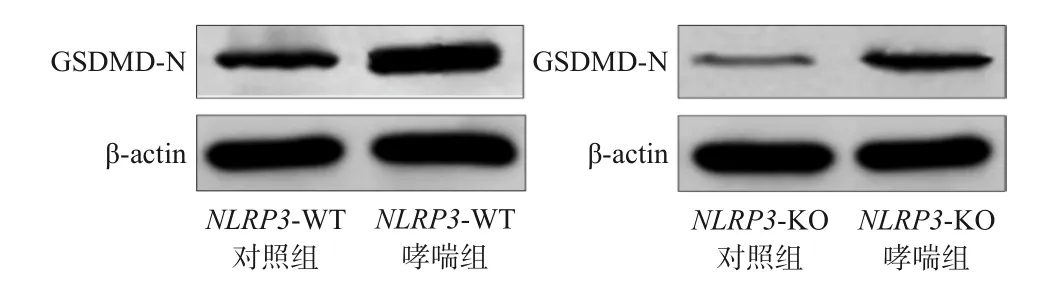
图4 Western blot法检测各组小鼠肺组织中GSDMDN表达水平电泳图
3 讨论
支气管哮喘的发病过程涉及多种炎性细胞及细胞组分,但具体的机制尚未完全阐明。在气流受限反复发作的过程中,气道炎症反应持续激活是特征性的病理改变,同时也会诱发细胞焦亡、引起气道上皮细胞损伤并加重气道高反应性。NLRP3炎症小体在炎症反应及细胞焦亡的调控中起关键作用,在病原相关分子、活性氧簇、组织蛋白酶等刺激下NLRP3表达增加,进而通过凋亡相关斑点样蛋白使下游caspase-1前体活化为cleaved caspase-1,后者能够介导炎症反应及细胞焦亡的激活。近些年,多项基础研究报道了地塞米松[9]、雌激素[10]、miR-223过表达[11]、苍术内酯Ⅲ[12]等不同哮喘治疗手段不仅显著改善哮喘动物模型肺功能,同时也对NLRP3的表达具有抑制作用,提示NLRP3的高表达可能在哮喘的发病中起重要作用。
Wood等[13]的临床研究证实哮喘患者外周血中NLRP3的表达水平明显增加;Xu等[7]及Zhang等[14]的动物实验证实哮喘小鼠肺组织中NLRP3炎症小体的表达均显著增加。本研究通过OVA联合氢氧化铝致敏、OVA激发的方式建立支气管哮喘小鼠模型,在WT哮喘小鼠肺组织中检测到NLRP3、cleaved caspase-1的表达增加,与既往其他学者报道支气管哮喘发病过程中NLRP3炎症小体表达增加的结果[7,13]一致。为了进一步探究NLRP3在哮喘发病过程中的作用,本研究对小鼠进行了NLRP3KO,NLRP3KO后进行支气管哮喘模型制备,NLRP3KO哮喘小鼠较WT哮喘小鼠的气道反应性指标Penh水平明显降低,肺组织中气道平滑肌增厚、炎性细胞浸润的形态学改变明显改善,表明NLPR3KO显著改善哮喘小鼠的气道高反应性及气道病理改变,由此也提供了NLPR3高表达参与哮喘发病的直接证据。
NLRP3表达增加后使下游有活性的cleaved caspase-1生成增加,后者能够使IL-1β和IL-18的前体裂解为有活性的成熟的IL-1β和IL-18并释放进入局部组织、血液循环,进而发挥促炎生物学效应,在局部招募多种炎性细胞浸润并介导炎症反应激活[15-16]。炎症反应激活是造成哮喘发病过程中气道高反应性、气流受限的关键因素,既往多项研究[8]及本研究均证实哮喘小鼠肺组织的炎症评分增加、BALF中多种炎性细胞数目增多。同时,本研究还检测到WT哮喘小鼠BALF中IL-1β和IL-18的含量增加,与NLRP3及cleaved caspase-1表达增加的结果吻合,进一步确认哮喘发病过程中NLRP3炎症小体过度激活。为了阐明NLRP3在哮喘发病过程中的炎症调控作用,本研究在NLRP3KO后观察到哮喘小鼠肺组织的炎症评分降低、BALF中多种炎性细胞数目减少且IL-1β和IL-18的含量降低,表明NLRP3在哮喘发病过程中直接参与气道炎症反应的调控,高表达的NLRP3能够增加IL-1β和IL-18的释放、招募多种炎性细胞浸润并介导炎症反应的激活。
近些年关于哮喘、慢性阻塞性肺疾病等的研究发现细胞焦亡是与上述呼吸道疾病发生密切相关的生物学环节,在焦亡过程中细胞膜迅速破裂,细胞内大量炎症介质释放进入细胞间液,进而介导炎症反应的级联放大。目前认为焦亡的经典途径由NLRP3介导,使细胞内GSDMD裂解为GSDMD-N并使细胞发生焦亡,这一过程主要发生在单核细胞、巨噬细胞、气道上皮细胞等,GSDMD-N是目前公认的焦亡标志物。有研究报道,激活焦亡使哮喘小鼠的气道功能减退、炎症反应加剧[17]。本研究在WT哮喘小鼠中检测到肺组织GSDMD-N的表达水平增加,表明哮喘发病过程中存在焦亡的过度激活,既与既往关于焦亡与哮喘的其他研究结果一致,也与本研究观察到哮喘发病过程中NLRP3表达增加的结果吻合。进一步在NLRP3KO后检测焦亡程度可知:在NLRP3KO哮喘小鼠肺组织内GSDMD-N的表达水平降低,表明NLRP3KO对GSDMD-N的表达及细胞焦亡具有抑制作用,进而证实哮喘发病过程中高表达的NLRP3不仅参与炎症反应的调控,还对细胞焦亡产生调控。
综上所述,本研究中WT小鼠的实验表明哮喘发病过程中存在NLRP3炎症小体的过度表达,NLRP3KO小鼠的实验表明NLRP3在哮喘发病过程中参与炎症反应及细胞焦亡的调控。这为今后深入认识NLRP3在哮喘发病中的作用及哮喘的发病机制提供了实验依据,也为发现哮喘新的治疗靶点提供了思路。

