不同价态阳离子对蒙脱石吸附镉的影响研究
万娟,陈文清,黄家森,牟海燕,薛哲,张舵
(1.四川大学 建筑与环境学院,四川 成都 610041;2.四川省天晟源环保股份有限公司,四川 成都 610213)
土壤重金属污染问题日益严重,成都平原地区表层土壤中镉含量均值在0.2 mg/g以上,远大于全国背景值0.097 mg/g[1-3]。镉能在动植物体内富积,并诱发疾病,被世界卫生组织列入IPCS计划进行研究[4]。蒙脱石是2∶1型膨胀性层状硅酸盐粘土矿物[5],层间阳离子容易与土壤中阳离子发生物理和化学反应[6-8],从而影响重金属的富集和迁移[9-12]。目前主要研究有机阴离子和金属离子共存的吸附行为[13-15],不同金属阳离子存在下,蒙脱石对镉的吸附研究较少。本文通过饱和吸附K+、Ca2+、Al3+后的蒙脱石对镉的吸附、解吸实验,探究不同含盐类型的钠基蒙脱石土壤中镉的去除情况,并结合XRD、FTIR分析,探讨蒙脱石对K+、Ca2+、Al3+、Cd2+的吸附行为及机理。
1 实验部分
1.1 试剂与仪器
蒙脱石(M),纯度为60%~70%;NaNO3、KNO3、Ca(NO3)2、Al2(NO3)3、Cd(NO3)2、HNO3、NaOH均为分析纯;镉标准液,国标。
ICPE-9000型电感耦合等离子发射光谱仪;IRAffinity-1S型傅里叶变换红外光谱仪;EMPYREAN型X射线衍射仪。
1.2 蒙脱石提纯
称取一定量的蒙脱石置于烧杯中,与去离子水以1∶10的配比制成悬浮液,搅拌,使得蒙脱石颗粒在水中充分分散。根据斯托克斯沉降法[16],计算出d<100 nm粒径的胶体沉降10 cm所需要的时间,根据此时间,反复提取样品中所有该粒径范围的胶体,直至悬液澄清[17]。将收集的悬浮液用离心机分离,并于60 ℃烘干,碾磨,过100目筛,得到提纯蒙脱石(M)[18]。
1.3 蒙脱石分别吸附K+、Ca2+、Al3+、Cd2+
1.3.1 吸附动力学实验 称取1.0 g蒙脱石,置于1 L的锥形瓶中,分别加入不同浓度的KNO3、Ca(NO3)2、Al2(NO3)3、Cd(NO3)2溶液500 mL,使用HNO3或NaOH调节溶液pH至6.5±0.1,在0,5,10,20,30,60,120,240,480,720,1 440,2 880 min 时分别取样,过0.45 μm滤膜,用ICP测定K+、Ca2+、Al3+、Cd2+浓度,计算胶体吸附量。
式中Qe——吸附平衡时固相上金属离子的吸附量,mg/g;
C0——溶液初始浓度,mg/L;
Ce——溶液平衡浓度,mg/L;
V——溶液的体积,L;
m——吸附剂质量,g。
实验数据全部采用Excel 2012进行统计,采用Origin 9.0进行作图。
1.3.2 等温吸附实验 称取0.1 g蒙脱石,置于100 mL的锥形瓶中,分别加入50 mL不同浓度的KNO3、Ca(NO3)2、Al2(NO3)3、Cd(NO3)2溶液,使用HNO3或NaOH调节溶液初始pH至6.5±0.1,恒温振荡24 h,振荡频率为200次/min,温度为(25±1) ℃。过0.45 μm滤膜,用ICP测定K+、Ca2+、Al3+、Cd2+浓度,计算胶体吸附量。
1.4 蒙脱石饱和吸附K+、Ca2+、Al3+后再吸Cd2+1.4.1 饱和吸附K+、Ca2+、Al3+实验 配制2 L浓度600 mg/L KNO3、400 mg/L Ca(NO3)2、600 mg/L Al2(NO3)3溶液,使用HNO3或NaOH调节溶液pH至6.5±0.1,加入1.0 g蒙脱石,恒温间歇搅拌24 h 后,悬浮液用离心机进行分离。重复上述步骤2次以上,使蒙脱石充分吸附阳离子,并消解测定其含量,直至吸附饱和。将得到的蒙脱石样品置于50 ℃ 温度下烘干,得到K-蒙脱石(M-K)、Ca-蒙脱石(M-Ca)、Al-蒙脱石(M-Al)。
1.4.2 吸附动力学实验 称取1.0 g M、M-K、M-Ca、M-Al,分别置于1 L的锥形瓶中,加入500 mL浓度1 000 mg/L Cd(NO3)2溶液,0.01 mol/L NaNO3溶液为电解溶液,实验条件如1.3.1节。
1.4.3 等温吸附/解吸实验 称取0.1 g四种蒙脱石,分别置于100 mL的锥形瓶中,加入50 mL以0.01 mol/L NaNO3溶液为支持电解质的不同浓度的Cd(NO3)2溶液,实验条件如1.3.2节。
1.5 表征方法
1.5.1 XRD Cu阳极靶,电压40 kV,电流100 mA, 扫描步长为0.026°,扫描范围10~80°。所得图谱用jade 6.5进行定性分析。
2 结果与讨论
2.1 蒙脱石分别吸附K+、Ca2+、Al3+、Cd2+
2.1.1 吸附动力学 吸附动力学见图1。
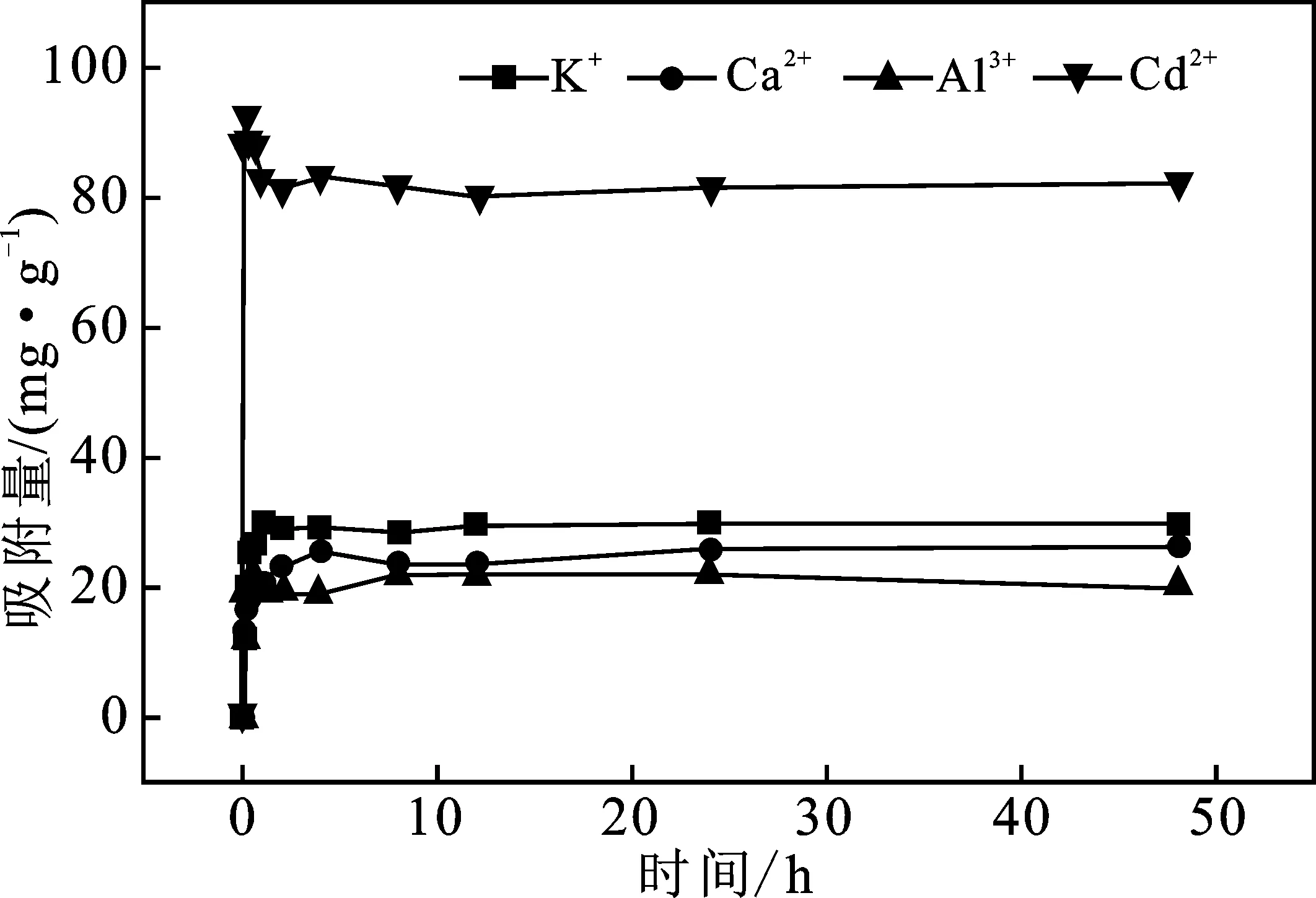
图1 蒙脱石吸附K+、Ca2+、Al3+、 Cd2+的吸附动力学曲线Fig.1 Adsorption kinetics curves of montmorillonite for K+,Ca2+,Al3+ and Cd2+
由图1可知,在吸附的前30 min,蒙脱石对4种阳离子的吸附速度非常快,随着时间的增加,吸附速率逐渐减慢,2 h后达到吸附平衡,跟刘慧等的研究结果一致[19]。因此,等温吸附取24 h为反应时间。
蒙脱石对4种阳离子的吸附过程分为两步:第1步快速反应,是阳离子从溶液中扩散到蒙脱石的外表面;第2步反应是阳离子向蒙脱石内层扩散,这一过程包括层间的离子交换及同晶替代。根据阳离子亲和力的大小,分为高亲和力吸附位点和低亲和力吸附位点,高亲和力吸附位点吸附过程迅速,低亲和力吸附位点吸附过程缓慢[20],推测蒙脱石胶体中对4种阳离子的高位能吸附位点数量为Cd2+>Al3+>K+≈Ca2+。
对蒙脱石吸附4种阳离子的吸附动力学进行准一级和准二级动力学模型拟合,结果见表1。
由表1可知,准二级动力学模型对蒙脱石吸附4种阳离子拟合结果较好,R2均在0.97以上,表明蒙脱石对阳离子的吸附机理为化学吸附。

表1 蒙脱石吸附K+、Ca2+、Al3+及Cd2+的动力学模型Table 1 Kinetic models of adsorption K+,Ca2+, Al3+ and Cd2+ by montmorillonite
2.1.2 等温吸附 4种阳离子在蒙脱石上的等温吸附曲线见图2。
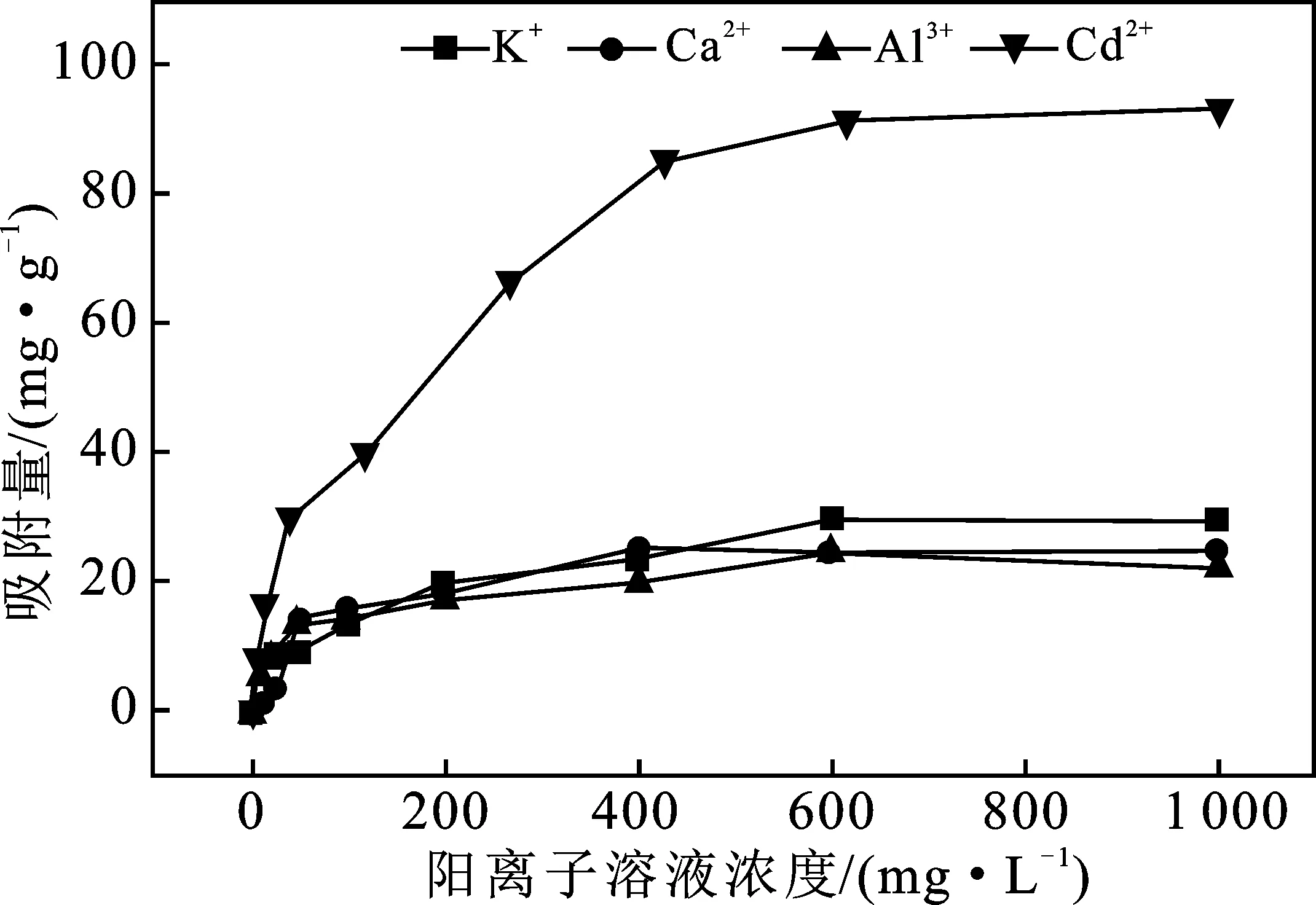
图2 蒙脱石吸附K+、Ca2+、 Al3+、Cd2+的等温吸附曲线Fig.2 Isothermal adsorption curves of montmorillonite for K+,Ca2+,Al3+ and Cd2+
由图2可知,随着4种阳离子浓度的增加,吸附速率逐渐减慢。蒙脱石分别在浓度为600 mg/L KNO3溶液、400 mg/L Ca(NO3)2溶液、600 mg/L Al2(NO3)3溶液以及800 mg/L Cd(NO3)2溶液中对K+、Ca2+、Al3+和Cd2+的饱和吸附量为Cd2+(0.845 mmol/g)>Al3+(0.834 mmol/g)>K+(0.757 mmol/g)>Ca2+(0.633 mmol/g)。
4种阳离子在蒙脱石上吸附用Langmuir方程(R2>0.90)和Temkin方程(R2>0.93)拟合程度较高,表明蒙脱石胶体对K+、Ca2+、Al3+、Cd2+4种阳离子吸附容易发生,属于单分子层吸附,并且受温度影响较大。
Langmuir方程中b值的大小代表吸附剂对吸附质的吸附稳定能力[21],b值越大,代表吸附越稳定。由表2可知,b值大小为K+>Al3+>Ca2+>Cd2+,说明蒙脱石对K+吸附最稳定,Al3+次之,Cd2+最弱,Al3+可以取代蒙脱石四面体中的Si4+,因此它们的吸附比较牢固,不容易解吸出来,而Ca2+、Cd2+大多被吸附在表面或通过离子交换进入蒙脱石胶体层间,吸附相对不稳定。
帕金森疾病可以通过药物进行控制,在治疗过程还需要患者配合。我院通过对比发现,护理前两组焦虑、抑郁评分、日常生活能力比较,差异无统计学意义(P>0.05)。护理后两组焦虑、抑郁评分、日常生活能力均有改善,且研究组优于参考组,差异有统计学意义(P<0.05)。所以心理护理干预能够改善帕金森患者的焦虑、抑郁,提高患者的日常生活能力,可以在临床护理上推广应用。
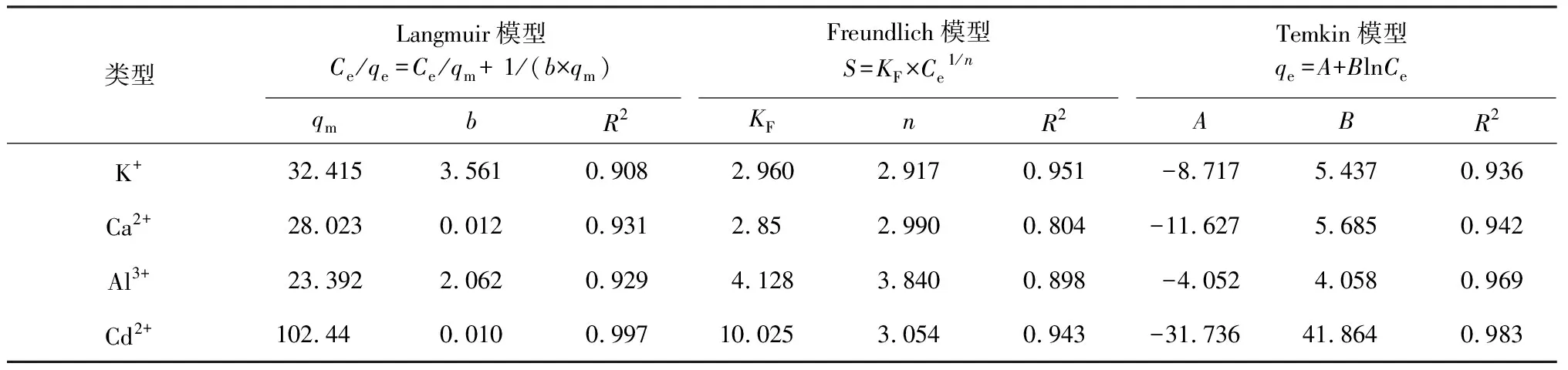
表2 蒙脱石吸附K+、Ca2+、Al3+及Cd2+的等温吸附模型Table 2 Montmorillonite adsorption K+,Ca2+,Al3+ and Cd2+ isothermal adsorption models
2.2 蒙脱石饱和吸附K+、Ca2+、Al3+后再吸附Cd2+
2.2.1 吸附动力学 吸附动力学见图3。

图3 K-蒙脱石、Ca-蒙脱石、Al-蒙脱石 吸附Cd2+的吸附动力学曲线Fig.3 Adsorption kinetics curves of K-montmorillonite, Ca-montmorillonite and Al-montmorillonite on Cd2+
由图3可知,在吸附的前30 min,Cd2+在M-K和M-Ca中的吸附速度非常快,上升至一定的峰值后回落,并趋于平稳;Cd2+在M-Al上的吸附速率快,上升至一定的峰值后趋于平稳。反应2 h后,均逐渐达到吸附平衡,其反应平衡时间与蒙脱石分别吸附K+、Ca2+、Al3+、Cd2+的平衡时间相差不大。表3列出3种蒙脱石对Cd2+吸附的准一级和准二级动力学模型。
由表3可知,两种模型对蒙脱石吸附Cd2+的拟合结果均较好,相关度R2均在0.92以上,其中准一级最好,准二级次之,表明3种类型蒙脱石对Cd2+的吸附主要是化学吸附和表面吸附的共同作用结果,Cd2+在3种固体表面外扩散速率可能是影响吸附速率的主要因素。
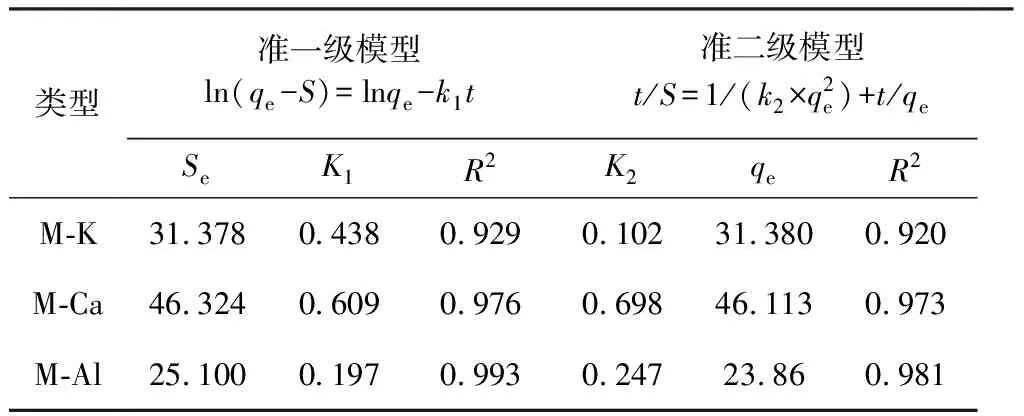
表3 K-蒙脱石、Ca-蒙脱石、 Al-蒙脱石吸附Cd2+的动力学模型Table 3 Kinetic model of adsorption of Cd2+ by K-montmorillonite,Ca-montmorillonite and Al-montmorillonite
2.2.2 等温吸附 Cd2+在蒙脱石上的等温吸附曲线见图4。
由图4可知,随着Cd2+浓度增加,吸附速率逐渐减慢。3种蒙脱石对Cd2+的吸附量为M-Ca(0.489 mmol/g)>M-K(0.436 mmol/g)>M-Al(0.305 mmol/g)。分别用Langmuir方程和Freundlich方程对3种蒙脱石吸附Cd2+进行拟合,结果表4。
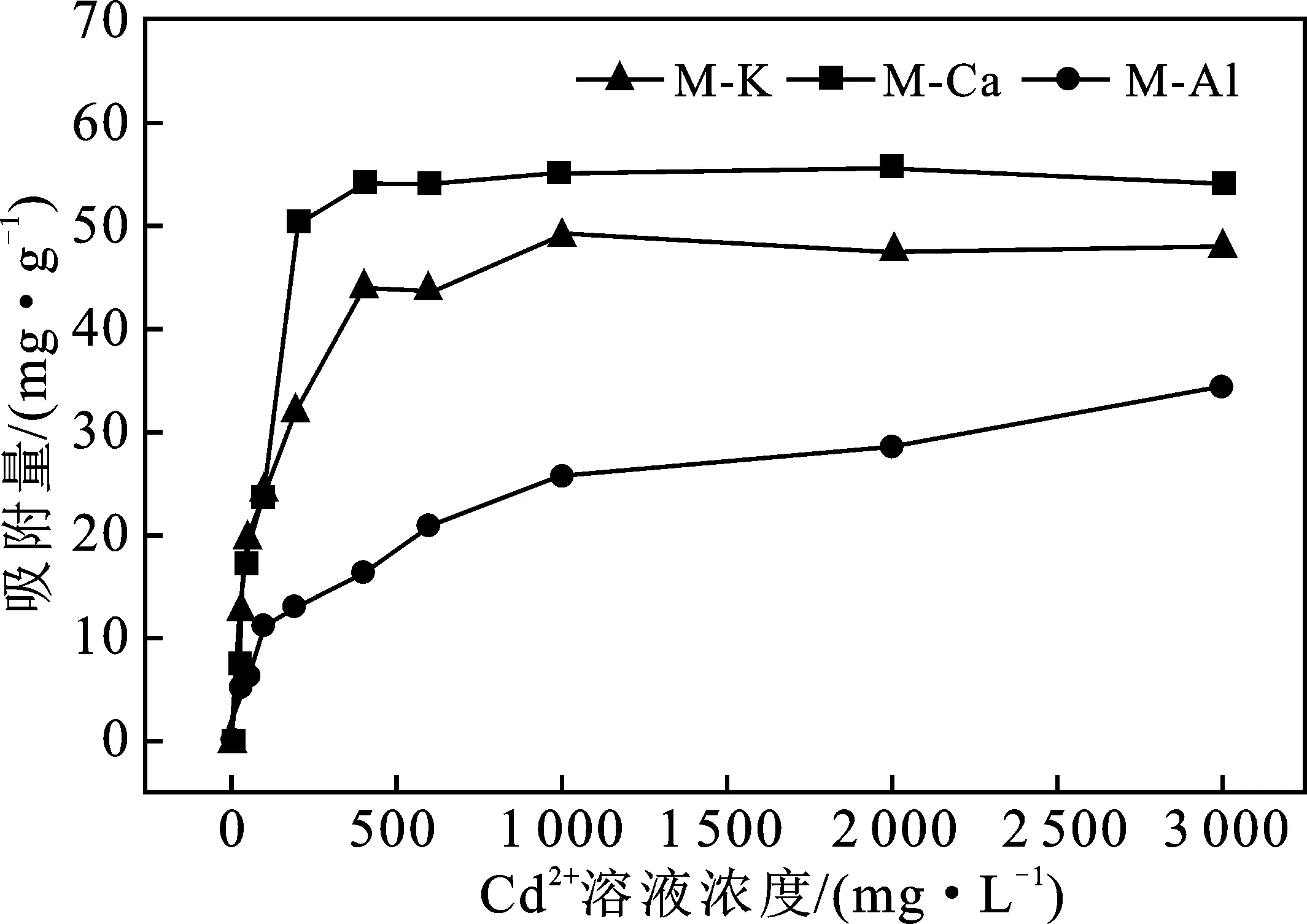
图4 K-蒙脱石、Ca-蒙脱石、Al-蒙脱石吸 附Cd2+的等温吸附曲线Fig.4 Isothermal adsorption curves of Cd2+ by K-montmorillonite,Ca-montmorillonite and Al-montmorillonite
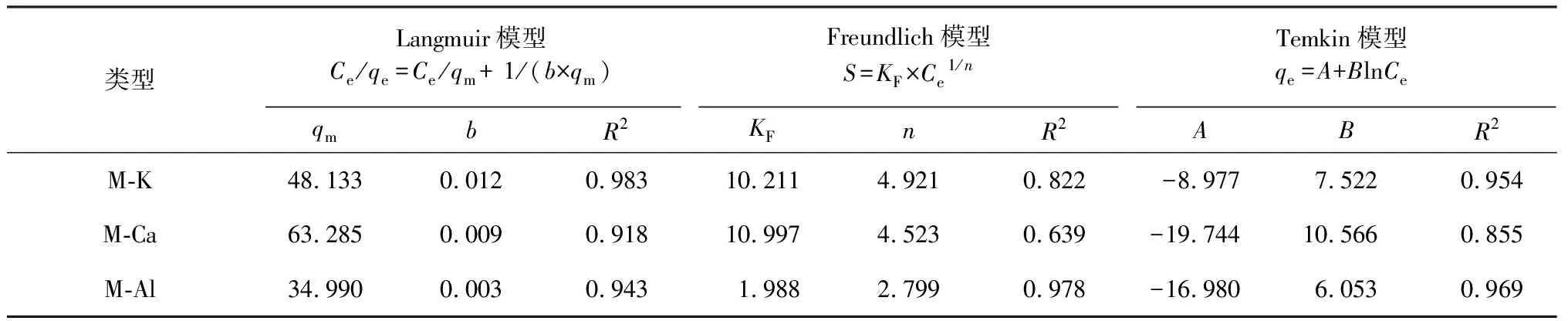
表4 K-蒙脱石、Ca-蒙脱石、Al-蒙脱石吸附Cd2+的等温吸附模型Table 4 Isothermal adsorption model of Cd2+ adsorption by K-montmorillonite, Ca-montmorillonite and Al-montmorillonite
由表4可知,Langmuir方程对M-K、M-Ca吸附Cd2+的拟合程度较高,Freundlich方程对M-Al吸附Cd2+的拟合程度较高。3种蒙脱石对Cd2+吸附容易发生,且单分子层吸附为主,稳定吸附Cd2+的大小为M-K>M-Ca>M-Al。
M对Cd2+的吸附量远大M-K、M-Ca和M-Al。K+、Ca2+、Al3+3种阳离子均会占据蒙脱石中Cd2+的吸附位点,与之形成竞争,导致蒙脱石对Cd2+吸附量下降。蒙脱石中对4种阳离子的高位能吸附位点数量为Cd2+>Al3+>K+≈Ca2+,高能位点吸附的离子不容易跟Cd2+发生离子交换,导致吸附量顺序为M-Ca>M-K>M-Al。Al3+在蒙脱石上的高能吸附位点多且吸附稳定,Cd2+无法过多地置换出价态更高的Al3+,因此M-Al对Cd2+的吸附量最小。蒙脱石吸附Ca2+后,其层间距增大,结构相对疏松,内部空隙较多,层间空隙较大,形成了孔道效应,加之蒙脱石对Ca2+的吸附是以表面吸附和离子交换为主,吸附不稳定,容易解吸或被置换出来,因此M-Ca对Cd2+的吸附量最大。
2.3 不同类型蒙脱石吸附Cd2+后阳离子的解吸情况
蒙脱石吸附不同阳离子的特性有所差异,导致吸附在蒙脱石上的K+、Ca2+、Al3+与Cd2+的离子交换情况不同,吸附的阳离子也会发生不同程度的解吸。由于离子价态及水合离子半径不同,离子吸附及交换的亲和力会有所不同,土壤胶体对阳离子吸附及交换的亲和力大小顺序为:三价离子>二价离子>一价离子,通常有Al3+>Ca2+>Cd2+>K+>Na+[22]。亲和力的不同导致分别饱和吸附K+、Ca2+、Al3+蒙脱石胶体吸附Cd2+后,K+、Ca2+、Al3+呈现出不同的解吸量及解吸规律。实验结果见图5。
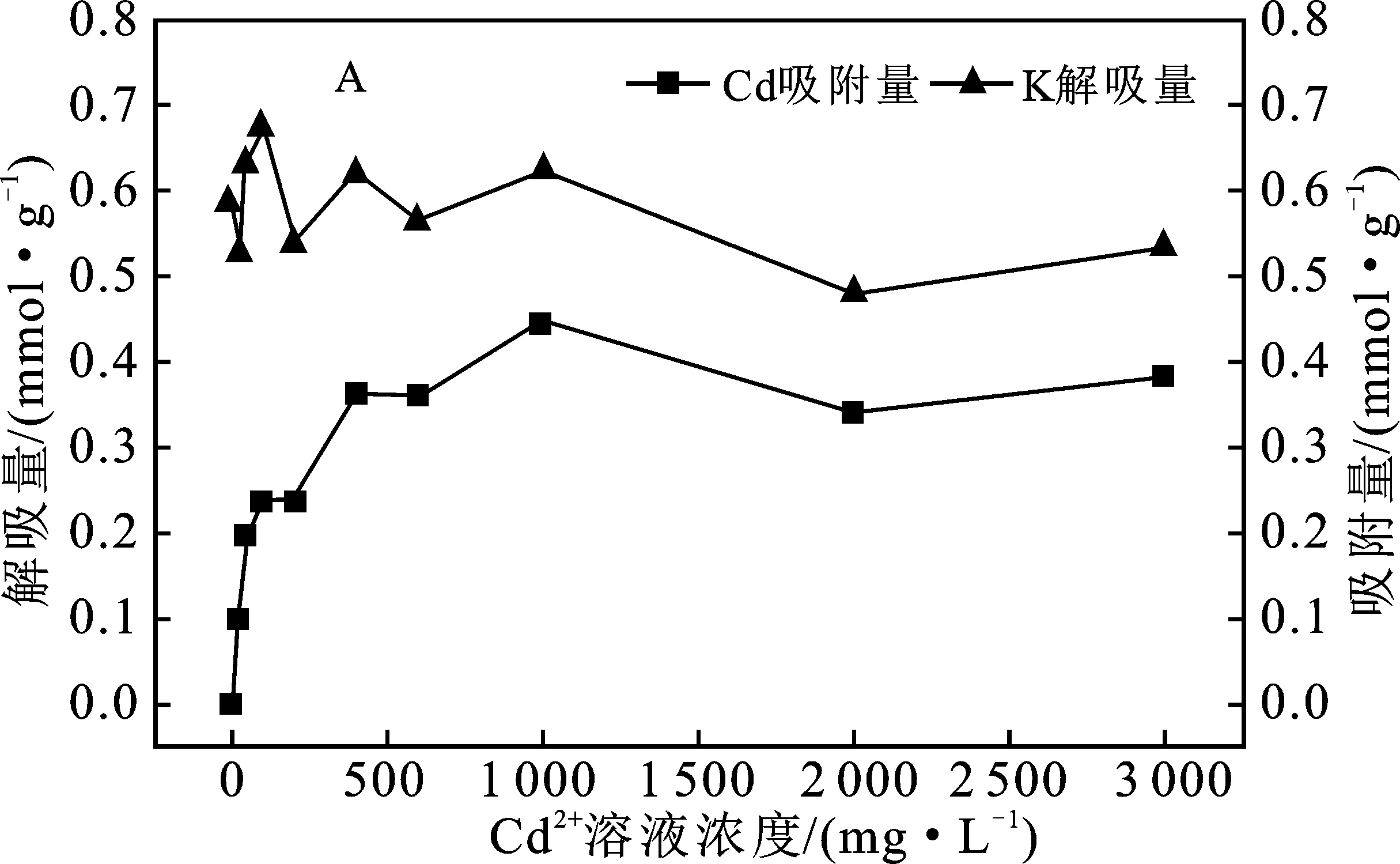
A.M-K对Cd2+吸附量和K+解吸量
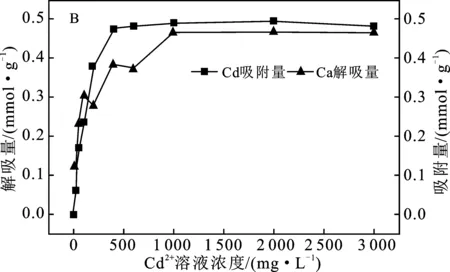
B.M-Ca对Cd2+吸附量和Ca2+解吸量
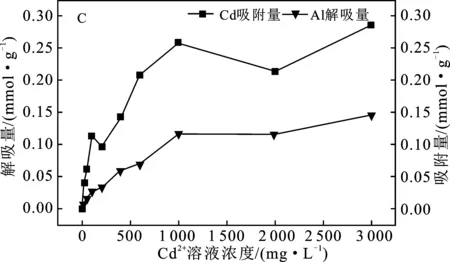
C.M-Al对Cd2+吸附量和Al3+解吸量图5 M-K、M-Ca、M-Al对Cd2+吸附量和 K+、Ca2+、Al3+解吸量Fig.5 Cd2+ adsorption by M-K,M-Ca,M-Al and desorptionrate of cations K+,Ca2+Al3+and Al3+ by M-Al
由图5(A)可知,随着Cd2+吸附量的增大,K+解吸量基本不变,约0.55 mmol/g,小于饱和吸附量(0.757 mmol/g),解吸率约72.66%。随着Cd2+浓度的增大,K+解吸量与Cd2+的吸附量保持一定的差值。蒙脱石对Cd2+的吸附亲和力和离子交换能力高于K+,物理吸附的K+不稳定,易被Cd2+置换,从而解吸。又因蒙脱石对K+的吸附具有较强专一性,部分K+嵌入蒙脱石晶层中的空穴中,并稳定吸附在蒙脱石中,导致Cd2+无法将其全部置换出来。
由图5(B)可知,Cd2+吸附曲线与Ca2+解吸曲线趋势相同,随着Cd2+的吸附量增大,Ca2+的解吸量逐渐增大。Ca2+的解吸量约为0.465 mmol/g,小于饱和吸附量(0.633 mmol/g),解吸率约为72.04%,跟K+解吸率均为72%左右,与蒙脱石胶体中4种阳离子的高位能吸附位点数量为Cd2+>Al3+>K+≈Ca2+的结果相符合。蒙脱石对Ca2+的吸附以表面吸附和离子交换为主,吸附不稳定,容易解吸或被置换出来。同一价态的阳离子,水合半径越小,距离胶体就越近,同时单位体积所带电荷量也越多,越容易被胶体吸附,也越难以被其它阳离子置换,Ca2+、Cd2+水合离子半径有Ca2+(0.244 9 nm)>Cd2+(0.230 5 nm)[23],因此Cd2+容易将Ca2+置换出来,并被蒙脱石胶体吸附。
由图5(C)可知,随着溶液中Cd2+浓度的增大,蒙脱石对Cd2+的吸附量和Al3+解吸量趋势一致,Cd2+浓度在1 000~3 000 mg/L内,Al3+解吸量波动较小,约为0.116 mmol/g,远小于饱和吸附量(0.834 mmol/g),解吸率约为13.91%。土壤胶体对阳离子吸附及交换的亲和力大小顺序为:三价离子>二价离子>一价离子,Cd2+难置换出Al3+,导致蒙脱石吸附Cd2+的吸附量较少。同时随着溶液中Cd2+浓度的增大,溶液离子强度增大,导致蒙脱石胶体双电层厚度减小,从而降低了蒙脱石对Cd2+的吸附量[24],故溶液中Al3+解吸量很低,且随着Cd2+浓度的增大,解吸量缓慢提高。
2.4 吸附机理研究
2.4.1 不同类型蒙脱石X射线衍射分析 M-K、M-Ca及M-Al吸附Cd2+前后的XRD见图6。
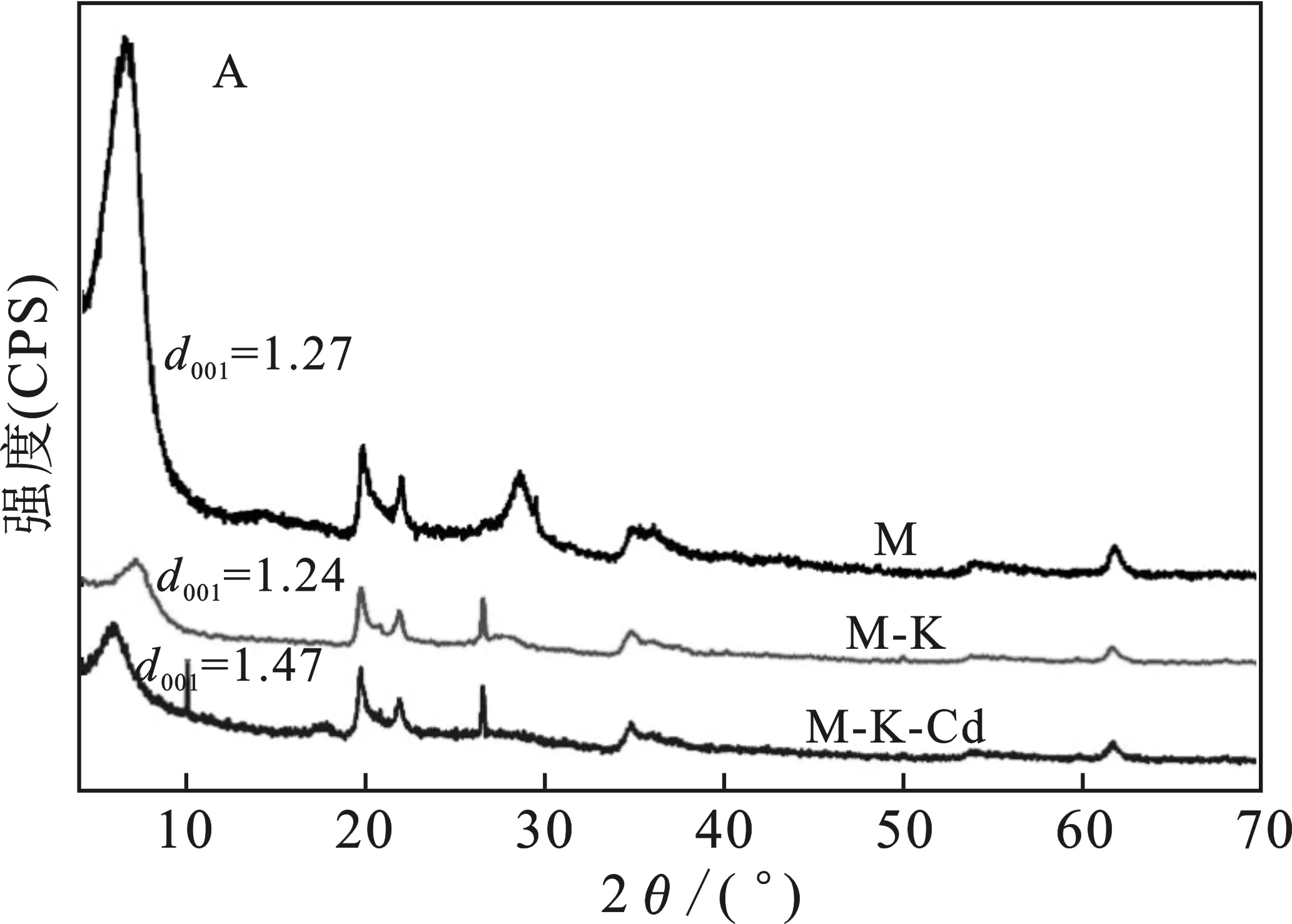

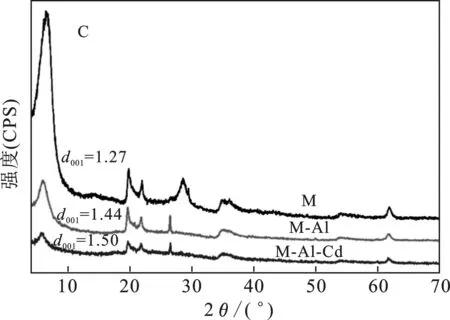
图6 Cd2+在M-K(A)、M-Ca(B)及M-Al(C) 上吸附前后的X射线衍射图Fig.6 XRD of Cd2+ before and after adsorption on M-K,M-Ca and M-Al
由图6可知,6.5,19.9,22.0,28.6,35.5,61.9 °与蒙脱石标准卡片(00-013-0135)基本一致,蒙脱石的特征峰位置未发生任何变化,表明蒙脱石吸附4种金属离子后均未改变晶体结构。4种阳离子均进入不同类型蒙脱石的层间,发生离子交换反应,导致层间距发生变化。
由图6(A)可知,M吸附K+后,M-K的晶体间距比M减小了0.03 nm,M-K-Cd比M-K的晶面间距增大了0.23 nm。加入K+后,尽管K+的离子半径明显大于Ca2+、Al3+阳离子半径,由于K+能够嵌入蒙脱石上下晶层中的空穴中[25],不易被其他离子所交换,同时也阻止水分子进入,也证实了部分K+未解吸。M-K-Cd晶面间距增大,表明Cd2+进入M-K层间,根据FT-IR结果显示,Cd2+与—OH发生络合反应,使胶体层间距增大。
由图6(B)可知,M-Ca比M晶体层间距增大了0.27 nm,M-Ca-Cd比M-Ca晶体间距减小0.01 nm。蒙脱石吸附Ca2+后,部分Ca2+插入蒙脱石层间,与Na+发生离子交换,Ca2+价态高且半径大,导致M-Ca比M晶体层间距大。吸附的Cd2+置换出M-Ca中部分Ca2+,且水合离子半径有Ca2+>Cd2+,导致吸附Cd+后,M-Ca-Cd晶体间距减小。
由图6(C)可知,M吸附Al3+后,M-Al晶体层间距比M增大了0.17 nm,M-Al-Cd比M-Al晶体层间距增大了0.06 nm。蒙脱石吸附Al3+后,部分Al3+插入蒙脱石的层间,与Na+、Mg2+等发生交换,将其置换出,由于Al3+的电价高,半径大,与结构单元层之间的作用力较强,导致M-Al晶体层间距比M晶体层间距大,M-Al-Cd中Cd2+插入蒙脱石层间内,使其层间距增大。
2.4.2 不同类型蒙脱石红外光谱分析 由图7可知,吸附4种阳离子后,蒙脱石骨架没有发生变化,4种阳离子均进入蒙脱石晶体间层。蒙脱石3 620 cm-1处为O—H伸缩振动,3 320 cm-1处为H2O伸缩振动和1 643 cm-1处为H2O弯曲振动,这是由层间水和吸附水引起的,1 090 cm-1表示Si—O—Si吸附振动[26-29],1 545 cm-1处为钠基峰。
由图7(A)可知,吸附K+后,M-K在3 320 cm-1有所差异。结合XRD,推测K+嵌入到晶层空穴中,不易被其他离子所交换,引起蒙脱石层间闭合,同时也阻止了水分子的进入导致,导致层间距减少。M-K-Cd在3 620,1 643 cm-1处增强,3 320 cm-1处吸收峰减弱,表明吸附Cd2+后,Cd2+与—OH发生了络合作用,其中一定量Cd2+进入蒙脱石层间,对水分子进行挤压与替换,增大晶体间距,可能发生了水合离子反应。
由图7(B)可知,M-Ca在1 545 cm-1附近的钠基峰强明显减弱,Ca2+进入蒙脱石间层,与Na+发生了置换,由于Ca2+的离子半径大于Na+,导致晶体层间距减小。M-Ca吸附Cd2+后,M-Ca-Cd位于3 435,1 643 cm-1处水分子伸缩振动和弯曲振动明显减弱,导致M-Ca-Cd层间略小于M-Ca。
由图7(C)可知,M-Al在1 090 cm-1处的Si—O—Si振动峰有所差异,表明蒙脱石胶体四面体的中心离子Si4+被Al3+同晶置换。M-Al吸附Cd2+后,M-Al-Cd在3 430,1 643 cm-1处水分子伸缩振动和弯曲振动减弱,表明Cd2+与—OH发生了络合作用。

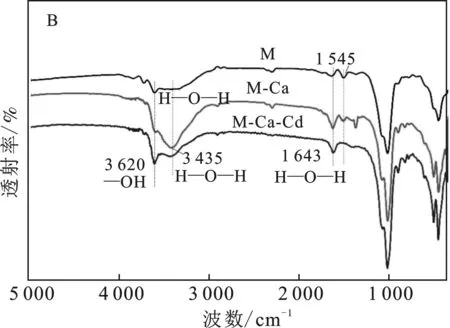
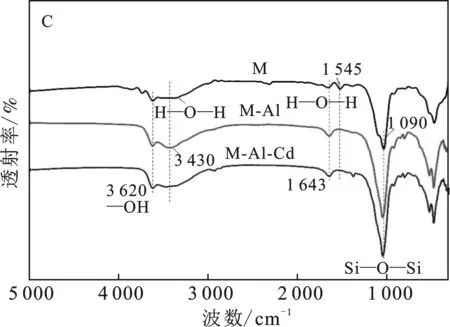
图7 M-K(A)、M-Ca(B)、M-Al(C) 吸附Cd2+前后的红外光谱图Fig.7 FTIR of Cd2+ adsorbed by M-K(A), M-Ca(B) and M-Al(C)
3 结论
(1)蒙脱石分别在浓度为600 mg/L KNO3溶液、400 mg/L Ca(NO3)2及600 mg/L Al2(NO3)3溶液中对K+、Ca2+、Al3+的饱和吸附量为Al3+(0.834 mmol/g)>K+(0.757 mmol/g)>Ca2+(0.633 mmol/g)。
(2)3种蒙脱石对Cd2+的吸附量为M-Ca(0.489 mmol/g)>M-K(0.436 mmol/g)>M-Al(0.305 mmol/g),表明含有钙盐的钠基蒙脱石土壤比含钾盐和铝盐的钠基蒙脱石土壤对镉的吸附量更高。M-K、M-Ca、M-Al对Cd2+的吸附量远小于M对Cd2+的吸附量,K+、Ca2+、Al3+占据了M中Cd2+的吸附位点,与其发生竞争吸附。
(3)M-Ca对Ca2+的解吸率与M-K中的K+解吸率均为72%左右,M-Al对Al3+的解吸率为13.91%。蒙脱石成功吸附K+、Ca2+、Al3+,并进入晶体层间,发生离子交换反应和络合反应,导致层间距发生变化;K-蒙脱石、Ca-蒙脱石、Al-蒙脱石吸附Cd2+后,层间距均增大。

