适应性驯化生产低分子质量β-葡聚糖及其抗氧化活性研究
王冰,朱莉,李茂玮,詹晓北*
1(糖化学与生物技术教育部重点实验室,江南大学 生物工程学院,江苏 无锡,214122) 2(无锡格莱克斯生物科技有限公司,江苏 无锡,214125)
β-葡聚糖是葡萄糖以β-糖苷键连接而成的同型多糖,具有降低胆固醇、调节血糖血脂、调节肠胃健康等功效[1-2]。β-葡聚糖的水解产物β-葡寡糖,是一种不可消化的低聚糖,可在不同程度上被肠道微生物菌群发酵[3],具有促进乳酸菌生长和免疫调节等的作用[4-5]。近年来,β-葡聚糖成为研究热点,但发酵条件、来源等因素影响着β-葡聚糖的溶解性、相对分子质量及功能特性。
热凝胶是一种由土壤杆菌在氮源匮乏条件下合成的仅由β-D-1,3-糖苷键连接而成的线性葡聚糖,在韩国、中国台湾地区和日本已被注册为膳食纤维[6]。但是热凝胶的水不溶性限制了其生物活性的发挥,一些研究表明,热凝胶经过降解得到的β-1,3-葡聚糖,是一种可被水溶解且有较好生理功能的低聚糖[7],在医学保健、生物、日化等领域具有很高的应用价值[8-10]。YANG等[11]研究表明,β-葡聚糖通过不同传达方式被吞噬细胞输送或释放,从而产生各种生理活性。但目前利用不同降解方法得到的低分子质量葡聚糖依然存在着转化率低、耗能大、污染大、分子质量分布不均等问题[12-14]。如果可以用微生物直接发酵得到低分子质量β-1,3-葡聚糖,将会进一步扩大葡聚糖的应用领域。
甘油是被广泛认可并使用的工业原料[15]。土壤杆菌ATCC 31749 可以将甘油等醇类化合物作为碳源,本研究利用甘油做为碳源对土壤杆菌进行驯化挑选,引导菌株生产低分子质量β-葡聚糖,在废物利用的同时提高土壤杆菌合成低分子质量β-葡聚糖的活力,并对其产物结构、抗氧化活性进行了研究。
1 材料与方法
1.1 实验材料
1.1.1 实验菌种
Agrobacteriumsp.ATCC 31749、Agrobacteriumsp.WS-8E3T(由甘油梯度适应性驯化筛选获得),均保藏于糖化学与生物技术教育部重点实验室。
1.1.2 培养基
平板培养基 (g/L):甘油100.0,酵母粉10.0,蛋白胨2.0,鱼粉蛋白胨2.0,琼脂粉 20.0,pH 7.0,121 ℃ 灭菌锅灭菌20 min。
基础鉴别培养基:酵母粉10.0 g/L,刚果红溶液(10 mg/mL 刚果红水溶液)0.5%(体积分数),琼脂粉 20.0 g/L,pH 7.0,115 ℃ 灭菌20 min。
种子培养基 (g/L):甘油 40.0,酵母粉 6.0,MgSO40.5,KH2PO41.5,pH 7.0,115 ℃灭菌30 min。
摇瓶发酵培养基 (g/L):甘油 100.0,酵母粉 6.0,KH2PO43.0,MgSO41.5,(NH4)2S043.0,pH 7.0,121 ℃ 灭菌20 min。
基础驯化培养基为种子培养基。驯化过程中培养基中甘油质量浓度以10 g/L为梯度增加至100 g/L,其他成分不变。
1.1.3 主要仪器
LC-2010A高效液相色谱仪,Waters;ICS5000离子色谱仪,美国Dionex公司;Thermo Nicolet NEXUS型傅里叶红外光谱仪,美国尼高力公司;Avance Ⅲ型NMR光谱仪,德国Bruker公司。
1.1.4 主要试剂
木糖、鼠李糖、葡萄糖醛酸及半乳糖、刚果红、高碘酸钾、甘露糖、抗坏血酸,分析纯,Sigma-Aldrich;Dextran 右旋糖苷标准品,色谱纯,美国聚合物标准品公司;蛋白浓度测量试剂盒,碧云天生物技术有限公司;其他试剂均为分析纯,国药集团(上海)。
1.2 土壤杆菌适应性驯化选育过程
将Agrobacteriumsp.ATCC 31749在种子培养基中培养16 h后,按10%体积分数的接种量接入含50 g/L甘油的驯化培养基中,于30 ℃、200 r/min 培养 16 h,然后按同样方法连续传代10次,取 0.1 mL 发酵液稀释涂布到含有 50 g/L 甘油的鉴别培养基上,于30 ℃培养36 h,挑取菌落形态圆润凸起、表观透明、颜色深红的单菌落接种到含60 g/L 驯化培养基的24 孔板中进行下一轮驯化。在接下来驯化和筛选过程中,甘油质量浓度逐渐增加至100 g/L。将高通量筛选获得的菌株按方法 1.1.2 培养成种子液,按体积分数10%的接种量接种到发酵摇瓶中,于30 ℃、200 r/min 培养120 h。测定各菌株β-葡聚糖产量及分子质量,筛选产低分子质量β-葡聚糖的菌株。
1.3 遗传稳定性实验
将获得的Agrobacteriumsp.WS-8E3T连续传代,在摇瓶中于30 ℃、200 r/min下培养120 h,测量每一代 β-葡聚糖分子质量、产量、微生物数量,验证Agrobacteriumsp.WS-8E3T的遗传特性是否稳定。
1.4 不同分子质量多糖的制备
对发酵液进行乙醇分级沉淀操作(图1)提取多糖,通过冷冻真空干燥得到分级醇沉粗多糖。

图1 乙醇分级沉淀步骤Fig.1 The steps of ethanol fractionation preciptipation
1.5 分析测定方法
1.5.1 总糖含量测定
采用苯酚-硫酸法[16]。
1.5.2 蛋白含量测定
利用紫外光谱扫描法,于200~500 nm进行紫外扫描测定纯化多糖中蛋白质含量。
1.5.3 分子质量的测定
采用高效液相色谱法。色谱条件:配有2414 示差检测器的Waters e2695 高效液相色谱仪;UltrahydrogelTMLinear(300 mm×7.8 mm)凝胶柱;流动相 0.1 mol/L NaNO3;流速0.95 mL/min;柱温45 ℃;进样体积15 μL。
1.5.4 单糖组成分析
按照LIU等[17]的方法稍作修改。将5 mg 样品与2 mol/L 的三氟乙酸配制成5 mg/mL溶液于120 ℃金属浴条件下水解,利用高效离子交换层析结合脉冲电流检测器对单糖组成进行分析。
1.5.5 红外光谱分析
利用压片法将样品粉末与干燥的KBr混合于玛瑙研钵中并进行研磨,采用手动压片的方式,在500~4 000 cm-1采集红外光谱[18]。
1.5.6 核磁共振分析
利用0.5 mL D2O溶解20 mg多糖样品,采用Agilent 400 MHz核磁共振仪进行测定,采集样品的核磁共振光谱。
1.5.7 抗氧化活性的测定
1.5.7.1 DPPH自由基清除率的测定
DPPH自由基清除活性的测定如韦铮[19]所述,略有调整。将2 mL DPPH溶液和2 mL无水乙醇以不同浓度添加到2 mL样品溶液中。漩涡振荡后于室温下35 min避光反应,测定517 nm处的吸光度。通过公式(1)计算DPPH自由基清除率:
(1)
式中:Ri,多糖溶液(2 mL)和 DPPH(2 mL)溶液混合后的吸光度值;Rj,多糖溶液(2 mL)和无水乙醇(2 mL)的吸光值;R0,DPPH溶液(2 mL)和无水乙醇(2 mL)的吸光值。
1.5.7.2 ·OH清除率的测定
测定510 nm处的吸光度[20],用蒸馏水较零。按公式(2)计算:
(2)
式中:Qi,多糖溶液的吸光度;Qj,样品溶液在蒸馏水中的吸光度;Q0,蒸馏水吸光度。
1.5.7.3 还原力的测定
参照铁氰化钾法[21]。
1.6 数据处理与分析
采用Origin 8.5软件绘制图表并进行数据分析,KEGG分析代谢途径。
2 结果与分析
2.1 适应性驯化筛选结果
β-葡聚糖与碱性刚果红溶液的结合具有高序匹配性,室温下可以形成红色物质[22]。根据此特点,利用刚果红鉴别平板对菌种进行挑选,选择透明、凸起、菌落大、红色深的130株菌株进行24孔板高通量筛选,以β-葡聚糖产量和分子质量为指标,从中选取具有高菌种活力、高产量及低分子质量的12株菌株进行摇瓶复筛。复筛结果如图2所示。经过摇瓶复筛,发现在分子质量差异较小的前提下,有4株菌在100g/L发酵培养基中产β-葡聚糖的量较高,其中编号为 8E3T的菌株发酵产β-葡聚糖稳定性较高。将其命名为Agrobacteriumsp.WS-8E3T。

图2 摇瓶复筛结果Fig.2 Rescreening results of shaking flask
2.2 遗传稳定性
工业生产中菌种经过连续多次传代后,会出现菌种退化而致使生产性能下降的情况。为验证Agrobacteriumsp.WS-8E3T 的稳定遗传特性,连续传代培养了6次,测定各代发酵参数,实验结果如表1 所示。从表1 可以看出,该菌株在摇瓶发酵培养基发酵120 h后,菌体量在(3.07±0.17) g/L,β-葡聚糖产量在 1.39 g/L,可稳定产生分子质量在2 800~3 600 Da之间的新型低分子质量多糖BGOs,各项指标较稳定,具有较好的稳定性。

表1 Agrobacterium sp.WS-8E3T 的遗传稳定性测试Table 1 Genetic stability test of Agrobacterium sp.WS-8E3T
2.3 代谢途径分析
驯化株Agrobacteriumsp.WS-8E3T可以利用甘油生长并合成低分子质量β-葡聚糖,而甘油在土壤杆菌中代谢途径鲜有报道,但在Agrobacteriumsp.CGMCC 11546全基因组序列中却可查到甘油代谢相关基因,这是一种glp系统编码的沉默甘油分解代谢途径。基于此,初步绘制了土壤杆菌中甘油合成低分子质量β-葡聚糖的代谢途径(图3)。
如图3所示,甘油在通道蛋白协助下进入菌体内部,然后在甘油磷酸化激酶、3-磷酸甘油脱氢酶、磷酸戊糖异构酶的作用下形成3-磷酸甘油醛,进入糖酵解及糖异生途径,在糖异生途径中,3-磷酸甘油醛和磷酸二羟丙酮在1,6-二磷酸果糖激酶的作用下产生的6-磷酸果糖异构化为6-磷酸葡萄糖,6-磷酸葡萄糖变位成1-磷酸葡萄糖进入合成途径,在糖酵解途径中,3-磷酸甘油醛进入三羧酸循环途径[23]提供菌体生长和BGOs合成所需能量。结果显示,当驯化菌株以甘油为底物进行发酵时,合成BGOs的产率较低,原因可能是在代谢途径中的两段分支共存的条件下,大量ATP、UTP、(NADH+H+)、多种酶的合成所需Mg2+及能量因子的消耗降低了BGOs的合成能力。

图3 Agrobacterium sp.WS-8E3T利用甘油合成 BGOs代谢途径Fig.3 Metabolic pathway of Agrobacterium sp.WS-8E3T using glycerol for BGOs
2.4 产物组成及结构分析
2.4.1 紫外光谱分析

图4 多糖的紫外光谱图Fig.4 UV spectra of polysaccharides
从图4可以看出,在波长280 nm处[24]没有紫外吸收,说明经纯化得到的BGOs中蛋白质含量可以忽略不计,对后续分子特性实验无影响。
2.4.2 单糖组成及红外光谱分析
使用离子色谱仪和傅里叶红外光谱对新型多糖BGOs的单糖组成和官能团结构进行分析,结果见图5。
离子色谱仪共对比了8种单糖,各个组分的保留时间如图5-a所示。经测定,BGOs样品中只含有一组峰,其保留时间与标准糖混合溶液中的葡萄糖的保留时间相同,证明了样品是仅由葡萄糖单体组成的聚合物。
傅里叶红外光谱可以对糖苷键类型进行初步判断,例如吡喃型糖环只有2个特征强吸收峰、β-和β-吡喃型糖苷键分别在840和890 cm-1有特征吸收峰[17]。按照1.1.5所述的方法,对BGOs的官能团信息和糖苷键类型进行分析,特征吸收峰结果如图5-b 所示。BGOs在波数890.6和1 272.2 cm-1处有特征吸收峰,而在840和790 cm-1处无吸收峰,说明BGOs为β-糖苷键构型。另外在波数为3 351.7(—OH)、2 893.7 (—CH3—或—CH2)、1 657.4及1 272.2 cm-1处有多糖的特征吸收峰,而在1 616 cm-1处无—NH2的吸收峰,说明不存在蛋白质多糖,与紫外扫描光谱一致。1 028.9、1 166.6 cm-1处的吸收峰表示BGOs中的糖环构型是吡喃型。由此推测,BGOs为β-吡喃型葡萄糖苷键链接的多糖。

a-单糖组成分析图;b-红外光谱图 1-岩藻糖;2-鼠李糖;3-阿拉伯糖;4-半乳糖;5-葡萄糖; 6-木糖;7-甘露糖;8-果糖图5 BGOs的单糖组成及红外光谱分析Fig.5 The monosaccharide compositions analysis and FT-IR spectra of BGOs
2.4.3 核磁共振分析
核磁共振图谱可以分析多糖的糖苷键型,比如:氢谱中,α型糖苷键质子信号一般小于5 ppm,α型糖苷键大于5 ppm,碳谱中,异头碳和非异头碳的信号主要分别出现在90~110和60~85 ppm处,C-1的出峰位置基于α-构型和β-连接的化学位移范围分别是δ90-102和δ102-112[25]。按照1.5.6所述的方法,对BGOs的结构进行分析,结果如图6所示。
由图6-a可以看出,BGOs的H1质子信号出现在5.22 ppm处,说明是单一β-型糖苷键,且在5.22(s,1H,OH-6)、4.82(m,2H,OH-2,OH-4)、4.56(s,1H,OH-6)、3.92(s,1H,H-6)、3.65(m,2H,H-3,H-6)、3.43(m,3H,H-4,H-2,H-5) ppm 处出现异头质子信号,说明BGOs是由单一的β-1,3-糖苷键相连。由图6-b可以看出,BGOs只有一个异头碳信号,且它的主干信号均出现在109.69 (C-1)、85.38 (C-3)、83.39 (C-2)、77.55 (C-4)、81.85(C-5) 以及72.47 (C-6) ppm处,说明 BGOs是没有分支的单链。以上结果与红外光谱和单糖组成分析结果一致。
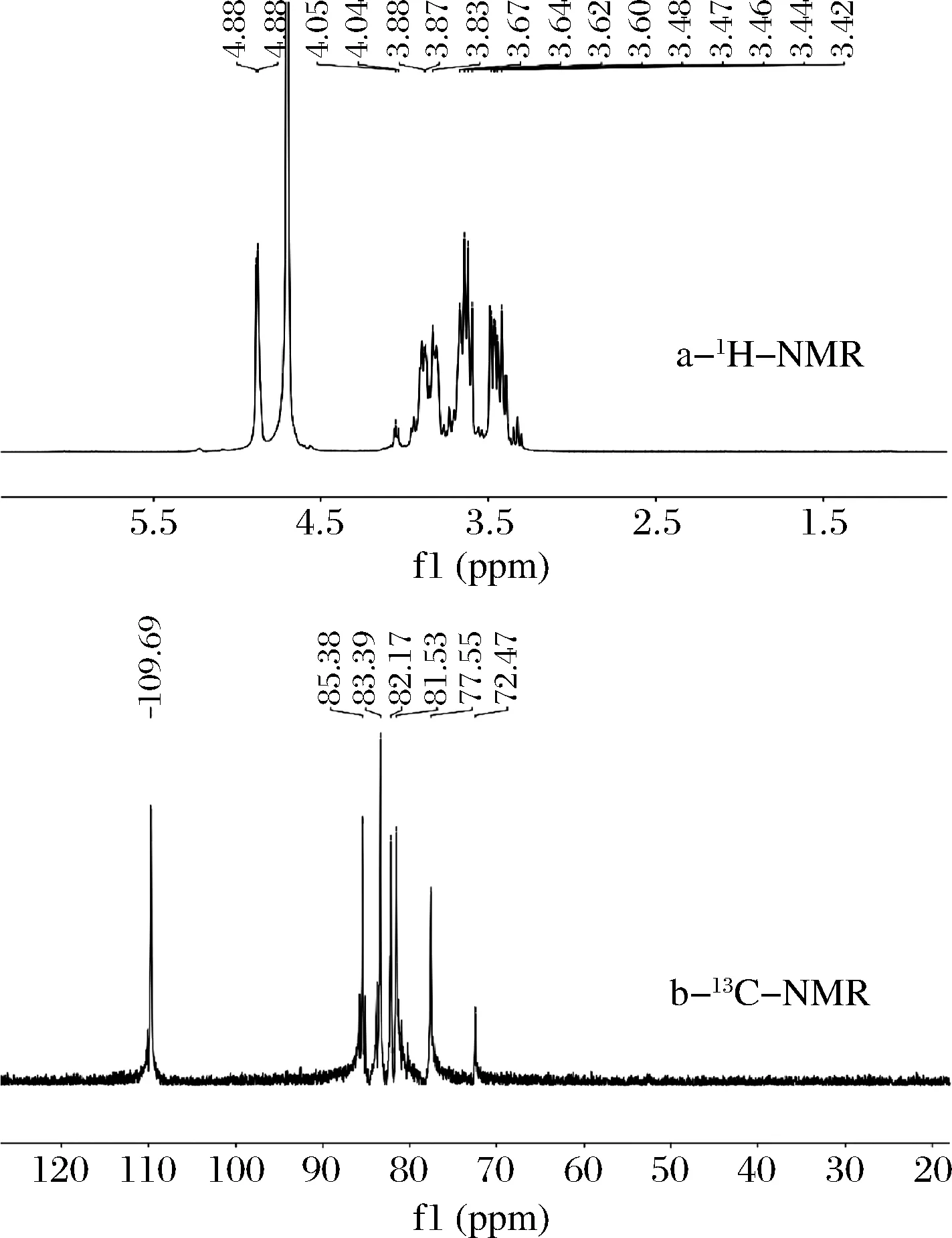
a-1H-NMR;b-13C-NMR图6 BGOs核磁共振图谱Fig.6 NMR spectra of BGOs
2.5 分子质量分析
高效凝胶过滤色谱法测定了纯化后多糖的分子质量(Mw)与保留时间(t)关系,以lgMw为纵坐标,t为横坐标,多糖分子质量的标准曲线如图7-a所示,为lgMw=-0.141 1t+6.068,R2=0.997 4。

a-多糖分子质量标准曲线;b-BGOs的高效凝胶色谱图图7 高效凝胶色谱图Fig.7 High performance gel chromatogram
BGOs分子质量如图7-b所示,样品的保留时间为18.167 min,由标准曲线计算得出其相对分子质量为3.218 kDa,研究表明,低分子质量β-葡聚糖更容易发挥其多功能性[26],通过适应性驯化的菌株利用甘油生产的BGOs分子质量分布均匀,将具有广阔的市场应用潜力。
2.6 抗氧化性能研究
2.6.1 DPPH自由基清除率
多糖溶液与DPPH自由基反应生成紫色,颜色变化程度与多糖清除自由基的能力有一定的剂效关系[27]。BGOs对DPPH自由基清除能力如图8-a所示。在与BGOs浓度相近的浓度下,抗坏血酸具有较高的DPPH自由基清除能力。当多糖质量浓度为1.0 mg/mL时,BGOs对DPPH自由基的清除能力接近(78.95±2.35)%,且增长趋势趋于平缓,许女等[28]研究表明,鸡腿菇子实体多糖质量浓度为2.0 mg/mL时,对DPPH自由基清除率为48.4%,说明BGOs在较低浓度下即可达到食用菌多糖同等效果。
2.6.2 ·OH清除率
图8-b显示,BGOs具有较强的·OH清除能力,这一发现与DPPH自由基清除能力的结果一致,在实验浓度范围内,BGOs对·OH的清除程度为(80.5±1.4)%。随着BGOs浓度的增大,·OH清除率随之增大,并且表现出了一定的伴随性。
2.6.3 铁还原力
在铁还原体系中,具有强还原力的多糖可以还原Fe3+为Fe2+,因此可以通过颜色变化(吸光值的变化)来判断多糖的还原能力。由图8-c可知,随着底物浓度的增加,BGOs呈现出一定程度的还原作用,当多糖质量浓度为1.0 mg/mL时,吸光值达到(1.70±0.04),说明BGOs可以作为一种良好的电子供应者。综上所述,通过对不同浓度BGOs作用下各抗氧化性指标的检测,表明BGOs具有良好的抗氧化活性。
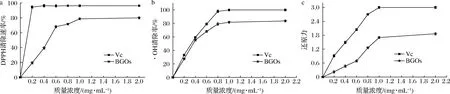
a-BGOs的DPPH清除速率;b-BGOs的·OH清除速率;c-BGOs的还原力图8 抗氧化活性测定Fig.8 Determination of antioxidant activities
3 结论
本研究将甘油作为碳源,采取梯度驯化的方法,通过40、60、80、100 g/L甘油连续传代培养选育,结合刚果红平板初筛、高通量筛选和摇瓶复筛的方法,以初始产率及分子质量为目标,筛选获得了1株以甘油为碳源、可稳定获得低分子质量多糖的高活力菌株Agrobacteriumsp.WS-8E3T,该菌株在100 g/L甘油质量浓度下发酵120 h,可稳定产生分子质量在2 800~3 600 Da的新型低分子质量多糖BGOs。经过结构鉴定,判断该BGOs为β-1,3-葡聚糖,并具有一定的抗氧化活性。在实验浓度范围内,BGOs的DPPH自由基和·OH清除效果可达到抗坏血酸的80%,还原力可达到抗坏血酸的50%,随着质量浓度的增加,呈现出一定的浓度依赖性,表明其具有良好的抗氧化活性。
研究结果显示,通过驯化的方式获得低分子质量多糖具有可行性。该多糖呈现出的抗氧化活性,体现出了其作为功能性多糖的多应用性。此外还需进一步优化培养基组成、探索代谢途径中相关基因的表达,以提高BGOs的产量并探究BGOs的潜在功能性,进一步确定BGOs作为新型营养素、食品添加剂或抗氧化补充剂的适用性。

