动静脉内瘘成熟障碍机制研究进展
魏思琪 综述 孔德阳 审校
《中国血液透析用血管通路专家共识(第2版)》[1]指出,自体动静脉内瘘(AVF)是维持性血液透析患者首选长期性血管通路。AVF成熟障碍仍为血管通路领域的主要临床问题,即初次行AVF成形术,术后12周内瘘仍发育不良,不能满足透析需要,即穿刺失败和(或)血流量不足。AVF成熟障碍多与静脉内膜过度增生致血管狭窄相关。由于缺乏对AVF成熟障碍发病机制的深入了解,仍缺少针对性解决方案。
迄今为止,AVF成熟障碍治疗大多于其发生后启动,缺乏早期干预措施。临床上迫切需要有效预防AVF成熟障碍的方案,促进内瘘成熟,延长其使用寿命。本文综述了AVF成熟障碍最新生物学机制及临床研究进展,已期为提高AVF成熟率及延长使用寿命提供理论基础。
血流动力学与动静脉内瘘成熟障碍
血流和压力对血管的调节血管壁承受的机械应力包括流体壁剪切力(FWSS)和圆周应力(CWS)。FWSS是液体在某个物体表面流动时产生的单位面积上的摩擦力[2],是重要血流动力学参数,其大小及方向改变影响细胞增殖和血管重塑。单向、层流和高FWSS管壁区域血管腔直径增大,伴随某些机械转导信号激活,促使内皮细胞静止,一氧化氮释放,抑制内膜增生或动脉粥样硬化发生;而低或振荡剪切力的湍流通常发生在自体动脉血管分叉处或旁路移植物-动脉吻合处,此种形式的血流方式及剪切力使内皮细胞活化,并减少一氧化氮释放,促使内膜增生或动脉粥样硬化发生[3]。此外,管壁扩张引起的拉伸作用使血管壁承受的CWS参与了动脉重塑过程。血压升高和血管壁的拉伸作用,在组织水平上使动脉内膜增生和血管壁增厚;在细胞水平上刺激动脉平滑肌细胞增殖。
血流对AVF的影响内瘘流出道下游血管阻力减小和吻合处血流方向改变使AVF血管处于高血流、高压力梯度及吻合区域血液扰动状态,术后血流量即刻升高,诱导血管扩张促使内皮细胞保持静止,FWSS回落至正常水平;高压力梯度促使平滑肌细胞增殖与迁移;吻合口区域血液扰动状态使内皮细胞活化,促炎、促增殖及促血栓形成,最终致AVF成熟障碍。
AVF与FWSS和静脉内膜增生之间的关系已受关注[4-5],在猪AVF模型中,FWSS与平均静脉内膜/中膜厚度比呈负相关,早期低FWSS和高振荡剪切指数与最大静脉内膜/中膜厚度比相关。相比自体静脉,上述因素影响下的血压和血管壁压力可增加至少10倍,并且血管内膜增生易感部位比抵抗部位更易暴露于强拉伸力和壁应力之下,意味AVF更容易发生新生血管内膜增生。
动静脉内瘘成熟障碍病理生理机制
内膜增生与外向重构既往认为,静脉内膜增生是导致AVF成熟障碍的主要病变;但越来越多的研究证实,术前预先存在的静脉内膜增生及术后新生静脉内膜增生与AVF预后缺乏相关性[6-7]。目前,血管外向重构受损与AVF成熟障碍备受关注。在针对“术前静脉内膜增生作为AVF成熟障碍的预测指标”的研究中,Cheung团队[7-8]发现,术前静脉内膜增生与术后6周AVF狭窄无关;术前血流和硝酸甘油介导的肱动脉扩张与术后6周的AVF流量和血管直径呈正相关。该团队证实,影响AVF成熟的因素是原有动脉异常(解剖上管径细小或动脉粥样硬化),而非静脉病理改变;血管平滑肌细胞松弛导致的血管扩张可能是参与AVF外向重构的机制之一,改善慢性肾脏病患者动脉功能的药物或许会促进AVF成熟。
血管中膜纤维化主要表现为Ⅰ型和Ⅲ型胶原蛋白沉积,血管硬度增加,其与血管扩张及AVF成熟相关性尚存争议[9];Shiu等[10]证实动脉中膜纤维化与AVF直径和流量增加相关,促进AVF成熟,或许与动脉中膜纤维化增加内瘘压力有关。Martinez等[6]报道,内膜增生在不同程度的术后静脉中膜纤维化中对AVF成熟影响不同;而术前静脉中膜纤维化则与AVF成熟无关。亦有报道,慢性肾脏病患者术前上肢动脉中膜纤维化与AVF成熟障碍发病机制无相关性[11];术前动脉微钙化可能是AVF成熟障碍的预测指标。
细胞外基质参与血管外向重构的主要血管细胞外基质(ECM)成分是胶原蛋白和弹性蛋白,它们的降解依赖多种基质金属蛋白酶的激活。弹性蛋白是血管平滑肌细胞和各种纤维母细胞分泌的弹性蛋白单体交联的不溶性聚合物。弹性蛋白稳态已经成为血管外向重塑的一个重要决定因素。Wong等[12]在单倍体缺陷原弹性蛋白基因敲除小鼠的AVF失败模型中观察到静脉外向重构增加,表明弹性蛋白有抑制AVF外向重构的作用,其降解或许促进AVF成熟。
平滑肌细胞在AVF成熟过程中的双重作用Liang等[13]利用小鼠AVF模型证实,动脉平滑肌细胞是AVF狭窄病变主要细胞来源,靶向抑制转录调控内子(RBP-Jκ)及成纤维细胞特异性蛋白1(FSP-1)信号转导可以干扰动脉平滑肌细胞向新生内膜迁移,提高AVF远期通畅率。Zhao等[14]对平滑肌细胞在AVF中的双重作用进行了研究,观察到分化的平滑肌细胞主要参与中膜增厚,促进静脉成熟;而去分化的平滑肌细胞是AVF新生内膜的主要细胞成分,导致新生内膜增生,AVF通畅性丧失。
AVF成熟障碍的新治疗靶点与信号通路研究进展
新发现的基因与通路
弹性蛋白 弹性蛋白可以抑制AVF外向重构,弹性蛋白酶对血管ECM的修饰可以引起静脉和动脉的即刻以及持续扩张而使血流量增加。伏帕尼酶(Vonapanitase)是重组人Ⅰ型胰弹性蛋白酶。在AVF形成过程中局部应用后,会被迅速吸收到最外层血管层,破坏弹性蛋白纤维抑制AVF外向重构。一项应用伏帕尼酶进行的前瞻性、双盲、随机对照研究(Ⅲ期临床试验)[15]结果显示该药物未能显著改善内瘘初级通畅率,但能改善次级通畅率和内瘘血液透析使用率。
Eph-B4-Cav-1轴 Eph-B4是PI3K-Akt信号通路上游激动剂,促进细胞迁移和增殖,在血管重塑中调节细胞基本功能,是成年静脉系统成熟的标志。Protack等[16]利用小鼠和人类AVF模型发现,与同一受试对象正常静脉对比,功能良好的AVF吻合口静脉Eph-B4高表达;Eph-B4基因缺失小鼠AVF静脉内膜增生增强,上调Eph-B4表达可使血管壁变薄,AVF通畅性明显改善。窖蛋白1(caveolin-1,Cav-1)是胞膜窖的主要成分和支架蛋白质,参与调节血管重塑和动脉粥样硬化。Hashimoto等[17]证实Cav-1是Eph-B4介导的内瘘成熟的关键调节者,机制可能是抑制一氧化氮合酶(eNOS)活性,影响静脉重塑过程。
综上所述,靶向激活Eph-B4表达或许成为减轻静脉内膜增生的新策略;同时,针对血管内皮机械传感器Cav-1的调节,可能是改善AVF成熟的新方案。
松弛素(RLN) RLN是一种抗纤维化分子,与松弛肽家族肽受体1(RXFP1)结合后作用于血管系统,发挥血管舒张、ECM重塑和减轻炎症的作用。Bezhaeva等[18]发现RXFP1基因敲除小鼠较野生小鼠高表达弹性蛋白,原因在于该小鼠静脉流出道的弹性蛋白酶活性显著降低,阻碍弹性蛋白降解;同时,RXFP1基因敲除后可能会激发AVF的血管炎症反应,继而刺激血管平滑肌细胞增殖,使得AVF外向重塑受限。上述研究提示我们可以通过调节RLN 2-RXFP1信号途径改善AVF通畅性。
Toll样受体4(TLR4)信号 TLR4可诱导促炎信号级联反应。RP105是多种细胞中TLR4信号的重要生理调节因子,属内源性Toll受体4激动剂。Bezhaeva等[19]发现RP105在内瘘静脉流出道狭窄性病变中高表达,敲除鼠RP105基因的AVF外向重塑得到修复。由此可见,AVF抗炎干预的疗效依赖于炎症-平滑肌细胞增殖-血管外向重塑的交互作用下的炎症级联反应的精确靶点。
干细胞和转录后调控
干细胞 间充质干细胞(MSC)具有抗炎作用,在血管损伤修复与再生过程中显示了广泛的治疗前景。Yang等[20]将人脂肪组织MSC移植到小鼠AVF模型的静脉流出道,可以通过降低单核细胞趋化蛋白1(MCP-1)基因表达,使静脉新生内膜增生减少,细胞增殖减少和凋亡增加,有利于血管重塑。
miRNA miRNA是约22个核苷酸长非编码核糖核酸,是基因表达、细胞功能和疾病重要调节因子,一些miRNA与血管重塑相关。Wang等[21]建立了小鼠AVF模型,发现miRNA-155基因敲除小鼠AVF内膜增生明显减轻。Lv等[22]进行了一项微阵列研究,比较行AVF修复手术患者的狭窄静脉样本和AVF成形手术患者的对照静脉样本之间miRNA表达谱的差异,发现MAPK通路可能在AVF狭窄的发病机制中发挥作用。中国台湾一项单中心、前瞻性、队列研究[23],将10例行AVF狭窄修复手术或血管通路动脉瘤切除术的患者(其中5例内瘘显著狭窄、5例内瘘无明显狭窄)以及10例行AVF成形术的患者组成手术队列,而另一队列为60例行血管成形术的患者,该研究不仅发现多种miRNA在静脉增生内膜表达发生变化;该研究还证实,手术队列中,AVF静脉狭窄组miRNA-21表达明显上调,而在无狭窄静脉中未见表达;血管成形术队列中,术后2d血miRNA-21表达增加,血miRNA-21表达增加>0.35的患者AVF狭窄风险高,证实了miRNA在AVF的狭窄静脉段中异常表达,血miRNA-21水平升高是AVF狭窄的危险因素。通过调节相关miRNA表达水平,或许能为内瘘成熟提供新的治疗靶点。
动静脉内瘘成熟障碍临床研究进展
临床试验来自国立卫生研究院透析通路联盟(DAC)的两项研究评估了抗血小板药物的疗效。在 DAC进行的AVF研究中,发现氯吡格雷显著降低了AVF早期血栓形成率,但并不能改善AVF的临床可用性[24]。Irish 等[25]报道鱼油未能改善AVF术后12个月时AVF血栓形成。Wong等[26]观察到包裹了泼尼松的脂质体经小鼠静脉注射后积聚在AVF吻合口周围,能够抑制血管炎症反应,增强了静脉外向重构,通过实验评估发现了脂质体泼尼松促进AVF成熟的有效性。
改善血流动力学近年,计算流体力学模拟研究进展为评价血流动力学和血管重塑之间的关系提供了重要支持,数据模拟表示AVF吻合角度越小,流动受扰面积越小,并已有针对手术技术或装置的探索,如应用于临床AVF建立时的层压医疗技术(VasQTM)和生物连接系统(OptiflowTM)均能够减少吻合处的血液流动干扰,提高AVF通畅率。VasQTM是镍钛合金植入物,外部环绕静脉,紧贴吻合处动脉外层,是通过微小湍流优化AVF几何结构的设备。Karydis等[27]将40例行AVF患者分为置入VasQTM组及标准手术对照组,术后随访6月发现,VasQTM可以改善血流动力学紊乱的影响,提高AVF通畅性(图1)。OptiflowTM是放置在吻合口内部的硅化聚氨酯吻合口连接器,与血流直接接触,用以连接AVF的动静脉并形成对称的血流进而改善血流动力学,有利于AVF成熟[28](图2)。
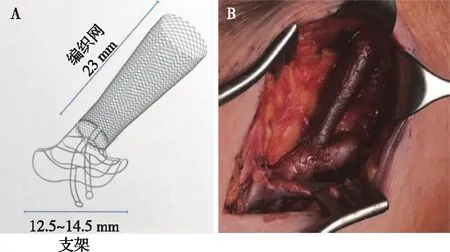
图1 A:层压医疗技术(VasQTM)装置;B:VasQTM在动静脉内瘘吻合口和近吻合口区域处于扩张状态[27]
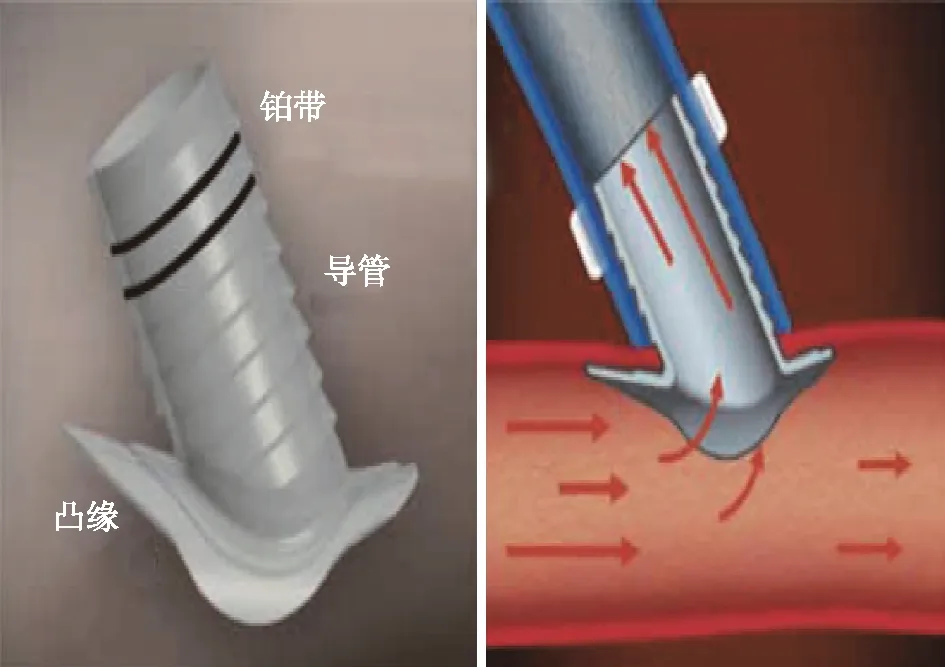
图2 生物连接系统(OptiflowTM)吻合连接器[28]
血管腔内治疗
经皮球囊扩张血管成形术 经皮球囊扩张血管成形术(PTA)是治疗AVF成熟障碍的主要方法。然而,PTA技术改善AVF成熟障碍存在早期成功率高,远期疗效不理想的情况,主要原因是AVF术后再狭窄部位出现细胞增殖及其活性增加[29]。倪其泓[30]等对21例AVF成熟不良患者应用超声引导下PTA技术进行治疗,20例获得成功,术后6个月及术后12个月的一期通畅率分别为70%和55%。与既往的研究[31]一致,经PTA治疗后的AVF成熟不良患者可维持6个月以上的血液透析。
血管内支架植入技术 尽管,PTA是针对当前AVF狭窄的主要疗法。然而,PTA术后可以造成血管内膜增生加重,针对PTA术后的支架治疗可以减少血管重塑。天然血管支架技术是一种新型光化学技术,利用4-氨基-1,8-萘酰亚胺(4-amino-1,8-naphtalimide)分子,在450 nm 光的作用下促进血管壁内ECM蛋白氨基酸之间的共价结合,无需异物置入体内就可以使得血管扩张。Shiu等[32]利用该技术对大鼠AVF治疗发现可以促进血管外向重塑使管腔扩张,促进内瘘成熟。
远红外线治疗 远红外线治疗(FIR)是通过使用5~25 mcm波长范围的电磁波改善AVF血流和内皮功能。Hadimeri等[33]利用FIR在透析过程中患者的AVF吻合口上方20 cm处进行照射40 min,结果发现内瘘的血流速度及血管直径增加。Lin等[34]证实,FIR增加AVF血流量的机制可能是激活HO-1途径以及减轻内皮细胞的炎症反应。
血管内皮生长因子A(VEGF-A)基因治疗 基因治疗在AVF成熟中属于新兴治疗手段,但基因多态性易导致通路治疗失败,最主要的原因是与内皮损伤或增加血栓风险相关。VEGF基因表达增加与AVF高血栓风险相关,抑制内皮VEGF-A表达可以减缓血管向心重塑的过程,提高AVF通畅率。
小结:AVF成熟障碍是当前血管通路领域面临的主要临床难题。目前,尚无有效的预防和治疗方案。尽管了解动静脉内瘘成熟障碍的机制有助于推进潜在治疗手段的发展。然而,应对这一问题的解决方案除上述提及的治疗新方案,其他的因素如内瘘护理等,尤其是对患者的选择,同样会影响内瘘的成功使用和持久性。因此未来优化血管通路理想战略亟需将护理因素、患者选择及可用的生物疗法(正确的治疗、合适的患者、合适的时间及正确的原因)结合起来。

