蜂巢培养系统在细胞扩增培养过程中的优势与应用
程锦生
(上海东富龙医疗装备有限公司,上海 201108)
关键字:细胞药品化;蜂巢培养系统;合规性;成本控制;规模化
细胞治疗即来源于人自体或异体的体细胞,经体外操作后回输(或植入)人体的治疗方法[1]。细胞治疗产品是指人源的活细胞产品,包括由细胞系,以及来源于自体或异体的免疫细胞、干细胞和组织细胞等生产的产品[2]。据不完全统计,目前全球有超过1 000项已获批或正在研究的细胞疗法,其中占比最大的当属免疫细胞治疗中的嵌合受体抗原T细胞(CAR-T)以及干细胞疗法中的间充质干细胞MSC细胞治疗产品,是细胞治疗的典型代表。我国2020年CDE共受理了25个细胞治疗产品的IND申请,其中CAR-T类产品为14个,间充质干细胞产品5个,占据细胞治疗产品的绝大多数。虽然国内暂无上市的细胞治疗产品,中国的细胞治疗产品距离上市越来越近,在2021年有望出现第一个批准上市的CAR-T产品。
细胞治疗及细胞技术产品的创新发展,对监管法规提出了巨大挑战。对于细胞治疗产品监管政策,我国在不断摸索中逐渐建立完善,2009年国家卫生部首次将部分免疫细胞治疗纳入第三类医疗技术进行准入管理,2017年12月22日,原国家食药监总局发布《细胞治疗产品研究与评价技术指导原则(试行)》,法规指出:“细胞治疗产品可按照药品管理相关法规进行研发和注册申报”,并在药学研究、非临床研究、临床研究等方面进行了细化的规范指导[3],该法规标志着我国正式开启细胞治疗产品的注册上市流程。2018年2月9日药品评审中心组织召开了“CAR-T细胞治疗产品申报临床试验药学研究和申报资料基本要求”研讨会,形成了《细胞治疗产品申请临床试验药学研究和申报资料的考虑要点》,该文件对生产原料、生产工艺、质量及稳定性研究等要点进行阐述,为同类药品的研发和申报资料准备提供参考[4]。在此之后,又相继出台了一系列法规,对细胞治疗的药品管理法规进行进一步完善,基本实现细胞治疗产品从医疗技术向药品的转化,奠定了细胞治疗药品化的基础。
细胞治疗产品药品化生产标志着细胞产品生产方式的巨大转变,细胞产品的生产与质量控制体系需要根据GMP药品法规进行改革,针对生产过程中的关键因素,人、机、物、法、料、环的管控以及各个制备生产阶段,都需要按照GMP法规进行适应性变化,因此,细胞治疗产品药品化生产是对细胞治疗产品的系统性挑战,是细胞生产作业方式的全面、系统、规范化的升级改革。如何确保GMP合规性并同时满足成本控制及规模化要求是每个细胞治疗机构面临的共同问题。尤其在仪器设备方面,细胞治疗药品化生产的GMP法规挑战尤其严峻,传统化细胞生产设备目前已满足不了GMP法规、规模化及成本控制要求,尤其在细胞培养上,传统的细胞培养设备功能设计未考虑GMP法规要求,安全性及数据追溯存在不足,多数设备仅供研究使用,而且不符合成本控制及规模化生产要求,亟待革新。蜂巢培养系统经过我们长期测试研发,在充分考虑GMP合规性的基础上,重点关注成本控制及生产效率提高,配合自主GMP全站系统设备使用,是细胞药品化及规模化生产的有效解决方案。
1 蜂巢培养系统及其优势
蜂巢培养系统即集成独立密闭可扩展培养箱功能单元、GMP符合性上层控制及完整数据追溯系统及蜂巢式主体结构框架于一体的细胞治疗产品细胞培养生产系统设备,在满足医用二氧化碳培养箱法规对工作环境、外观及结构、气体浓度及温湿度控制等要求的基础上[5-6],可实现不同类型/批次细胞治疗产品物在同一系统设备下同时相互隔离培养,在密闭隔离条件下提供细胞培养所需环境条件同时,满足GMP对软件系统控制及数据管理及追溯的要求。该系统主要分为电气控制系统、RTP(无菌快速对接)培养箱及蜂巢式主体结构框架三个部分,如图1所示。
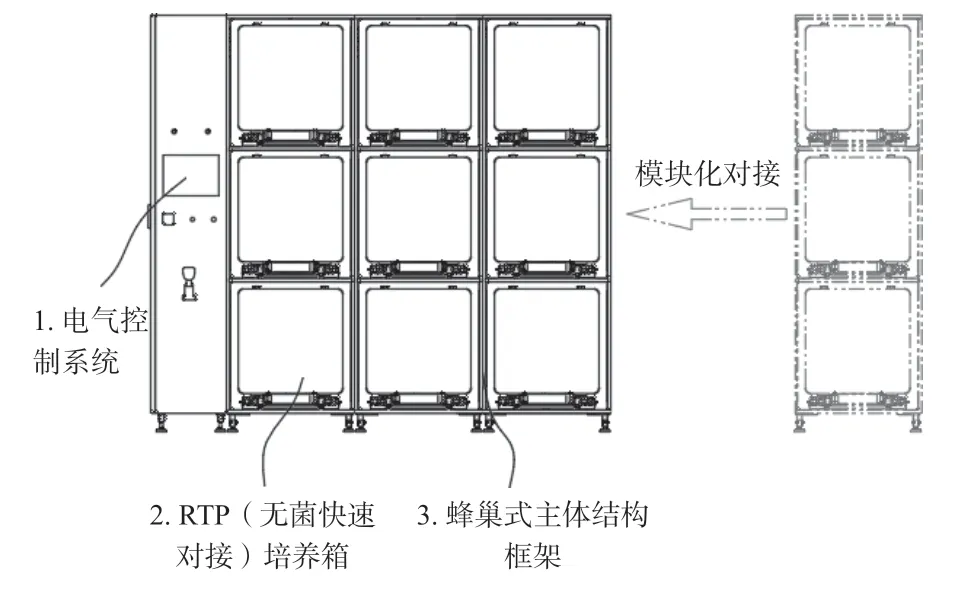
图1 蜂巢培养系统示意Fig.1 Beehive Incubator management system
1.1 电气控制系统
蜂巢培养系统的电气控制系统集电气控制与数据管理为一体,系统通过主控制计算机实现对每一个RTP培养箱模块实现独立平行控制,提供细胞培养所需温度、气体及湿度环境。数据管理方面,系统具备三级权限设置及扫码识别功能,可以生产批次为单位记录所有相关操作信息并以工作日志体现,满足FDA电子记录和电子签名相关要求。电气控制系统与RTP培养箱之间采用无线通讯(WIFI)技术实现信号连接,实时监控追踪检测培养过程中的关键培养技术参数,并在异常出现时及时预警,提醒人工干预,所有培养参数可按照指定取样间隔进行自动化整理归纳,形成连续式批培养生产记录。
1.2 RTP(无菌快速对接)培养箱
蜂巢培养系统的RTP培养箱模块,每个模块都是独立的培养控制单元,RTP培养箱是密闭的培养系统,气体进出均采用0.22微米空气过滤器,使之与其他RTP培养箱模块实现空间上的完全隔离,可以实现多批次同时培养。RTP培养箱采用航天对接器的原理,将RTP(快速转运接口)应用到培养箱上,可在密闭条件下与多设备实现无菌密闭式对接,在密闭无菌的环境下完成相应工艺工序。RTP培养箱系统采用过氧化氢灭菌,灭菌效果能达到6 log,在批次培养转换时,可以对RTP培养箱腔体内部进行彻底灭菌。
1.3 蜂巢式主体框架结构
以类似蜂巢式的排列方式对RTP培养箱模块进行组合排列,有效利用空间,提高空间利用率。
比较传统的细胞培养箱,蜂巢培养系统在细胞治疗产品药品化生产应用上具备诸多优势,首先体现在GMP合规性上,蜂巢培养系统是可自动化灭菌的密闭式培养设备,可有效减少污染和交叉污染风险。蜂巢培养系统配功能完备的电气控制系统,能够实现培养过程的全程监控与控制,生成可供追溯的记录。其次是成本控制及生产效率,蜂巢培养系统属于密闭培养设备,根据《GMP附录-细胞治疗产品》法规要求,蜂巢培养箱的背景环境可以为D级洁净环境并且满足多批次同时培养要求,再者蜂巢培养箱系统的蜂巢式结构可有效提高空间利用率,因此可以大幅减少厂房投入并提高生产效率。
2 蜂巢培养系统在细胞药品化生产中的应用
蜂巢培养系统的设计功能满足多种细胞治疗产品的药品化生产工艺要求,包含但不限于各种免疫细胞及干细胞产品。为了验证蜂巢培养系统在细胞治疗产品生产中的实际应用效果,依托东富龙生物技术模拟验证实验室,以传统培养箱为对照组,选择细胞治疗产品的代表性培养生产工艺对蜂巢培养箱功能进行验证测试,验证测试D级环境背景下蜂巢培养系统的细胞培养效果以及无菌性保证,进而确认其是否能够满足细胞药物制备生产规范及工艺的要求。
2.1 人外周血来源的T淋巴细胞制备测试验证
2.1.1 验证方案
按照T淋巴细胞制备标准作业规程进行T扩增放大培养。当细胞总数达到2×109以上时,按1×106mL接种至10个225 T的培养瓶,平均分为2组,每组5个样本,标注蜂巢培养系统及传统培养箱组并编号后,分别置于后分别置于传统培养箱、蜂巢培养系统中培养,每天取样检测记录细胞数,每3 d按照1×106进行扩增,培养完成后进行内毒素及无菌检测测试,并对比最终细胞收获量及细胞生长过程曲线。
2.1.2 验证结果
2.1.2.1 T细胞生长记录
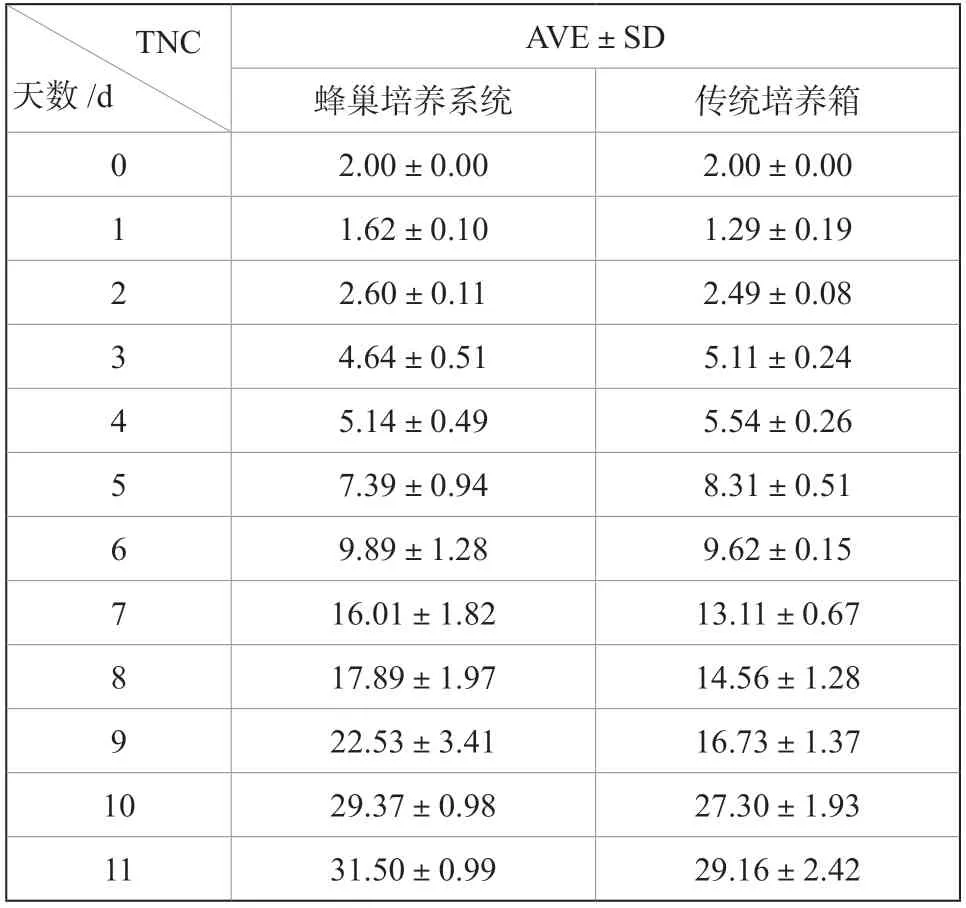
表1 T细胞生长记录(数据来自验证实验室)Tab.1 T cell expension daily test records
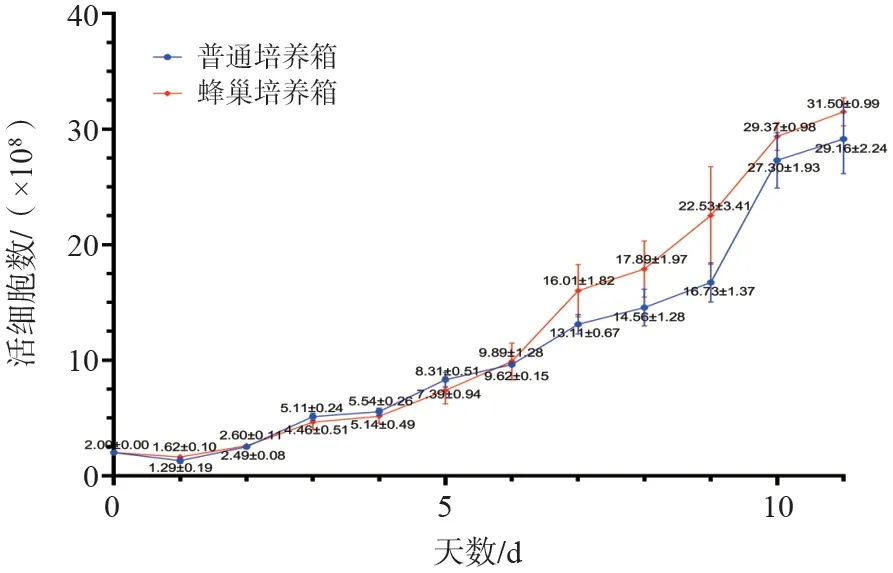
图2 T细胞生长曲线对比(数据来自验证实验室)Fig.2 T cell expension profile
2.1.2.2 内毒素及无菌检测,见表2。
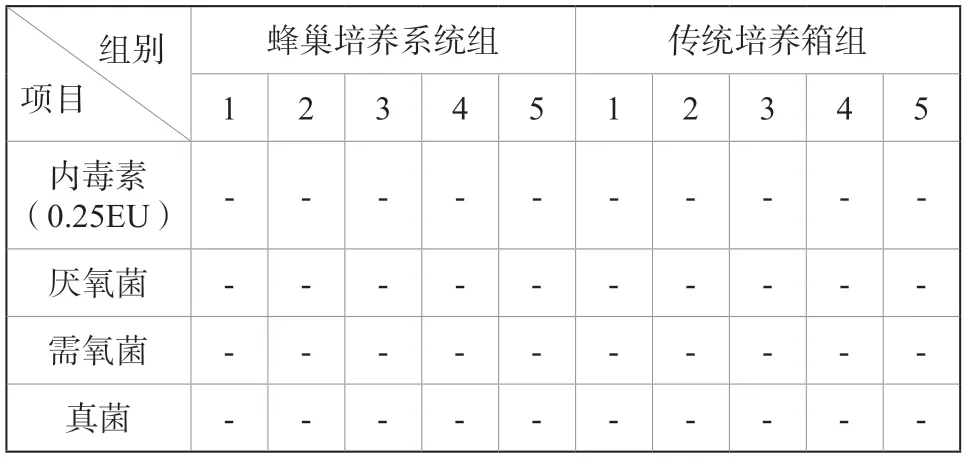
表2 T细胞内毒素及无菌检测记录(数据来自验证实验室)Tab.2 T cell endotoxin and sterility test records
2.1.2.3 验证结论
蜂巢培养系统组与传统培养箱组培养组T细胞的扩增生长曲线基本一致,从生长曲线上看,第6天开始,蜂巢培养箱组的细胞扩增生长速度占据一定优势。经过11 d的培养后,T淋巴细胞的活细胞总数(TNC)分别为(29.16±2.24)×109与(31.50±0.99)×109,P= 0.080(P>0.05)。蜂巢培养箱组获得的T细胞活细胞总数(TNC)高于传统培养箱,但两者无显著差异(P>0.05)。内毒素及无菌检测结果均为阴性,蜂巢培养系统能够有效提供无菌保障。
结论:D级环境背景下蜂巢培养系统可以根据需要提供适宜的T生长环境及无菌性保证,满足以T细胞治疗产品制备生产工艺要求。
2.2 人脐带来源的间充质干细胞传代培养测试验证
2.2.1 验证方案
冻存的脐带间充质干细胞(MSCs)P3代种子细胞,按照脐带间充质干细胞制备标准作业规程处理,P3代种子细胞解冻复苏后按4 000 cm2的密度接种至10个175 T的培养瓶中,平均分为2组,每组5个样本,标注蜂巢培养系统组及传统培养箱组并编号后,分别置于传统培养箱、蜂巢培养系统中培养,第3天观察拍照记录并换液,第6天观察并进行消化收集,计算细胞收获量,之后按4 000 cm2接种继续培养,培养完成后对细胞进行内毒素及无菌检测测试,并对比最终细胞收获量、细胞生长情况及二倍增长时间。
2.2.2 验证记录
2.2.2.1 MSCs细胞生长记录
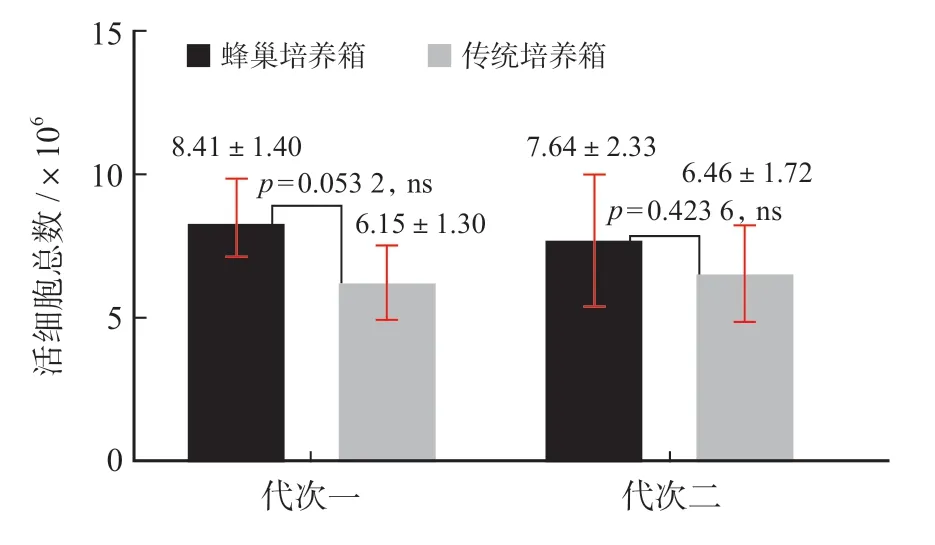
图3 MSCs活细胞总数(TNC)对比(数据来自验证实验室)Fig.3 Total number of viable MSCs
2.2.2.2 内毒素及无菌检测
表3 MSCs内毒素及无菌检测记录(数据来自验证实验室)Tab.3 MSCs endotoxin and sterility test records
2.2.2.3 验证结论
连续2代MSCs细胞培养,蜂巢培养箱组所获得的MSCs活细胞总数(TNC)均高于传统培养箱组,但二者均无明显差异(P>0.05)。代次一,蜂巢培养箱组MSCs细胞的二倍扩增时间明显低于传统培养箱组(P<0.05),代次二,蜂巢培养箱组MSCs细胞的二倍扩增时间低于传统培养箱组,但二者无显著差异(P>0.05)。内毒素及无菌检测结果均为阴性,蜂巢培养系统能够有效提供无菌保障。
结论:D级环境背景下蜂巢培养系统可以根据需要提供适宜的MSCs生长环境及无菌性保证,满足以T细胞治疗产品制备生产工艺要求。
2.3 蜂巢培养系统在细胞药品化生产中的应用总结
T细胞及MSCs培养是细胞治疗产品培养生产的典型代表,分别代表了免疫细胞治疗及干细胞治疗培养技术,其培养的参数条件要求同样适应于其他细胞治疗产品培养。验证结果表明蜂巢培养系统在满足法规的基础上,可根据需要提供适宜的T细胞、MSCs生长环境及无菌性保证,满足细胞药品化生产的培养工艺要求,该结论也同样适应于其他细胞治疗产品。因此,蜂巢培养箱系统可广泛应用于多种细胞治疗产品的细胞药品化生产。
3 结束语
蜂巢培养系统从GMP合规性出发并结合细胞培养生产工艺要求,满足多种细胞培养工艺要求并大幅提高生产效率,是细胞药品化、规模化生产的有效解决方案,可广泛应用于多种细胞治疗产品的药品化生产。我国目前大多数细胞治疗技术产品处于研发及IND申报阶段,蜂巢培养箱系统的法规符合性优势,可有力支持研发和IND申报,进而推动细胞治疗产品发展。

